利用乙醇发酵副产CO2培养富含淀粉亚心型四爿藻作为其补充原料
2011-02-09廖莎姚长洪薛松张卫白凤武
廖莎,姚长洪,薛松,张卫,白凤武
1 大连理工大学生命科学与生物技术学院,大连 116024
2 中国科学院大连化学物理研究所 海洋生物产品工程组,大连 116023
3 中国科学院研究生院,北京 100049
4 Flinders Centre for Marine Bioprocessing and Bioproducts, Flinders University, Bedford Park, Adelaide, SA5042, Australia
基于可再生生物质资源生产生物燃料是解决当前石油资源短缺,石油基燃料及产品大量消费导致温室气体总量不断增加等诸多问题的有效途径之一。
与高等植物相比,微藻具有光和效率高、单位面积生物量产量大的突出特点,已经成为国内外生物能源基础研究和技术开发的热点,但目前的研究工作主要集中在产油微藻生产生物柴油[1],对富含淀粉可用于燃料乙醇生产的微藻却很少关注。
能源微藻应该采用户外开放模式直接利用太阳光低成本培养[2],但这种培养模式不可避免面临两大突出问题:一是CO2无法向密闭的光反应器培养那样可以通过循环使用来提高其利用效率,因此CO2作为原料消耗的成本将十分可观;二是培养液中藻细胞密度很低,从大量培养液中分离回收微藻的能耗成本会很高。
乙醇发酵副产与乙醇产量基本相当的 CO2,目前由于没有经济可行的利用渠道而直接排放。这种发酵产生的 CO2,与热电和冶金等行业产生的烟道气相比,不仅纯度高,不含有害杂质,而且温度适宜 (烟道气余热回收后的温度仍然远远高于微藻培养温度,由于气体传热效率很低,因此需要换热面积庞大的换热设备将低温烟道气冷却降温),更适宜于微藻培养。如果用来培养富含淀粉的微藻,利用乙醇发酵系统自身产生的不超过0.05 MPa的微压力直接输送到微藻培养系统,微藻培养的CO2原料成本可以显著降低,而收集的微藻生物质可以直接用来作为淀粉质原料燃料乙醇生产的补充原料。
绿藻是一类积累淀粉作为自身能源的藻类,包括小球藻Chlorella vulgaris[3]、斜栅藻Scenedesmus basilensis[4]和莱茵衣藻Chlamydomonas reinhardtii[5]等。本实验室筛选得的亚心形四爿藻 Tetraselmis subcordiformis为一株海洋绿藻。与淡水藻相比,海水藻培养可以减少对淡水资源的需求,在淡水资源紧张的今天,有较好的应用前景。初步研究工作表明,此藻有较好的淀粉积累能力。
本文首先研究了T. subcordiformis的培养,进而对乙醇发酵与 T. subcordiformis培养耦合的可行性进行了分析,在此基础上建立了乙醇发酵偶联微藻培养系统,探讨了这类微藻生物质作为淀粉质原料乙醇发酵补充原料的可行性。
1 材料与方法
1.1 实验材料
1.1.1 菌种和藻种
Saccharomyces cerevisiae用于乙醇发酵,由大连理工大学生物工程系保藏。
T. subcordiformis为一种海洋单细胞浮游藻类,属绿藻门 Chlorophyta,绿藻纲 Chlorophyeeae,团藻目Volvocales,衣藻科Chlamydomonaeeae,四爿藻属 Tetraselmis,适应性强,生长繁殖迅速,通过光合作用可在胞内积累淀粉,由中国科学院大连化学物理研究所海洋生物产品工程组保藏[6]。
1.1.2 培养基
酵母斜面培养基 (g/L)[7]:葡萄糖20,酵母粉5,蛋白胨5,琼脂 15,灭菌后冷却到室温,接种后恒温30 ℃培养至菌落饱满,作为斜面种子,4 ℃保藏。
酵母种子培养基 (g/L)[7]:葡萄糖 10,酵母粉20,蛋白胨20,121 ℃灭菌15 min,冷却后使用。
酵母扩大培养及乙醇连续发酵培养基 (g/L)[7]:葡萄糖150,酵母粉5,蛋白胨5,121 ℃灭菌15 min,冷却后使用。
T. subcordiformis种子培养基[8]:优化的海水康维方培养基。
10 L规模反应器T. subcordiformis培养用培养基[9]:海水8 L,康维方营养盐溶液10 mL (表1)。
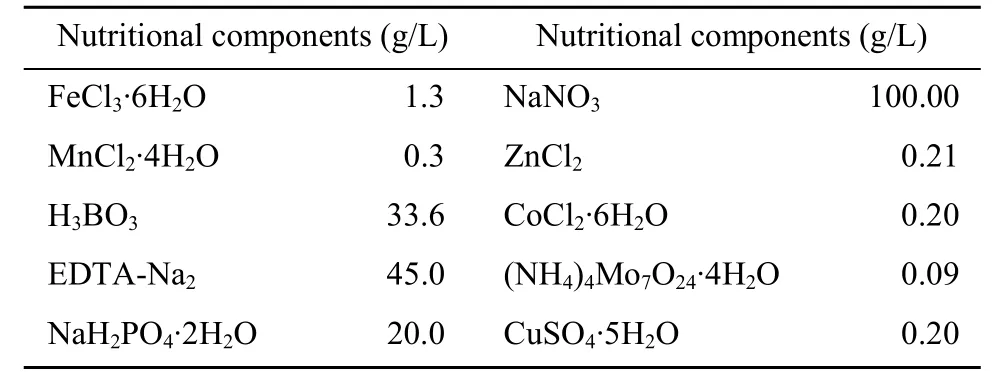
表1 康维方营养盐溶液配方Table 1 Nutrient composition of Kang Weifang solution
1.2 T. subcordiformis的培养
T. subcordiformis培养方法由中国科学院大连化学物理研究所海洋生物产品工程组提供。实验用海水取自大连黑石礁海域,海水经砂滤,110 ℃灭菌15 min后,自平板接一环藻种于100 mL培养基中,在温度 (25±1) ℃,光照强度50 μmol E/(m2·s),光暗比14∶10条件下,培养至对数生长期[8]。在相同培养条件下扩大到500 mL培养基中培养,再扩培到2 L培养基中继续培养6~7 d,可作为光反应器培养的藻种。
10 L有机玻璃平板光照反应器经 0.44‰的NaClO溶液灭菌12 h后,加入8 L灭菌后的海水,然后添加10 mL康维方营养盐溶液,随后接入2 L藻种,使总工作容积达到10 L,培养温度 (28±2) ℃,光照强度140 μmol E/(m2·s),通气量0.125 vvm。研究结果表明,通气中CO2浓度对微藻细胞生长和胞内淀粉积累有重要影响,通入 3%的CO2时胞内淀粉含量较高。因此,将 CO2浓度调节为 3%,分别来自瓶装商品CO2和乙醇发酵副产的CO2[10]。反应器连续光照培养至第7天收获。
1.3 乙醇发酵与微藻培养的偶联
1.3.1 酵母摇瓶种子培养
自斜面接一环菌种于盛装 150 mL培养基的250 mL三角瓶中,置于摇床中在150 r/min,30 ℃条件下培养20~22 h[7]。
1.3.2 1.5 L发酵罐酵母扩大培养
以10%的接种量将摇瓶培养的酵母种子接入含有1 L扩大培养基的发酵罐中,进行间歇扩大培养,发酵罐搅拌速率150 r/min,培养温度30 ℃,pH控制为4.5,通气量100 mL/min,相当于单位体积通气量为0.067 vvm,既保持乙醇发酵要求的厌氧环境,又提供微量氧促进酵母细胞生长。待葡萄糖浓度下降至1 g/L时切换为连续发酵,控制流加稀释率为0.065 h−1,达到恒化状态后,流出发酵罐的发酵液中残糖浓度可以维持在1 g/L以下。
1.3.3 乙醇发酵与微藻培养的偶联
乙醇发酵系统稳定后,将富含CO2的尾气按照需要的流量通入10 L规模平板光照反应器中培养微藻 (培养方法同1.2),至两个系统均稳定运行。
1.4 利用富含淀粉微藻生物质生产乙醇
1.4.1 微藻生物质预处理
收获后的亚心形四爿藻5.0 g加入100 mL去离子水,600 W超声处理[11]后调解pH到6.0~6.5,加入10 μL液化酶 (Liquozyme supra NBSSG4163),加热到80~90 ℃,保温液化1~1.5 h后,冷却到60 ℃~ 65 ℃,调节 pH到 4.0~4.5,加入 20 μL糖化酶(Dextrozyme dx NCSP0041),保温糖化10~12 h[12],离心取上清液供发酵使用,设置2个平行样。
1.4.2 乙醇发酵
同1.2.1的方法培养酵母,经1.3.2预处理后的培养基中均加入1 g酵母粉和2 g蛋白胨,121 ℃灭菌15 min,冷却后以10%的接种量接入已培养好的酵母,置于30 ℃、150 r/min的摇床培养,每隔2 h取样。
1.5 检测方法
1.5.1 细胞干重
微藻细胞干重:取4 mL藻液2 000 r/min离心2 min,用0.5 mol/L的NH4HCO3溶液洗涤2次,置于80 ℃烘箱烘至恒重,取2个测量误差在±10%平行样的平均值。
酵母细胞干重:取4 mL发酵液12 000 r/min离心3 min,用去离子水洗涤2次,置于80 ℃烘箱烘至恒重,取2个平行样,测量误差控制在±10%,取平均值。
1.5.2 淀粉含量测定
取20 mL微藻培养液离心后,少量去离子水洗2次,加入20 mL去离子水,冰水浴600 W超声处理后,经液化酶和糖化酶处理后定容到 50 mL,用SBA-40C生物传感器 (山东省科学院) 检测葡萄糖含量。淀粉含量 (g/g)=葡萄糖 (g/L)×0.05 (L)×0.9/细胞干重 (g)。
1.5.3 藻细胞叶绿素荧光动力学参数的测量
用 Water-PAM 叶绿素荧光仪 (Walz, Germany)测定光合系统Ⅱ (Photosystem Ⅱ,简称 PS Ⅱ) 实际光化学量子产量ΔF/Fm’。取3 mL过滤后的海水,根据培养过程藻细胞浓度,加入适量藻液 (2~10 μL)于测量杯中,混匀,打开光化光 (Actinic light),使叶绿素荧光值在400~500单位左右,再用强饱和脉冲光 (150 μ mol E/(m2·s)) 激发0.6 s,测量ΔF/Fm’[13]。
1.5.4 葡萄糖和乙醇的检测
利用SBA-40C生物传感器 (山东省科学院) 直接检测葡萄糖和乙醇。乙醇得率 (%)=实际产生的乙醇量 (g)/理论应产生的乙醇量 (g)。
2 结果与分析
2.1 乙醇发酵偶联微藻培养的可行性分析
乙醇发酵与富含淀粉的微藻培养偶联,既避免了乙醇生产过程向环境大量排放 CO2,同时又节省了微藻培养所需CO2的原料成本,收获的微藻生物质还可以作为燃料乙醇生产的补充原料。在这一思想指导下,我们在实验室建立了图1所示的耦合系统。文献报道亚心形四爿藻的最高含碳量为38%[6],初步实验数据表明该藻每天最多可积累0.5 g/L生物质,据此可以推算出每天单位体积 (L) 光反应器微藻培养最多可以吸收CO2约0.697 g。本研究使用的2.5 L发酵罐,工作容积1.5 L,以0.065 h−1的稀释速率流加葡萄糖浓度150 g/L的发酵培养基,恒化条件下发酵液中乙醇浓度平均为70 g/L,每天产生CO2约为156.7 g,因此该发酵系统理论上可与225 L的微藻培养反应器偶联。
为了便于实验操作,我们基于现有10 L规模微藻培养反应器,在使用瓶装商品 CO2为碳源培养微藻使其胞内富集淀粉基础上,将乙醇发酵生产 CO2直接通入微藻培养系统,控制尾气流量为72 mL/min,使进入光反应器的气体CO2含量保持在3%左右,研究2个系统耦合的可行性。
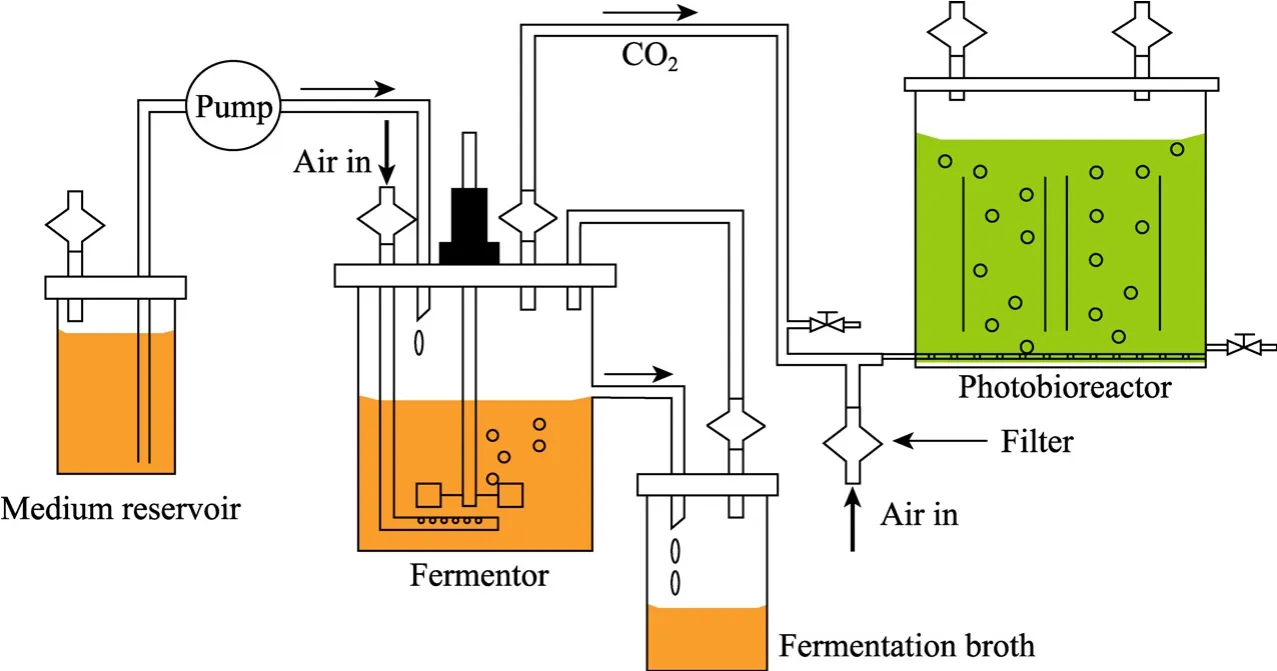
图1 乙醇连续发酵耦联微藻培养生产富含淀粉微藻生物质作为乙醇生产补充原料Fig. 1 Continuous ethanol fermentation coupled with microalgae culture for algae-based starch as an alternative feedstock for ethanol production.
2.2 微藻培养及淀粉积累
以瓶装商品CO2为碳源,10 L平板光反应器中培养T. subcordiformis细胞生长状况如图2a所示,可见接种后的前2 d由于藻细胞从摇瓶接入反应器后需要一定时间适应新的环境,所以生长缓慢,处于延滞期;第2天开始进入指数生长期。微藻培养的前3 d,环境中的营养元素丰富,光合作用效率高,微藻固定CO2进行细胞生长,淀粉积累迅速,淀粉占干细胞的比例从初始的不到 2%上升到第 3天的20%。
PS II实际光化学量子产率ΔF/Fm’反映藻细胞开放的PS II反应中心原初光能捕获效率,其值越高表明叶绿体捕获用于光合作用的光量子越多,光能利用效率越高[14]。当藻细胞生长受到环境因子及营养条件等胁迫时,实际光化学量子产率就会明显下降。从图2a可以看出,从第3天开始ΔF/Fm’值开始下降,表明此时微藻细胞已经处于营养限制状态,但仍然积累大量淀粉[15];第4天后藻细胞可能由于光合作用效率降低,无法满足细胞生长的能量需求而动用自身积累的能量物质如淀粉供其继续生长,所以淀粉含量略有下降的趋势。到培养第 7天虽然淀粉含量下降为 (45.60±1.72)%,但生物量达到最大值(1.85±0.04) g/L,此时单位反应器体积的淀粉产量较高,达到 (0.84±0.03) g/L。综合考虑生物质和淀粉含量的变化,在第7天收获藻细胞较合适。
利用乙醇发酵副产 CO2为碳源培养微藻的实验结果如图2b所示,可见其他培养条件相同条件下,获得的微藻生物量浓度和胞内淀粉积累差别不大,表明利用这种廉价的 CO2替代价格相对昂贵的瓶装商品CO2培养微藻,使其胞内积累淀粉是可行的。
2.3 利用微藻生物质生产乙醇
T. subcordiformis经光照培养后,胞内积累淀粉,需要对藻细胞进行适当处理,将淀粉释放出来,再将其转化成酵母可利用的糖。文献报道的微藻预处理方法很多,如酸解法[4]、超声法[16]、冻融法[17]、暗诱导法[18]、微波法[19]等,结合目前淀粉质原料燃料乙醇生产的实际情况,我们对微藻生物质采用超声预处理后酶解的方法制备可发酵性糖。
T. subcordiformis藻粉通过1.3.2的方法处理后,检测水解液中葡萄糖的含量为18.0 g/L;藻粉的淀粉含量为45.6%,在料液比1∶20的情况下,5 g藻粉中的淀粉完全水解生成葡萄糖的理论值为25.3 g/L,因此该方法葡萄糖的释放量为71.1%。
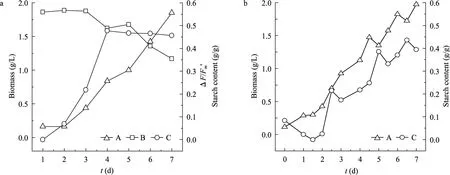
图2 商品CO2(a) 和乙醇发酵副产CO2(b) 为碳源条件下的微藻生长 (A),PSⅡ光化学量子产率ΔF/Fm’(B) 及淀粉积累 (C)Fig. 2 Microalgal growth (A), photochemical efficiency of PSⅡ (ΔF/Fm’) (B) and starch accumulation (C) with CO2 commercially available (a) and produced by ethanol fermentation (b) as carbon source.
图3所示为乙醇发酵的实验结果。酵母发酵6 h到达终点,生物量由0.825 g/L增加到4.43 g/L,乙醇浓度由接种初始的1.07 g/L增加到9.13 g/L,乙醇对总糖的得率系数为 0.447,为理论值 0.511的87.6%。
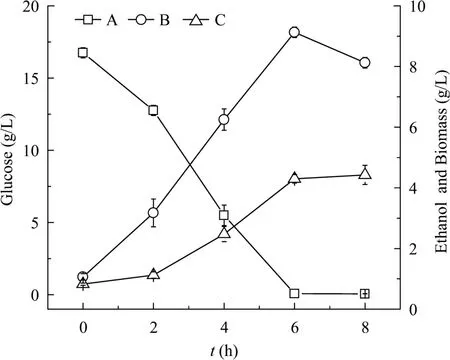
图3 S. cerevisiae发酵T. subcordiformis生物质微波预处理后的酶解液生产乙醇Fig. 3 Ethanol production with S. cerevisiae using the enzymatic hydrolysate of T. subcordiformis biomass pretreated by ultrasonic radiation. A: glucose; B: ethanol; C: biomass.
玉米原料的淀粉含量一般在60%~70%,目前培养的微藻生物质淀粉含量在45%~50%,进一步通过代谢调控等策略提高微藻生物质淀粉含量,作为淀粉质原料燃料乙醇生产补充原料是可行的,可以减少燃料乙醇生产对粮食的消耗。
3 结论
以乙醇发酵副产 CO2为碳源培养 T. subcordiformis富集淀粉是可行的,10 L平板光照反应器培养7 d后,藻细胞干重达到2.0 g/L左右,胞内淀粉积累达到 45%~46%。分析并建立了乙醇发酵偶联微藻培养系统,表明其技术上可行,为乙醇发酵副产CO2的利用开辟了一个新的途径。藻粉经过超声及酶处理后,葡萄糖释放量为淀粉总量的71.1%左右,S. cerevisiae利用其水解液发酵乙醇得率达到理论值的 87.6%。因此,利用乙醇发酵副产CO2偶联微藻培养生产富含淀粉的微藻生物质,可以作为淀粉质原料燃料乙醇生产的补充原料,后续工作应进一步优化藻细胞代谢途径和培养工艺条件,提高胞内淀粉含量和培养过程细胞密度,最大限度地降低微藻生物质生产成本,同时开发适宜的预处理方式提高藻细胞内淀粉的释放效率。
REFERENCES
[1] Waltz E. Biotech’s green gold? Nat Biotechnol, 2009, 27(1): 15−18.
[2] Huang YM, Wang LW, Li YG, et al. Strategies for research and development and commercial production of microalgae bioenergy. Chin J Biotech, 2010, 26(7): 907−913.黄英明, 王伟良, 李元广, 等. 微藻能源技术开发和产业化的发展思路与策略. 生物工程学报, 2010, 26(7): 907−913.
[3] Doucha J, Lívanský K. Outdoor open thin-layer microalgal photobioreactor: potential productivity. J Appl Phycol, 2009, 21(1): 111−117.
[4] Tatsumi C, Ogaki M, Tanabe. Method of producing ethanol: UK, GB 149380 (A). 1975-12-15.
[5] Nguyen MT, Choi SP, Lee JW, et al. Hydrothermal acid pretreatment of Chlamydomonas reinhardtii biomass for ethanol production. J Microbiol Biotechnol, 2009, 19(2): 161−166.
[6] Guo Z. High-density cell cultivation for photobiological hydrogen production by marine green alga Platymonas subcordiformis [D]. Dalian: Dalian Institute of Chemical Physics, Chinese Academy of Sciences, 2008.郭祯. 扁藻高密度培养调控产氢工艺的研究[D]. 大连:中国科学院大连化学物理研究所, 2008.
[7] Li F, Ge XM, Li N, et al. Consecutive very-high-gravity batch ethanol fermentation with self-flocculation yeast, Chin J Biotech, 25(9): 1329−1337.李凡, 葛旭萌, 李宁, 等. 自絮凝酵母高浓度重复批次乙醇发酵. 生物工程学报, 2009, 25(9): 1329−1337.
[8] Liu Y, Chen ZA, Lu HB, et al. Optimization of culture medium and photosynthetic characteristics of Platymonas subcordiformis. Chin J Pro Eng, 2007, 7(6): 1197−1201.刘远, 陈兆安, 陆洪斌, 等. 亚心形扁藻培养基的优化及光合特性. 过程工程学报, 2007, 7(6): 1197−1201.
[9] Xue S, Yao CH, Chen ZN, et al. A method of cultivating marine green alga for the accumulation of starch by utilizing carbon dioxide: China patent, 201010522883.4. 2010-10-27.薛松, 姚长洪, 陈兆安, 等. 一种利用二氧化碳培养海洋绿藻积累淀粉的方法: 中国, 201010522883.4. 2010-10-27.
[10] Guo Z, Chen ZA, Lu HB, et al. Enhanced hydrogen photoproduction by marine green microalga Platymonas subcordiformis grown under CO2-supplemented air bubble bioreactor. J Xi’an Jiaotong Univ, 2008, 42(6): 779−783.郭祯, 陈兆安, 陆洪斌, 等. CO2对亚心形扁藻生长及光合放氢的影响. 西安交通大学学报, 2008, 42(6): 779−783.
[11] Wang XQ, Miao H, Zhai Y. Study on the methods of alga cells fragmentation. J Tianjin Univ Sci Technol, 2007, 22(1): 22−25.王雪青, 苗惠, 翟燕. 微藻细胞破碎方法的研究. 天津科技大学学报, 2007, 22(1): 21−25.
[12] Zhang CM. Studies on continuous ethanol fermentation with recycling of distillage and impact of by-products on growth and ethanol fermentation of the self-flocculating yeast SPSC01 [D]. Dalian: Dalian University of Technology, 2010.张春明. SPSC01废液全循环乙醇连续发酵及发酵副产物对酵母生长和乙醇发酵的影响研究[D]. 大连: 大连理工大学, 2010.
[13] Schreiber U, Hormann H, Neubauer C, et al. Assessment of photosystem II photochemical quantum yield by chlorophyll fluorescence quenching analysis. Aust J Plant Physiol, 1995, 22(2): 209−220.
[14] Zhen Y, Chen ZA, Fu YB, et al. Integrated cultivation and photohydrogen production of Tetraselmis subcordiformis in a flat-plate photobioreactor system. Chemical J Chin Univ, 2008, 29(11): 2209−2212.郑阳, 陈兆安, 傅 彬, 等. 亚心形四爿藻培养和产氢过程一体化平板光生物反应系统. 高等学校化学学报, 2008, 29(11): 2209−2212.
[15] Behrens PW, Bingham SE, Hoeksema SD, et al. Studies on the incorporation of CO2into starch by Chlorella vulgaris. J Appl Phycol, 1989, 1(2): 123−130.
[16] Tatsumi C, Ogaki M, Tanabe I. Method of obtaining ethanol by the utilization of unicellular green algae: CA, 1073379. 1976-01-06.
[17] Shirai F, Kunii K, Sato C, et al. Cultivation of microalgae in the solution from the desalting process of soy sauce waste treatment and utilization of the algal biomass for ethanol fermentation. World J Microbiol Biotechnol, 1998, 14(6): 839−842.
[18] Bush RA, Hall KM. Process for the production of ethanol from algae: US, WO2007/101172 A2. 2007-09-07.
[19] Ogaki M, Tanaka S, Kawasaki H, et al. Method of producing bio-ethanol: US, US2009/0068715 A1. 2008-08-20.
