舌鳞状细胞癌Survivin、VEGF表达的相关性及其临床意义的研究
2011-02-09孙海媛王琳白宇宏
孙海媛 王琳 白宇宏
舌鳞状细胞癌是口腔恶性肿瘤中最常见的肿瘤,一般恶性程度较高,生长快,浸润性较强,常发生早期颈淋巴结转移。术后5a生存率仍约为6.6%~11.7%,严重影响患者的身心健康,降低了生存质量。细胞癌变源于基因异常表达,细胞处于癌变启动阶段时,细胞形态尚未发生变化,但一些酶类已开始异常表达,Survivin和VEGF基因可能就是其中之一,检测以上因子,可辅助临床现行的诊断方法,为探求更加有效的治疗手段提供理论依据。
1 资料与方法
1.1 临床资料
选取河北省唐山市多家医院2000年1月~2007年12月口腔颌面外科手术切除肿瘤标本的石蜡块45例,所有标本皆经病理诊断为舌鳞状细胞癌。10例正常舌黏膜,取自舌外伤组织。患者年龄:≥60岁21例,60岁24例。肿瘤组织病理学分级:20例高分化舌鳞状细胞癌,13例中分化舌鳞状细胞癌,12例低分化舌鳞状细胞癌标本。按照2002年国际抗癌联盟(UICC)公布的口腔癌TNM分期标准进行临床分期:Ⅰ期10例,Ⅱ期14例,Ⅲ期12例,Ⅳ期9例。在舌鳞癌标本中,伴颈淋巴结转移18例,无颈淋巴结转移27例。所有患者皆未接受任何系统的放、化疗。
1.2 主要试剂
鼠抗人CD147多克隆抗体、鼠抗人VEGF多克隆抗体、pv9000两步法免疫组化试剂盒、DAB Kit试剂盒均购自北京中杉金桥生物技术公司。
1.3 免疫组织化学染色
所有标本经4%甲醛溶液固定,石蜡包埋,常规切片,片厚4m,脱蜡至水。免疫组化染色按照试剂盒说明书进行。舌鳞癌组织阴性对照以PBS代替一抗进行组织化学染色。
1.4 结果判定
所有切片均由两位有经验的病理科医生,双盲阅片,每张切片在高倍镜(×400)下观察5个不同视野内的细胞CD147、VEGF染色情况,以胞浆或包膜浅黄色或棕黄色为阳性细胞,按阳性细胞占百分比及染色程度分级评分。阳性比例:10%~25%为1分,26%~50%为2分,51%~75%为3分,>76%为4分。染色深浅:无色为0分,浅黄为l分,黄色为2分,棕黄为3分。上述两项相加,得分<2分记为阴性,≥2分记为阳性。
1.5 统计学分析
应用SPSS15.0统计学软件,舌癌病理分级之间CD147和VEGF的表达应用x2检验,舌癌中CD147和VEGF的表达关系采用Spearman等级相关检验,P<0.05有统计学意义。
2 结果
2.1 Survivin、VEGF在舌鳞癌组织与正常舌组织中表达情况的比较Survivin、VEGF蛋白主要位于舌鳞癌细胞的胞浆中,为粗细不一的棕黄颗粒以中强染色为主。正常舌组织中未见Survivin、VEGF的染色,Survivin、VEGF在舌鳞癌组织中阳性表达率分别为66.7%(30/45)、71.1%(32/45),与正常舌组织间有非常显著的统计学意义(P<0.01)。
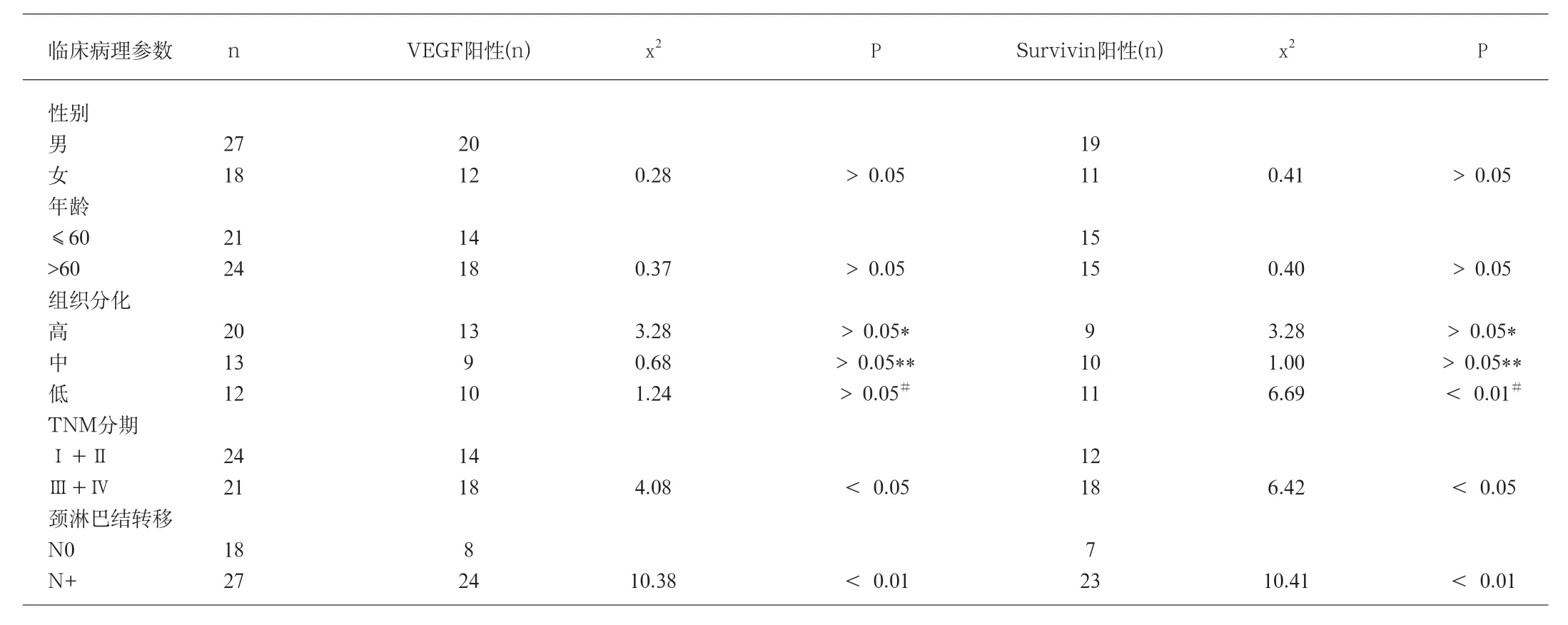
表1 VEGF在舌鳞癌中的表达与各种临床病理参数的关系

表2 舌鳞组织中Survivin、VEGF的相关性
2.2 Survivin、VEGF在舌鳞癌中的表达与各种临床病理参数的关系(表1)。
2.3 Survivin、VEGF在舌鳞癌组织的相关关系(表2)
在30例Survivin阳性表达的舌鳞癌中有26例VEGF表达阳性,占86.6%;在15例Survivin阴性表达的舌鳞癌中有6例VEGF表达阳性,占40%。经Spearman相关分析,两者之间成正相关,相关系数r=0.485(P=0.0019)。
3 讨论
肿瘤细胞凋亡是目前分子生物学研究的一个热点。在生物进化过程细胞生死的程序已经以基因的形式存储于细胞中,同样也存在着抑制凋亡的基因,正常情况下这两类基因处于协调的平衡状态,以确保细胞生死有序。Survivin是细胞凋亡抑制蛋白家族中的新成员,是迄今为止发现的抑制凋亡作用最强的因子,Survivin不仅抑制细胞凋亡,还参与对细胞分裂的调控,并在血管形成过程中,对维持血管内皮细胞的正常增殖起重要作用[1]。本实验中Survivin蛋白在正常粘膜不表达,而在舌鳞癌中高表达,与Tanaka等[2]对口腔鳞状细胞癌的研究是一致的,使Survivin基因成为肿瘤基因治疗的一个理想的攻击靶点。有淋巴结转移的舌鳞癌组织中,Survivin基因的阳性表达率显著高于无淋巴结转移的舌鳞癌组织(P<0.05),这与Lo Muziol等[3]的研究结果相一致。此研究结果表明,异常表达的Survivin可能通过抑制舌癌细胞自身凋亡的过程,使肿瘤细胞出现无限制生长,Survivin对舌癌的发生、发展起着促进作用,测定舌鳞癌组织中Survivin基因的阳性表达对判断预后有着指导作用。高、低分化组之间差异有统计学意义(P<0.05),临床分期Ⅰ、Ⅱ期和Ⅲ、Ⅳ期之间的表达有显著差异(P<0.05),均为临床诊断、判断预后提供了重要参考。
癌症死亡的原因85%~95%均为转移所致[4],舌癌远端转移的发生率明显受肿瘤的大小影响,T4较T1-3更易发生远端转移[5]。当肿瘤直径达到或超过1~2mm时,经微循环渗透提供的营养物质已不能满足肿瘤的生长需要,此时向肿瘤提供营养物质的血管逐步形成。VEGF是目前已知的作用最强、特异性最高的促血管生长因子,VEGF的表达与肿瘤的病程及恶性程度密切相关。最近的研究发现,肿瘤细胞不仅分泌VEGF,同时还能表达VEGF受体,VEGF能直接刺激肿瘤细胞的增殖[6]。因此,在肿瘤的生长和转移中VEGF扮演了一个重要的角色,可作为肿瘤代谢及转移的标志。Konno等[7]研究发现,26例大肠癌中VEGF的表达显著高于癌旁正常组织,而且VEGF的表达与肿瘤的大小显著相关。李宏捷等[8]研究显示VEGF的表达与舌癌组织的淋巴结转移及TNM分期有关,进一步证实了VEGF与肿瘤的侵袭和转移关系密切。而通过阻断VEGF抑制肿瘤血管形成,从而抑制了肿瘤的生长也为部分学者证实。
本实验结果显示:VEGF在舌鳞癌组织中的高表达率,说明VEGF过度表达与促血管形成有密切关系;舌鳞癌中VEGF在临床分期Ⅰ、Ⅱ期和Ⅲ、Ⅳ期之间的表达有显著差异(P<0.05);随着TNM分期的进展,Ⅲ、Ⅳ期舌鳞癌体积增长加快,新生血管无论从数量上还是质量上均不能满足肿瘤组织生长的需要。肿瘤细胞迅速生长时对氧气的需要增加,必然导致缺氧,而缺氧可以诱导肿瘤细胞旁分泌VEGF。因此笔者认为Ⅲ、Ⅳ期舌鳞癌VEGF表达的增加,与其癌的体积及浸润深度的增加使得癌灶内相对缺氧有关。舌鳞癌中VEGF的表达在淋巴结转移组和无转移组亦有显著差异(P<0.05),肿瘤的血道和淋巴道转移都与血管和淋巴管的内皮细胞结构及连接方式有关。而VEGF能特异性作用于血管内皮细胞促使其增殖并能增加血管的通透性。Pepper等[9]研究认为淋巴内皮细胞的生长与血管内皮细胞相似,均受VEGF等细胞因子的调控,VEGF同时具有促进淋巴管内皮细胞增生的能力。
细胞的凋亡不但与肿瘤的发生、发展有关,而且与血管的生成、肿瘤的转移密切相关。Survivin与VEGF在肿瘤细胞的增殖及肿瘤新生血管之间有着密切关系。O’connor[10]应用VEGF诱导静止期的内皮细胞分裂,结果内皮细胞内的Survivin表达水平上升约16倍,高表达的Survivin抑制了各种指向Caspase的凋亡机制,从而保护内皮细胞逃避凋亡。Mehdi Mesri等[11]利用Survivin的反义核苷酸抑制血管内皮细胞中Survivin的表达后,发现VEGF保护内皮细胞功能减低。本实验结果发现:Survivin蛋白表达与VEGF蛋白表达呈正相关(r=0.485,P<0.01),表明Survivin与VEGF在肿瘤的发生、发展中起着协同作用,在免疫组化的研究水平揭示了这两个肿瘤相关基因之间可能存在着相互调控。Survivin和VEGF表达的上调与舌癌临床病理特征密切相关,并且存在正协同关系。因此,对二个指标的联合检测有利于临床舌癌的诊断、转移及预后的判断,针对二者在舌鳞癌发展及肿瘤血管形成中的相互作用机制而开发抗肿瘤药物,或靶向Survivin和VEGF基因治疗,将提供舌癌治疗的新途径。
[1]Lo Muzio L,G Pannone,S Stabano,et al.Survivin expression in oral squanous cell carcinoma[J].Br J Cancer,2003,89(12):2244-2248.
[2]Tanaka C,Uzawa K,Shibahara T,et al.Expression of an inhibitor of apoptosis,survivin,in oral carcinogenesis[J].Dent Res,2003,82(8):607-611.
[3]Lo Muzio L,Pannone G,Staibano S,et al.Survivin expression in oral squamous cell carcinoma[J].Br J Cancer,2003,89(12):2244-2248.
[4]Shintani S,Matsuura H,Hasegawa Y,et al.Regional lymph node involvement affects the incidence of distant metastasis in tongue squamous cell carcinomas[J].Anticancer Research,1995,15(4):1573-1576.
[5]徐泽.癌转移治疗新概念与新方法[M].北京:人民军医出版社,2006:70.
[6]Tian XJ,Song SM,Wu J,et al.Vasceular endothelial growth factor:acting as an autocrine growth factor for human gastric adenocareinoma cell MGC803[J].Biochem Biophys Res Comm,2001,286:505.
[7]Konno H,Tanaka T,Baba M,et al.Quantitative analysis of vaseular growth factor in colon cancer[J].Eur Surg Res,1998,30(4):273-278.
[8]李宏捷,朱晓虹,张玉茹.MMP-9与VEGF在舌癌中的表达及相关性研究[J].天津医药,2008,36(4):264-266.
[9]Pepper MS,Wasi S,Ferrara N,et a1.In vitro angiogenesis and proteolytic properties of bovine lymphatic endothelial ce1ls[J].Exp Cell Res,1994,210:298-306.
[10]O'connor DS,Schechner JS,Adida C,et a1.Control of apoptosis during angiogengesis by Survivin express in endothelial cell[J].Am J Patho1,2000,156(2):393-398.
[11]Mesri M,Morales-Ruiz M,Ackermann EJ,et al.Suppression of vascular endothelial growth factor-mediated endothelial cell protection by Survivin targeting[J].Am J Patho1,2001,8(4):350-310.
