促肾上腺皮质激素释放激素基因敲除小鼠的繁殖与基因型鉴定*
2011-02-09王海燕钟河江黄苏娜蒋建新
王海燕,刘 庆,钟河江,杨 策,黄苏娜,严 军,蒋建新
(第三军医大学大坪医院野战外科研究所第四研究室/全军交通医学研究所/全军交通伤重点实验室/创伤、烧伤与复合伤研究国家重点实验室,重庆 400042)
促肾上腺皮质激素释放激素(corticotropin-releasing hormone,CRH)是下丘脑-垂体-肾上腺(hypothalam ic-pituitaryad renal,HPA)轴最重要的调节因子之一,能刺激垂体前叶促肾上腺皮质激素(ad renocorticotropic hormone,ACTH)细胞的阿黑皮素原(proopiomelanocortin,POMC)基因表达,调控机体糖皮质激素分泌水平[1-3]。作为研究应激后神经内分泌反应和天然免疫功能关系的重要模式动物,CRH基因敲除(knockout,KO)小鼠为进一步研究内源性CRH在免疫系统及炎症反应中的作用提供了有力的工具[4-5]。然而,国内利用CRH KO小鼠进行相关研究的报道还不多。由于CRH KO小鼠的饲养和繁殖难度与常规小鼠不同,而获取一定数量的CRH KO小鼠是探讨HPA轴在神经内分泌反应中作用的前提和基础,因此,本课题在引进CRH KO小鼠的同时,对该模式动物的饲养、保种和基因分型等方面的特点和规律进行了探讨。
1 材料与方法
1.1 实验动物 CRH KO杂合子型(CRH+/-)小鼠(雄鼠5只、雌鼠2只)购自美国 Jackson实验室。
1.2 基因敲除小鼠的建立 亲代杂合子小鼠为C57BL/6J种系背景。通过同源重组的方式将来源于129S2/SvPas小鼠的胚胎干细胞-D3株(embryonic stem cells-D3,ES-D3)中的目的基因(CRH)进行突变,再将突变的胚胎干细胞(embryonic stem ce lls,ES)注射入C57BL/6J小鼠胚胎中以获得嵌合小鼠,通过对嵌合小鼠近交繁殖获得杂合子型(CRH+/-)、野生纯合子型(CRH+/+)及CRH KO纯合子型(CRH-/-)小鼠。
1.3 CRH KO小鼠的饲养与繁殖 CRH KO小鼠的饲养和繁殖按照无特定病原(specific pathogen free,SPF)级动物饲养标准在层流隔离环境饲养,室内温度控制在20~26℃,湿度50%~60%,照明采取12 h昼夜交替的方式。小鼠的饲料由第三军医大学大坪医院野战外科研究所实验动物中心配制。饲养期间密切观察小鼠生长情况。采用70~80 d龄CRH+/-雄性小鼠与雌性小鼠按1∶1间歇同笼兄妹近亲繁殖方法,连续生产4~5胎,子鼠21 d后离乳,离乳后种鼠亦同笼交配。采用第2胎生产动物保种。繁殖出CRH+/+、CRH+/-及CRH-/-小鼠,并记录小鼠的体质量变化情况。
1.4 小鼠尾部基因组DNA的提取 取出生后10 d左右的幼鼠,剪趾编号。剪取幼鼠尾尖0.2~0.5 cm,加入组织裂解液56℃孵育过夜;6 mol/L饱和NaCl和无水乙醇常规抽提DNA;室温干燥后,加三羟甲基氨基甲烷-乙二胺四乙酸[tris(hydroxymethy l)aminomethane-ethy lene diam inetetraacetic acid,TE]缓冲液溶解,采用分光光度法对提取的小鼠基因组DNA进行定量。
1.5 基因鉴定引物及聚合酶链反应(polymerase chain reaction,PCR) 引物序列:oIM R0612:5'-GAG CTT ACA CAT TTC GTC C-3';oIM R0613:5'-GCT CAG CAA GCT CAC AGC AA-3';oIM R0510:5'-ATC GCC TTC TTG ACG AGT TC-3'。其中 oIM R0612和 oIM R0613引物扩增片段长度为437 bp,用于检测CRH+/+,而oIMR0612和o IMR0510引物扩增片段长度约600 bp,用于检测CRH-/-。PCR扩增参数:94℃预变性4 m in后,94℃变性30 s,60℃退火30 s,72℃延伸40 s,共35个循环;最后72℃延伸 8 min。2%琼脂糖凝胶电泳PCR产物并分析。上述试剂购自北京天根生化科技有限公司。
1.6 3种基因型小鼠不同组织中CRH的分布检测 收集成年CRH+/+、CRH+/-及CRH-/-小鼠的腹腔巨噬细胞,计数后接种至6孔细胞培养板,常规孵育2 h后,取贴壁细胞提取总RNA。同时分离提取小鼠下丘脑、肝脏、胸腺和脾脏组织总RNA,采用逆转录PCR(reverse transcription-PCR,RTPCR)检测不同组织中CRHm RNA的表达。PCR引物同1.5中的o IMR612和oIMR613引物,PCR方法同1.5。
1.7 统计学处理 采用SPSS 13.0软件对数据进行统计分析,两组间比较采用单向方差分析(one-way analysis of variance,one-way ANOVA)判定差异的显著性,并运用O rigin Pro 7.5软件作图。采用Kap lein-Meier方法分析生存曲线,应用Log-rank检验比较各基因型小鼠的生存率。
2 结 果
2.1 小鼠基因型的鉴定 应用3个特异性引物可鉴别3种不同基因型小鼠,其中泳道1仅出现600 bp条带,故幼鼠1基因型为CRH-/-;泳道3、5仅出现437 bp条带,故幼鼠3和幼鼠5基因型为 CRH+/+;泳道 2、4、6~ 8分别出现 437、600 bp两条带,表明幼鼠2、4、6~8的基因型为CRH+/-,见图1。
2.2 3种基因型小鼠的繁殖情况 通过杂合子小鼠配对,本实验室成功地繁殖出1 474只子代小鼠,通过PCR方法鉴定小鼠基因型,结果显示CRH+/+、CRH+/-、CRH-/-小鼠所占比例大约为3∶5∶1(CRH+/+小鼠占34.87%,CRH+/-小鼠占54.48%,CRH-/-小鼠占10.65%)。
2.3 CRH KO对小鼠生长状况的影响 相对CRH+/+和CRH+/-小鼠而言,早期所得CRH-/-小鼠与其同窝小鼠体型相当,在出生10 d及30 d时,CRH-/-小鼠体质量与CRH+/+及CRH+/-小鼠相比差异无统计学意义,见图2。提示以CRH+/-小鼠为种鼠所繁殖的CRH-/-小鼠出生后在无糖皮质激素补充的情况下仍能健康成长,并且,成年后的CRH-/-小鼠与CRH+/+及CRH+/-小鼠相比,体质量、生长状态及活动等均表现正常,无表型差异。但随着繁殖代数的增加而逐渐呈现出较明显的生长迟缓现象,特别是出生后1个月内表现为个头矮小,运动能力弱,生活状态差,CRH-/-小鼠的体质量显著低于同期的CRH+/+及CRH+/-小鼠。后2类基因型小鼠均表现如常,无表型差异。
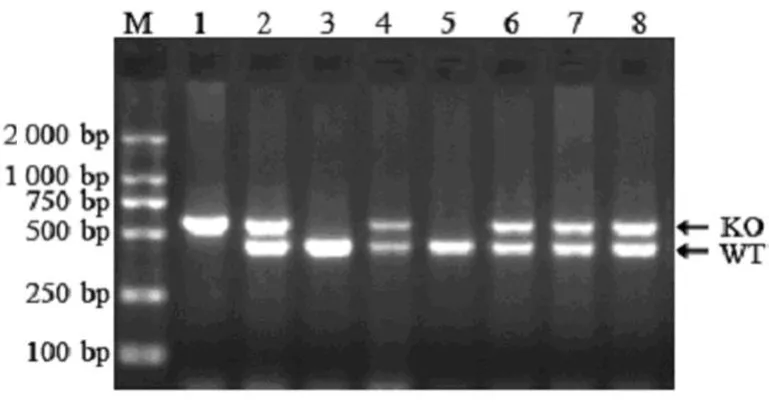
图1 3种基因型小鼠基因组DNA的PCR结果
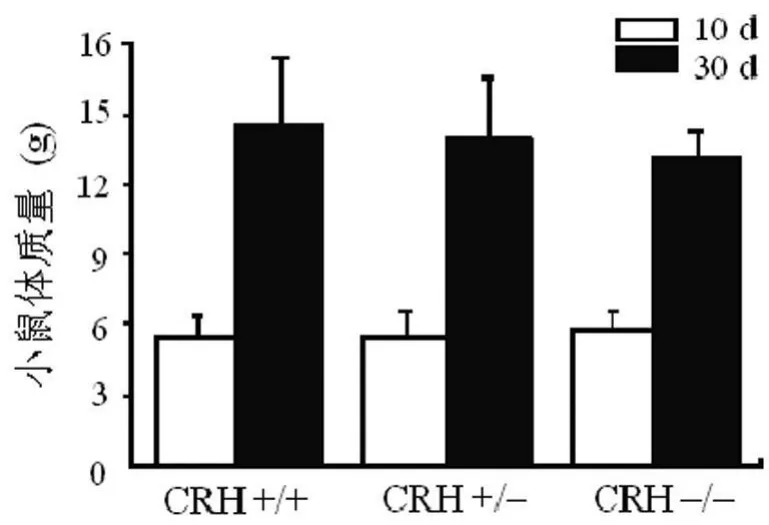
图2 3种基因型小鼠出生后10、30 d体质量比较(±s)
2.4 3种基因型小鼠不同组织中CRHmRNA的分布情况检测3种基因型小鼠下丘脑、肝、胸腺、脾及腹腔巨噬细胞CRHm RNA表达,发现CRH+/+及CRH+/-小鼠不同组织中均有CRHmRNA表达,但 CRH-/-小鼠无CRHm RNA表达,见图3。进一步证实CRH-/-小鼠不同组织中CRHm RNA表达的缺失。

图3 3种基因型小鼠不同组织中CRH mRNA的表达
2.5 3种基因型小鼠生存率分析 CRH+/-小鼠与CRH+/+小鼠的存活率基本相似,而在2~3周时,CRH-/-小鼠较另外2种基因型小鼠的存活率明显下降,第4周后其存活率才基本稳定,见图4。
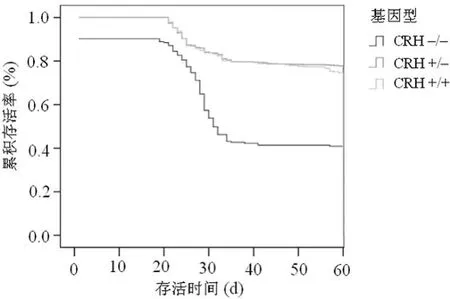
图4 3种基因型小鼠生存率分析结果
3 讨 论
动物实验是现代细胞与分子生物学实验研究的基本手段,借助遗传学手段研究各种基因突变小鼠已成为医学生物学研究最有力的方法之一,CRH KO小鼠模型的建立有助于进一步了解糖皮质激素在H PA轴系统中的活性机制和在生殖及免疫调节中的作用[6-8]。由于CRH KO小鼠在所有发育阶段组织中的CRH功能完全丢失,因此,它可提供CRH缺失的在体评估方法[6]。
有研究表明CRH+/-小鼠与CRH+/+小鼠在所有参数上表现完全相同并具有繁殖能力,通过CRH+/-小鼠交配所获得的首批4周龄的266只小鼠中,各型小鼠获得率与孟德尔比率相符。CRH+/-小鼠交配产生的CRH-/-小鼠具有正常的生存能力,而且,CRH-/-小鼠与同窝CRH+/+小鼠或CRH+/-小鼠相比,其各项指标如大小、活性及一般行为等均无明显差异[9]。CRH+/-小鼠与CRH+/+小鼠的存活率基本相似,而CRH-/-小鼠较另外2种基因型小鼠存活率在2~3周时明显下降,第4周后其存活率才基本稳定,尽管CRH-/-小鼠具有很低的基础糖皮质激素水平,但其仍具有生育能力和正常寿命[6,10]。
本研究对引进的CRH KO小鼠也采用CRH+/-小鼠交配的繁殖方式,并获得一定数量的CRH KO小鼠。但所获各基因型小鼠的比率与上述报道略有出入,纯合子小鼠获得率较低。推测其原因可能为:(1)CRH是HPA轴在应激时激活的主要中介者,内源性CRH的缺乏可能导致CRH-/-小鼠死于胚胎期,或于出生后数小时甚至数天后死亡,进而导致难以观察新生鼠的表型,更无从统计该表型的准确获得率,造成获得率低下的“假象”。(2)本研究中饲养的小鼠繁殖代数较多,而近交系小鼠随着近亲交配繁殖代数的增加,其基因纯合率不断提高,导致近亲衰退,抵抗力和生育力下降[11]。(3)目前基因敲除的结果忽略了背景基因的作用,由于所敲除基因的缺失,动物机体可能产生一种雪崩式的代偿过程,引起基因的第二次改变[12]。除遗传背景外,还有其他许多因素使基因敲除结果复杂化,由于基因突变体在体内所有组织发育的过程都会丢失,因此,不能排除其他器官缺陷参与表型改变的可能性[13]。CRH目的基因的缺失与某个或某些背景基因的协同作用可导致CRH KO小鼠的出生率低、死亡率高及生长迟缓等现象。
引进的小鼠系美国Jackson实验室采用冷冻胚胎复苏的方法所获得。虽然通过兄妹近亲繁殖法获得各型CRH KO小鼠可随时保障实验的需要,但不可避免地造成其近亲衰退。为了消除背景的混淆效应及纠正近亲衰退,一个经典的方法是回交降低背景基因发挥作用的可能性[11,14]。经过6代回交后,任何遗传背景对基因表达的影响将可通过与正常C57BL/6J或129S2/SvPas小鼠的比较而得到控制[6,15]。故拟下一步引进129S2/SvPas小鼠与CRH+/-交配,以恢复后者的繁殖及子代存活率。
本研究在美国Jackson实验室提供的PCR方法基础上优化反应条件进行基因型筛选,结果非常稳定。而对各基因型小鼠下丘脑、肝、胸腺、脾及腹腔巨噬细胞中CRHm RNA表达的检测结果,也进一步证实了PCR鉴定结果的正确性。另外还发现CRH+/-小鼠的CRHmRNA表达水平略低于CRH+/+小鼠,并且CRHmRNA在组织器官间表达水平不完全相同,提示其在不同组织器官中的作用可能存在差异。
[1] Keller PA,K irkwood K,Morgan J,et al.The p revention of preterm labour —— corticotropin releasing hormone type 1 recep tors as a target for d rug design and development[J].M ini Rev Med Chem,2003,3(4):295-303.
[2] Matsuw aki T,Kayasuga Y,YamanouchiK,et al.Maintenance of gonadotropin secretion by glucocorticoids under stress conditions through the inhibition of prostag landin synthesis in the brain[J].Endoc rinology,2006,147(3):1087-1093.
[3] Lariviere WR,Fiorenzani P,Ceccarelli I,et al.Central CRH adm inistration changes formalin pain responses in male and female rats[J].Brain Res,2011,1383:128-134.
[4] Gay J,Kokkotou E,O'Brien M,et al.Corticotropin-re leasing hormone deficiency is associated w ith reduced local in flammation in amousemodelof experimental colitis[J].Endocrino logy,2008,149(7):3403-3409.
[5] Chaniotou Z,Giannogonas P,Theoharis S,et al.Corticotropin-releasing factor regulates TLR4 exp ression in the co lon and p rotectsm ice from colitis[J].Gastroenterology,2010,139(6):2083-2092.
[6] Pirnik Z,Petrak J,Bundzikova J,et al.Response of hypothalam ic oxy tocinergic neurons to immobilization stress is not dependent on the presence of corticotrophin releasing hormone(CRH):a CRH knock-out mouse study[J].J Physiol Pharmacol,2009,60(2):77-82.
[7] Ko lber BJ,Boyle MP,Wieczorek L,et al.Transient ear lylife forebrain corticotropin-releasing hormone elevation causes long-lasting anxiogenic and despair-like changes in m ice[J].JNeurosci,2010,30(7):2571-2581.
[8] Sithisarn T,Bada HS,Dai H,etal.Effects o f perinatal cocaine exposure on open field behavior and the response to corticotropin releasing hormone(CRH)in rat offsp ring[J].Brain Res,2011,1370:136-144.
[9] Venihaki M,Zhao J,Karalis KP.Corticotropin-releasing hormone deficiency resu lts in impaired sp lenocy te response to lipopolysaccharide[J].JNeuroimmunol,2003,141(1-2):3-9.
[10]Bakshi VP,Kalin NH.Corticotropin-releasing hormone and animalmodels of anxiety:gene-environment interactions[J].Bio l Psychiatry,2000,48(12):1175-1198.
[11]魏泓.医学实验动物学[M].2版.成都:四川科学技术出版社,2001:28-39.
[12]Gerlai R.Zebra fish:an uncharted behavior genetic model[J].Behav Genet,2003,33(5):461-468.
[13]Fü lop AK,Fo ldes A,Buzás E,etal.H yperlep tinem ia,visceral adiposity,and decreased g lucose tolerance in m ice with a targeted disruption of the histidine decarboxy lase gene[J].Endocrino logy,2003,144(10):4306-4314.
[14]Harris RB.Lep tin responsiveness o fm ice deficient in corticotrophin-releasing hormone receptor type 2[J].Neuroendocrino logy,2010,92(3):198-206.
[15]Shinahara M,N ishiyama M,Iw asaki Y,et al.Plasma adiponectin levels are increased despite insu lin resistance in corticotropin-releasing hormone transgenic m ice,an animalmodel of Cushing syndrome[J].Endocr J,2009,56(7):879-886.
