IDO基因转染小鼠树突状细胞体外诱导Treg细胞增殖的研究*
2011-02-09谢启超陈正堂
谢启超,朱 波,陈正堂
(第三军医大学新桥医院全军肿瘤研究所,重庆 400037)
调节性T细胞(regulatory T cell,T reg)是T细胞中的一个亚群,极少量的Treg细胞便可以通过与T细胞直接接触的方式或产生某些抑制性细胞因子来抑制T细胞增殖、T细胞功能、甚至诱导T细胞凋亡,进而产生强烈的免疫抑制。研究表明,这种抑制作用与恶性肿瘤的转移关系密切。淋巴结作为人体免疫器官,是多种恶性肿瘤转移的重要发生部位,是导致癌症患者预后差的重要因素。前期研究中发现吲哚胺-2,3-双加氧酶(indoleam ine-2,3-dioxygenase,IDO)(+)树突状细胞(dendritic cells,DC)在发生或未发生的肺癌引流淋巴结中出现,猜测可能与肺癌的淋巴结转移有密切关系。本研究应用阳离子脂质体将IDO基因转染到小鼠DC细胞,并与小鼠外周血T淋巴细胞混合培养,通过体外培养研究增强IDO在DC中的表达对Treg细胞的诱导增殖作用,阐明IDO在DC的增强表达与Treg细胞增殖的相互关系,为肺癌淋巴结转移机制研究提供新的实验依据。
1 材料与方法
1.1 材料 小鼠DC细胞从C57小鼠骨髓中分离;真核表达重组质粒pEGFP-IDO由暨南大学组织移植与免疫教育部重点实验室何贤辉教授馈赠;大肠肝菌DH 5α由本研究所保存,高保真DNA Taq聚合酶为美国Promega公司产品,TRIzol试剂、RT-PCR系统购自晶美公司,质粒抽提试剂盒为晶美公司产品,淋巴细胞分离液为挪威NYCOMED产品,DMEM培养基及胎牛血清(FBS)为美国Gibco公司产品,IL-2、DNA Ladder、G418(p romega)、HRP化学发光检测试剂购于晶美生物公司;荧光标记的抗鼠单克隆抗体Foxp3-PE及CD4-PECY 5均购自晶美生物公司。
1.2 方法
1.2.1 小鼠DC细胞的分离和培养 无菌条件下制备C57小鼠骨髓,先后用红细胞裂解液、抗鼠 CD 4、CD8、B细胞 M cAb和补体溶液,依次去除红细胞、T细胞、B细胞、粒细胞和单核-巨噬细胞等混杂细胞而获得纯化的DC细胞及其前体;在GMCSF和IL-4协同诱导下培育,DC前体分化发育成DC细胞;小鼠DC细胞常规培养于RPM I-1640完全培养液中(含10%胎牛血清,青霉素 100 U/m L,链霉素100 U/m L),经0.25%胰蛋白酶溶液消化传代,细胞培养及转染等均在37℃饱和湿度及含5%CO2的培养箱中进行。
1.2.2 慢病毒转染 构建非线性病毒穿梭质粒,筛选人全长IDO基因阳性克隆,并进行测序鉴定,对于测序正确的阳性克隆,与慢病毒包装质粒(lentiviral packaging p lasm ids)共转染293T细胞,在细胞中完成病毒的包装,再收集病毒液并浓缩、纯化,测定病毒滴度,用收集到的高滴度病毒感染小鼠树突状细胞,用G 418筛选后获得稳定表达具有生物学功能IDO的IDO-DC细胞,空白对照质粒pEGFP转染同上,获得的细胞命名为EGFP-DC。
1.2.3 转染的鉴定 插入片段的测序由上海申博公司完成,结果与基因库NCBI比对;转染后的细胞应用RT-PCR检测IDO m RNA表达情况,上游引物:5'-GCG CTG TTG GAA ATA GCT TC-3',下 游引 物:5'-CAG GAC GTC AAA GCA CTG AA-3',扩增片段长度为234 bp,引物由申博公司合成;RT-PCR及Western b lot方法检测IDO基因的表达。
1.2.4 小鼠T细胞的分离及培养 利用小鼠淋巴细胞分离液,在无菌条件下肝素抗凝、眼眶取血,利用标准的密度梯度离心法分离获取单个核细胞,计数细胞后,用含10%胎牛血清1640培养基(Gibco)调节细胞浓度至 1×106/m L,加入终浓度为20 U/m L的白细胞介素-2,置培养箱内培养 48 h,收集培养后的T细胞,分别加入IDO-DC、EGFP-DC或DC细胞(DC∶T=1∶10),继续培养72 h。
1.2.5 流式细胞仪(FCM)检测 上述混合细胞群继续培养72 h后,收集所有细胞,离心,取细胞数约 1×105,磷酸盐缓冲液(PBS)洗涤2次,0.2%triton x-100穿膜后加入荧光标记的抗体FOXp3-PE和CD4-PECY 5,避光孵育30 m in,PBS洗涤3次,4 h内上机检测,每次均设置加入小鼠IgG 1-PE、IgG1-PECY 5荧光抗体作为非特异对照,实验均重复3次,结果取均值。
2 结 果
2.1 IDO基因转染及筛选 IDO基因质粒构建完成后与基因库比对,结果与基因库完全一致;转染并经G418筛选后,所得细胞均为绿色荧光表达阳性(图1),RT-PCR和W estern b lot检测结果表明IDO正常表达(图 2、3)。
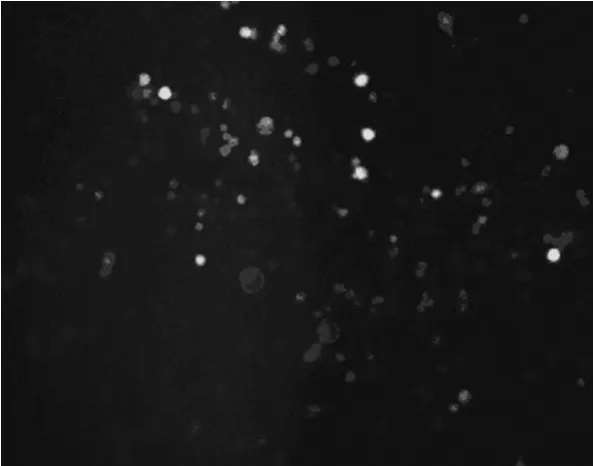
图1 转染后IDO融合蛋白在IDO-DC细胞中的表达(×200)
2.2 流式细胞仪(FCM)检测结果 FCM检测结果提示与IDO-DC细胞联合培养的体系中,CD4(+)细胞占T细胞总数的(47.4±5.7)%,Foxp3(+)细胞比例为(7.5±2.5)%,而与EGFP-DC或DC细胞联合培养的体系中,CD4(+)细胞的比例分别为(45.1±7.4)%和(43.8±8.3)%,Foxp3(+)细胞比例分别为(3.6±1.6)%和(3.1±1.7)%,前者与后二者比较,CD4(+)细胞比例差异无统计学意义,而Foxp3(+)细胞比例差异有统计学意义(t=4.51,P<0.05;t=3.43,P<0.05)。
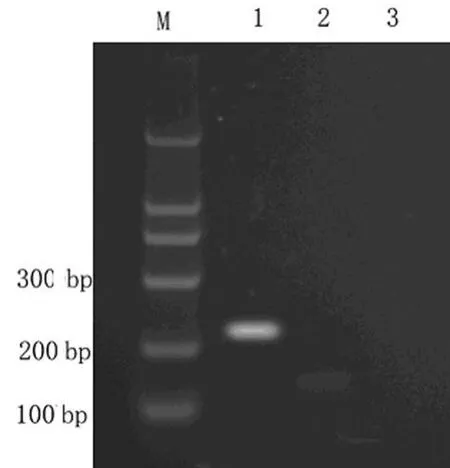
图2 RT-PCR检测IDO基因的表达
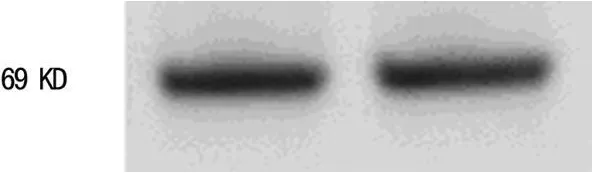
图3 Western b lot检测IDO蛋白在IDO-DC细胞中的表达
3 讨 论
免疫耐受是肿瘤形成的重要机制,同时也是肿瘤免疫治疗效果不佳的最主要原因之一,在免疫耐受的微环境中,机体免疫系统无法对肿瘤细胞进行有效地识别和杀伤。目前认为,肿瘤细胞诱导的外周免疫耐受形成机制主要包括肿瘤抗原缺失、抗原提呈细胞的抗原识别、加工、提呈障碍以及某些细胞因子如转化生长因子-β(TGF-β)等介导的 T细胞增殖受阻或功能抑制等[1-3]。最近研究发现,Treg细胞是导致肿瘤细胞免疫耐受的一个关键因素[4-5],Treg细胞是T细胞中一个独特的亚群,这种细胞可以以抗原非特异性的方式、通过细胞间的直接接触来抑制效应T细胞的功能,从而减弱甚至消除免疫反应的效果,由于Treg细胞在肿瘤局部免疫耐受的形成和维持中具有重要地位,所以,该细胞亚群一经发现便在肿瘤免疫耐受研究中受到极大的重视。DC细胞是人体内迄今为止所发现的功能最强大的抗原递呈细胞,在肿瘤免疫中具有重要的地位,它通过识别提取抗原并向T细胞递呈来引导抗肿瘤免疫反应的发生。最近研究发现,DC细胞可以通过增强IDO基因的表达来诱导局部的免疫耐受,从而导致肿瘤的侵袭和转移。
人类IDO基因位点位于第8号染色体上,为单拷贝基因,编码的IDO分子量约42 kD,由403个氨基酸组成,主要在胞质中发挥作用,人体内调控IDO表达主要为IFN-γ等一些细胞因子,研究表明,IDO可以通过调节色氨酸的代谢来诱导局部的免疫耐受微环境[6-8]。最近有研究表明部分患者DC细胞内可以检测到IDO表达明显增强,同时伴有局部的免疫耐受,在肿瘤引流淋巴结中,多个研究发现有IDO(+)DC的存在,而无论是否已经发生转移。Fallarino等[9]在鼠肿瘤引流淋巴结中检测到IDO在浆细胞样树突状细胞(p lasmacytoid DC)内表达明显增强;O rabona等[10]在小鼠脾脏内发现IDO在DC内高表达,且IRF-8是维持IDO表达和功能的主要调控因子;国内有研究者研究结肠癌区域淋巴结转移时也发现,在一些尚未发现肿瘤转移的前哨淋巴结中,检测到IDO(+)DC明显增多,但在更远的淋巴结中却没有发现此现象[11],这些现象提示IDO(+)DC有可能是造成肿瘤引流淋巴结发生转移的一个重要原因,但是,IDO(+)DC是否可以直接诱导Treg细胞的增殖从而诱导局部的免疫耐受微环境尚不清楚。
本研究通过将含有人全长IDO基因通过慢病毒系统转染到小鼠DC细胞,得到具有正常IDO基因生物学功能的DC细胞,再与小鼠T淋巴细胞共培养,通过流式细胞仪检测,结果表明Treg细胞增殖明显,与亲本细胞和空质粒转染细胞对照组比较,差异有统计学意义,表明IDO(+)DC细胞在体外可以诱导Treg细胞的增殖,为恶性肿瘤局部Treg细胞的产生和肿瘤淋巴结转移机制的研究提供了新的实验依据,同时也为恶性肿瘤患者的免疫干预研究提供了新的思路。但是,IDO(+)DC细胞是通过哪种信号通路诱导了Treg细胞的增殖尚不明确,本课题组正在进一步研究之中。
[1] Theresa LW.Immune responses tomalignancies[J].Journalof A llergy and Clinical Immunology,2010,125(2):S272-S283.
[2] Gajewski TF,Meng Y,Harlin H,et al.Immune suppression in the tumor microenvironment[J].J Immunother,2006,29(3):233-240.
[3] Soldano F,Theresa LW.Tumor microenvironment and immune escape[J].Surgical Oncology Clinics of North America.2007,16(4):755-774.
[4] N izar S,Meyer B,Galustian C,et al.T regu latory cells,the evo lution o f targeted immunotherapy[J].Biochimica et Biophysica A cta,2010,1806(1):7-17.
[5] Dim itrios M,Aniruddha C,A lvaro L,et al.Regu latory T cells in cancer[J].Advances in Cancer Research.2010,107(3):57-117.
[6] Maria Z,Anastasios EG,Vaios K.Tumor immune escape mediated by indoleamine 2,3-dioxygenase[J].Immuno logy Letters,2007,111(2):69-75.
[7] Chung DJ,Rossi M,Romano E,et al.Indoleam ine 2,3-dioxygenase-expressing mature human monocy te-derived dend ritic cells expand potent autologous regu latory T cells[J].Blood,2009,114(3):555-563.
[8] Chen W,Liang X,Peterson AJ,et al.The indoleam ine 2,3-dioxygenase pathway is essential for human p lasmacytoid dend ritic cell-induced adaptive T regu latory cell generation[J].J Immunol,2008,181(8):5396-5404.
[9] Fallarino F,Vacca C,Orabona C,et al.Functional expression o f indo leam ine 2,3-dioxygenase by murine CD8α+dend ritic cells[J].Int Immunol,2002,14(1):65-68.
[10]O rabona C,Puccetti P,Vacca C,et al.Toward the identification of a tolerogenic signature in IDO-competent dend ritic cells[J].Blood,2006,107(1):2846-2854.
[11]高艳芳,彭瑞清,伍小军,等.吲哚胺-2,3-双加氧酶在结肠癌及其区域淋巴结中的表达与临床意义[J].中国肿瘤临床,2007,34(14):811-814.
