苯海拉明等有机胺类药物干扰MTT还原法的应用
2011-02-09张晨辉胡薇薇
沈 耀,张晨辉,胡薇薇,陈 忠
(1.温州医学院生命科学学院,浙江温州325035;2.浙江大学药学院,浙江杭州310058)
3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)还原法是一种简单、灵敏、经济的体外检测细胞活性和增殖的方法[1-2]。其检测原理为:活细胞线粒体或非线粒体中的琥珀酸脱氢酶等能使外源性MTT还原为水不溶性的紫黑色结晶物——甲瓒(formazan),并沉积在细胞中,而死细胞则无此功能[3]。二甲基亚砜(DMSO)能溶解细胞中的甲瓒,用酶联免疫检测仪在490 nm波长处测定其光吸收值,可反映活细胞数量。许多文献显示在一定细胞数范围内,MTT结晶形成的量与细胞数成正比;使用MTT方法得到的实验数据和使用其它方法所得数据一致性较高[4-5]。目前,该方法已被广泛应用于抗肿瘤药物的大规模筛选、肿瘤放射敏感性检测、细胞毒性试验、细胞增殖和新材料的生物兼容性以及生物活性因子的活性检测等。
然而,MTT还原法的一些缺点致使实验结果出现偏差。一些胞外物质,如抗坏血酸、维生素E和N-乙酰半胱氨酸以及一些植物提取物等,能够在无细胞系统中还原MTT产生甲瓒[6]。此外,MTT还原法还受细胞培养液的pH及含糖量等的影响[7]。可见,在MTT还原法应用时,应排除这些潜在的干扰因素,从而得到准确的实验结果。有机胺类药物,如苯海拉明等在离体细胞实验上运用的较多,而MTT还原法也经常被用来检测这些药物处理后细胞的活性变化及增殖等情况。因此,本实验将探讨苯海拉明等有机胺类药物对MTT还原法测定细胞活性准确性的影响。结果显示,高浓度苯海拉明等有机胺类药物可通过抑制甲瓒的外排而促进 MTT还原生成甲瓒,从而干扰实验结果。
1 材料与方法
1.1 实验药品和化学试剂 MTT购自生工生物工程(上海)有限公司。苯海拉明(diphenhydramine)、吡拉明(pyrilamine)、西米替丁(cimetidine)、卓兰替丁(zolantidine)、组胺(histamine)、hoechst 33342、propidium iodide(PI)、多聚赖氨酸、阿糖胞苷购自美国Sigma公司。L-谷氨酰胺、胰酶、DMEM高糖培养基、马血清、胎牛血清购自美国Gibco公司。
1.2 皮层星形胶质细胞培养 参照文献报道[8],在无菌条件下取出新生24 h内的SD大鼠的全脑,小心分离左右半脑,剔除嗅球、纹状体、海马和基底脑组织,将皮层组织移入另一只含有冰冷解剖液的培养皿中,除去软脑膜和血管。用手术刀片将皮层组织捣碎,用0.25%胰酶置于培养皿中,在37℃下消化15~20 min。然后加入适量培养液,用吸管吹打成细胞悬液,接种到经0.1%多聚赖氨酸包被的细胞培养瓶中。24 h后更换培养液,以后每2~3 d更换一次培养液。培养10~12 d后,待培养瓶中细胞铺满瓶底时,换新鲜培养液置于培养箱内2~3 h,随后将培养瓶置于37℃恒温摇床上,以260 r/min的速度振摇过夜,以去除混杂的神经元细胞和小胶质细胞。次日,用PBS液洗涤细胞数次,用0.25%胰酶消化细胞成细胞悬液,按1×105cells/ml密度将细胞接种至培养瓶、培养板或玻片,2~3 d后用于实验。免疫细胞化学结果显示,按此种方法获得的胶质细胞GFAP阳性率>95%。
1.3 药物处理 星形胶质细胞生长至适宜密度后,加入苯海拉明、吡拉明、西米替丁,使其终浓度分别为 10-7、10-6、10-5、10-4、10-3mol/L;加入组胺、卓兰替丁,使其终浓度分别为10-8、10-7、10-6、10-5、10-4mol/L,药物分别作用 24 h,而后观察其对星形胶质细胞MTT还原的影响。在其它实验中采用苯海拉明(10-4mol/L)作用24 h。在各个实验进行时都安排有平行对照组。
1.4 MTT检测法 参照文献报道[9],药物处理完毕后,96孔板细胞每孔加入10 μl MTT(5 mg/ml溶于 PBS),置于37℃,5%CO2培养箱孵育2 h,弃去培养基,加入二甲亚砜(DMSO),振荡10 min左右,待结晶完全溶解后,在酶标仪测定波长490 nm处吸光值(OD490)。以正常对照组所测的MTT吸光值为基数100%,药物处理组与正常对照组的比值百分比来计算药物对星形胶质细胞MTT还原的影响。为了观察MTT还原产生的甲瓒在星形胶质细胞内的分布,培养在玻片上的细胞在药物和MTT处理完后在光学显微镜(Olympus)下观察、拍照。MTT孵育一段时间后,针状晶体有时候出现在细胞的表面,它们被认为是细胞通过胞吐作用排出的甲瓒。
1.5 细胞核荧光染色 为了探索苯海拉明对星形胶质细胞增殖及活性的作用,我们采用了Hoechst 33342和 PI核荧光双染的方法。Hoechst 33342具有高度的脂溶性,可穿透细胞膜,所以很容易进入活细胞以及凋亡的细胞。PI只能进入细胞膜有破损的细胞内,所以只有坏死的细胞才有PI阳性反应。Hoechst 33342和PI用蒸馏水分别配成1 mg/ml的浓度加以贮存,药物处理完后在培养的细胞中加入Hoechst 33342 溶液,使其终浓度为 10 μg/ml,37℃孵育10 min。然后加入PI染液,使其终浓度为 10 μg/ml,4℃,10 min。用 PBS 洗一次,4%多聚甲醛固定,荧光显微镜观察(PI荧光为红色,620 nm;Hoechst 33342荧光为蓝色,480 nm)。每个玻片上随机选取6个视野,拍照,然后细胞计数,分别计算细胞密度(反映细胞增殖情况)和细胞的凋亡及坏死率。
2 结果
2.1 苯海拉明等有机胺类药物对星形胶质细胞MTT还原法的影响 如图1所示,苯海拉明、吡拉明在 10-7、10-6、10-5mol/L,卓兰替丁在 10-8、10-7、10-6mol/L 浓度时,对星形胶质细胞还原MTT为甲瓒的能力没有影响;当苯海拉明、吡拉明浓度为10-4mol/L,卓兰替丁浓度为10-5mol/L时,能显著提高星形胶质细胞内的甲瓒量;然而当苯海拉明、吡拉明浓度达到10-3mol/L,卓兰替丁浓度达到10-4mol/L时,MTT还原为甲瓒的量显著下降,此时光学显微镜下观察发现星形胶质细胞发生严重死亡。组胺(10-8~10-4mol/L)和西米替丁(10-7~10-3mol/L)对星形胶质细胞内MTT还原为甲瓒的量没有影响。
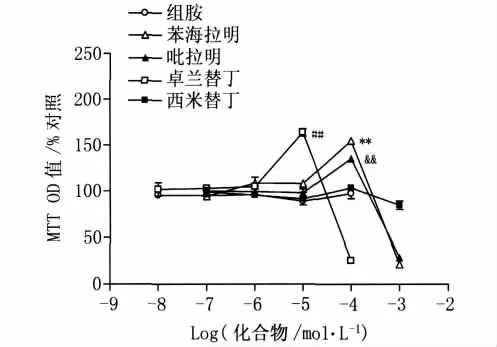
图1 组胺、苯海拉明、吡拉明、卓兰替丁、西米替丁对星形胶质细胞MTT甲瓒生成的影响Fig.1 Effects of histamine, diphenhydramine, pyrilamine, zolantidine and cimetidine on MTT formazan formation in astrocytes
2.2 苯海拉明对星形胶质细胞增殖及活性的影响 MTT还原为甲瓒的量与细胞的活性和数量密切相关,于是我们又采用了 Hoechst 33342和PI核荧光双染的方法,来观察苯海拉明对星形胶质细胞增值和活性的影响。苯海拉明(10-4mol/L)对星形胶质细胞的增殖没有影响[对照组细胞密度为:(2 231±144)个/mm2;苯海拉明处理组细胞密度为:(2 145±115)个/mm2,P > 0.05],见图2a。另一方面,从Hoechst 33342和PI染凋亡和坏死细胞的结果看,苯海拉明(10-4mol/L)孵育24 h,对星形胶质细胞的凋亡和坏死均没有显著影响[对照组细胞凋亡率:(3.54±0.59)%,苯海拉明处理组细胞凋亡率:(4.1±0.89)%,P>0.05;对照组细胞坏死率:(0.16±0.14)%,苯海拉明处理组细胞坏死率:(0.18±0.15)%,P>0.05],见图2b。

图2 苯海拉明对星形胶质细胞增殖和坏死及凋亡的影响Fig.2 Effects ofdiphenhydramine on cell proliferation and necrosis and apoptosis in astrocytes
2.3 苯海拉明对MTT甲瓒的胞吐作用 MTT进入细胞后被还原为甲瓒,先以甲瓒颗粒的形式沉积在细胞内,随着时间的推移甲瓒颗粒逐渐变黑、增大。一段时间后甲瓒颗粒逐渐移向细胞膜,进而被排出胞外,这个过程被称为MTT甲瓒的胞吐作用[10]。在本实验中,MTT甲瓒的胞吐作用被高浓度苯海拉明所抑制。如图3a所示,对照组星形胶质细胞MTT孵育2 h后,绝大多数细胞周围均出现针状甲瓒晶体(箭头所示)。然而苯海拉明(10-4mol/L)处理24 h,显著抑制星形胶质细胞对MTT甲瓒的胞吐作用,使甲瓒仍以颗粒状态沉积于细胞内(图3b,箭头所示)。吡拉明和卓兰替丁均有抑制星形胶质细胞对MTT甲瓒的胞吐作用(数据未显示)。
2.4 pH对苯海拉明抑制星形胶质细胞甲瓒胞吐作用的影响 为了探索pH对苯海拉明抑制星形胶质细胞甲瓒胞吐作用的影响,在孵育苯海拉明前30 min,给细胞更换不同pH培养液,其它成分保持不变。实验结果如图4所示。正常培养液pH(7.2)条件下,苯海拉明抑制星形胶质细胞对MTT甲瓒的外排,如前所述。酸性pH(6.4)条件下,苯海拉明显著抑制星形胶质细胞对MTT甲瓒的胞吐作用,致使胞内甲瓒大量生成,生成量为对照组的136%。而偏碱性pH(8.0)条件下,苯海拉明对MTT甲瓒的胞吐作用没有抑制作用,胞内甲瓒的生成量为对照组的101.57%。
3 讨论
细胞活性和增殖状况的测定是评价药物毒性,检测各种生物活性因子的活性,构建理想的细胞模型等过程不可或缺的步骤。MTT还原法是其中最为简单、迅速和高敏感性的检测细胞活性与增殖的方法。然而,有些生物活性物质或药物本身就能干扰细胞内MTT的代谢,因此,在检测某些化学试剂或药物的生物毒性作用或保护性作用时就要先排除此类因素。
在本实验中,我们采用了苯海拉明、吡拉明、西米替丁、卓兰替丁、组胺5种有机胺类药物。这5种胺类药物作用于星形胶质细胞后,我们发现采用不同的细胞活性测定方法检测出相互矛盾的结果。苯海拉明(10-4mol/L)、吡拉明(10-4mol/L)、卓兰替丁(10-5mol/L)作用于星形胶质细胞24h后,采用MTT还原法测定,结果显示OD490值显著上升,提示这个浓度的苯海拉明、吡拉明和卓兰替丁能够提高星形胶质细胞的活性或者促进星形胶质细胞的增殖。而Hoechst 33342和PI核荧光双染方法显示,苯海拉明(10-4mol/L)作用于星形胶质细胞24 h并没有促进细胞的增殖,同时对细胞的凋亡和坏死也没有影响。Abe等研究发现,淀粉样物质(β-amyloid peptide,βA)通过促进MTT甲瓒的胞吐作用来抑制MTT在细胞内的还原[11]。因此,我们也在显微镜下进一步观察苯海拉明等作用后MTT甲瓒在细胞内的分布状况,发现苯海拉明可以抑制星形胶质细胞对MTT甲瓒的胞吐作用。MTT孵育2 h后,对照组星形胶质细胞膜表面分布着大量针状甲瓒晶体,而在苯海拉明处理组,MTT还原产生的甲瓒仍以颗粒状沉积于细胞内。MTT是一种不透膜的物质,它通过胞吞作用进入细胞[10]。当甲瓒排出细胞后以针状晶体形式附着于细胞膜上,阻止了细胞对胞外MTT的摄取作用,从而减少胞内MTT的浓度,进而减少甲瓒的生成。因此,我们推测苯海拉明是通过抑制甲瓒的外排来减少胞外的甲瓒晶体,使得更多的MTT通过胞吞作用进入细胞,进而产生更多的甲瓒。

图3 苯海拉明抑制星形胶质细胞对MTT甲瓒的胞吐作用Fig.3 Diphenhydramine suppresses MTT formazan exocytosis in astrocytes

图4 pH对苯海拉明抑制星形胶质细胞甲瓒胞吐作用的影响Fig.4 EffectofpH on the inhibition of formazan exocytosis induced by diphenhydramine in astrocytes
在本实验中我们还发现,苯海拉明抑制甲瓒外排的作用与pH相关。当细胞培养液的pH小于7.2时,苯海拉明抑制甲瓒的外排作用比较明显;而当细胞培养液的pH偏碱,如pH为8时,苯海拉明抑制甲瓒的外排作用消失。有文献报道,甲瓒在细胞内形成后主要在溶酶体内积聚,然后被运送到细胞膜周边经胞吐作用而排出[10]。而Morissette等发现,有机胺类如普鲁卡因胺、苯海拉明等在较高浓度时向溶酶体积聚而引起空泡的生成,而且这种作用与pH相关[12]。因此,我们推测偏酸性环境下更多的苯海拉明向溶酶体积聚,从而影响运载有甲瓒的溶酶体向细胞膜的移动以及胞吐过程。而在偏碱性环境下,苯海拉明向溶酶体内积聚的作用减弱,从而使运载有甲瓒的溶酶体能够正常向细胞膜靠近并进行胞吐。
总之,苯海拉明等一些有机胺类药物能够影响星形胶质细胞对MTT甲瓒的胞吐作用,从而影响MTT还原法在检测这类药物对星形胶质细胞活性及增殖作用的结果的准确性。因此,使用有机胺类药物对细胞活性或增殖进行研究时,应谨慎选择检测方法。此外,使用MTT方法时也应谨慎检查反应体系的各项潜在影响因素,使实验所得数据能真实反应事实。
[1]MORGAN D M.Tetrazolium(mtt)assay for cellular viability and activity[J].Methods Mol Biol,1998,79:179-183.
[2]MOSMANN T.Rapid colorimetric assay for cellular growth and survival:Application to proliferation and cytotoxicity assays [J].J Immunol Methods,1983,65:55-63.
[3]AHMAD S,AHMAD A,SCHNEIDER K B,et al.Cholesterol interferes with the mtt assay in human epithelial-like(a549)and endothelial(hlmve andhcae)cells[J].Int J Toxicol,2006,25:17-23.
[4]SMITH M D,BARBENEL J C,COURTNEY J M,et al.Novel quantitative methods for the determination of biomaterial cytotoxicity[J].Int J Artif Organs,1992,15:191-194.
[5]LOVELAND B E,JOHNS T G,MACKAY I R,et al.Validation of the mtt dye assay for enumeration of cells in proliferative and antiproliferative assays[J].Biochem Int,1992,27:501-510.
[6]BRUGGISSER R,VON DAENIKEN K,JUNDT G,et al.Interference of plant extracts,phytoestrogens and antioxidants with the mtt tetrazolium assay[J].Planta Med,2002,68:445-448.
[7]VISTICA D T,SKEHAN P,SCUDIERO D,et al.Tetrazolium-based assays for cellular viability:A critical examination of selected parameters affecting formazan production [J].Cancer Res,1991,51:2515-2520.
[8]SHEN Y,HE P,FAN Y Y,et al.Carnosine protects against permanent cerebral ischemia in histidine decarboxylase knockout mice by reducing glutamate excitotoxicity [J].Free Radic Biol Med,2010,48:727-735.
[9]SHEN Y,HU W W,FAN Y Y,et al.Carnosine protects againstnmda-induced neurotoxicity in differentiated rat pc12 cells through carnosinehistidine-histamine pathway and h(1)/h(3)receptors[J].Biochem Pharmacol,2007,73:709-717.
[10]LIU Y,PETERSON D A,KIMURA H,et al.Mechanism of cellular 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (mtt)reduction[J].J Neurochem,1997,69:581-593.
[11]ABE K,SAITO H.Amyloid beta protein inhibits cellular mttreduction notby suppression of mitochondrialsuccinate dehydrogenase butby acceleration of mtt formazan exocytosis in cultured rat cortical astrocytes[J].Neurosci Res,1998,31:295-305.
[12]MORISSETTE G,MOREAU E,R C G,et al.Massive cell vacuolization induced by organic amines such as procainamide[J].J Pharmacol Exp Ther,2004,310:395-406.
