O3/UV高级氧化法去除腈纶废水生化出水中COD的研究
2011-02-08周朝晖史红芳孟志国尉国红关云峰
周朝晖 ,史红芳 ,孟志国 ,尉国红 ,关云峰
(1.江苏省纯江环保科技有限公司,江苏 宜兴 214215;2.北京城建环保投资发展股份有限公司,北京 100124)
腈纶生产分干法和湿法两种,其中干法腈纶生产过程中产生的废水水质复杂,污染物主要有丙烯腈、丁二腈、乙腈、二甲基甲酞胺,硫酸盐和较多的低聚物[1],其中大多数属于难降解物质。目前,国内干法腈纶废水的处理工艺主要有内电解-Fenton氧化-序批式膜生物反应器组合工艺,厌氧-好氧-生物活性炭处理工艺,厌氧-缺氧-好氧处理工艺,混凝-两相厌氧-缺氧-好氧工艺等[2-4]。其中一些处理工艺确实取得了不错的处理效果,但一些难生物降解的物质仍残留在水中,出水仍普遍不能达到国家排放标准,且更加难以处理,还需要更深一步的处理。在腈纶废水深度处理的方法中,高级氧化法是处理这种废水相对比较有效的方法之一。
高级氧化技术(Advanced Oxidation Processes,AOPs)是一大类反应过程的总称,包括高温高压下的超临界水氧化,也包括常温常压下由光、声、催化剂等所诱导的过程[5];工艺包括:臭氧紫外光(O3/UV)、过氧化氢紫外光(H2O2/UV)、过氧化氢臭氧(H2O2/O3)等方法[6]。O3/UV法始于二十世纪70年代,因其反应条件温和(常温常压)、氧化能力强而发展迅速。其基本原理是羟基自由基(·OH)通过电子转移、亲电加成、脱氢反应等途径矿化水中的各种污染物[7-9]。
在整个O3/UV体系中,O3氧化有两种方式:(1)由O3分子或单个O原子直接参与反应;(2)由O3衰减产生的·OH自由基引起。OH-的氧化还原电位为2.8V,仅次于F(2.87V),是水中存在的最强氧化剂,几乎无选择性地和废水中所有的污染物发生反应,将甘油、乙醇、乙酸等O3不能氧化分解的一些中间产物,彻底氧化为CO2和H2O。Glaze等研究了芳香烃、卤素等有机物的O3/UV氧化过程,提出了O3与紫外光之间的协同作用机理,可描述如下[6]:
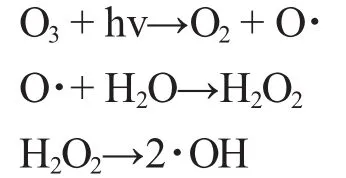
O3与UV的协同作用产生了OH-,OH-还可诱发一系列的链反应,产生其他基态物质和自由基,强化了氧化作用,使污染物的降解变得快速而充分[10]。
本实验通过研究O3/UV高级氧化技术处理腈纶废水生化出水的协同作用,探讨反应时间、pH值和污染物浓度等条件参数对处理效果的影响,对生化出水进行深度处理,同时,确定最佳运行条件,为工程实践提供理论依据。
1 实验部分
1.1 实验装置

图1 反应装置示意图Fig.1 Schematic diagram of O3/UV experimental process
1.2 实验水质
实验用水选用某干法腈纶生产厂的生化处理出水,其水质与生化之前相比具有以下特征:(1)经过之前的生化处理,COD浓度较低,且残留COD组成绝大多数为难以生物降解的有机物;(2)水样中存在着较高浓度水平的NH3-N和一定量的硝化抑制剂,如丙烯腈,二甲基甲酰胺(DMF),乙二胺四乙酸(EDTA)等,它们使微生物的硝化过程难以发生。这些特性都加大了生化处理出水深度处理的难度。实验所用水样具体的水质指标见表1。
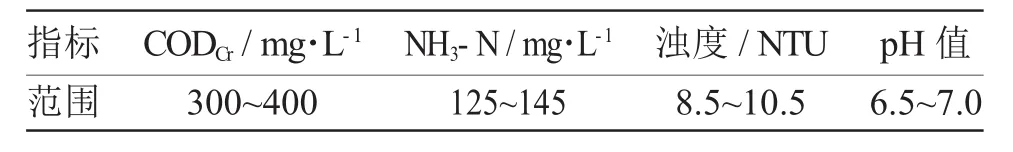
表1 废水水质指标Tab.1 Water quality indicators in wastewater
1.3 实验方法
取900mL实验用水置于1000mL的带有橡胶塞的广口瓶,盖紧瓶塞,通入臭氧,并用30W的紫外灯照射,定时取样检测相关数据。
1.4 分析方法
CODCr采用重铬酸钾法测定。
pH值用便携式pH测量仪测定。
2 结果与讨论
2.1 污染物浓度对处理效果的影响
为考察污水中不同污染物浓度时,O3/UV协同作用下处理效果的差异,将腈纶合成废水分别稀释2倍和3倍进行了对比实验。稀释用水为自来水,反应时间为1h,COD去除率随时间的变化见图2。

图2 污水稀释倍数对COD去除率的影响Fig.2 Effects of dilution ratio on COD removal rate
在相同的实验条件下,确定处理水样的最佳浓度。从图2中可以看出,3种浓度的水样COD去除率均随时间的升高而升高,当变化的幅度有很大差异。其中,原水的COD去除率一直维持在很低的水平,最高只能达到20.56%;原水的浓度被稀释3倍时,COD去除率最高,可达到60.35%,远远高于浓水的去除率;浓水稀释2倍的COD去除率也很高,可以达到52.88%,且在反应进行的后期二者的去除率越来越接近。这是因为,在一定浓度的臭氧发生量和一定功率的紫外光辐照下,单位时间和体积内,废水中的污染物吸收的光子数量和与之反应的自由基数量是一定的。如果污染物起始浓度降低,而单位时间内降解的污染物绝对数量变化很小,所以可以显著提高COD的降解率。根据排放标准要求可以直接排入污水体系,COD浓度应小于100mg·L-1,稀释 2 倍后浓度为 150~200mg·L-1。此时,COD去除率已经超过了50%,实验结果完全可以满足排放要求,出水可直接排入污水体系。稀释3倍时,COD浓度为100~133mg·L-1,接近排放要求,处理的意义不大,且需要更多的水资源来稀释。因此,确定最佳稀释倍数为2倍,接下来考察各种反应条件的实验均使用原实验用水稀释2倍后的稀释水。
2.2 反应时间的确定
考虑到原水COD在200~300mg·L-1范围内波动,稀释 2 倍后,COD 为 100~150mg·L-1,属于 COD浓度较低的情况,因此,观察O3/UV协同作用处理2h的COD去除率变化,见图3。
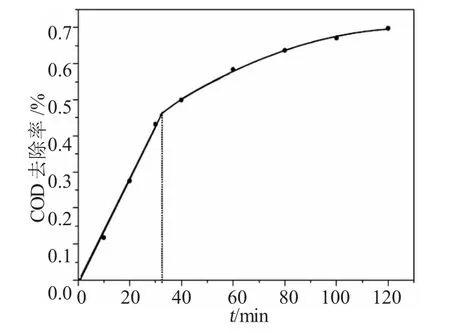
图3 反应时间COD去除率的影响Fig.3 Effects of reacting time on COD removal rate
由去除率变化可知,在前1h内COD去除速度较高,60min时去除率达到了59.35%。在前30min内COD去除效率都保持在较高的水平,在反应时间为30min时,去除率已经达到43.18%;在后面的时间里,COD的去除率变化不大,基本趋于稳定,最高仅升高到70.08%,去除效率不高。运用数学模拟,整个反应过程COD去除率与时间的变化关系可被模拟为一个两段函数:
当x≤35.6时,方程为y=0.0132x,方差σ2=0.986;
当35.6<x≤120时,方程为y=-0.00003x2+0.0073x+0.2484,方差 σ2=0.9954。
由函数可以看出,前一段反应的去除率与时间呈较明显的线性关系。在此阶段,污水中存在的易被氧化的有机污染物含量较多,基本符合一级动力学反应。当反应进行到35.6min时,COD去除率达到47%,函数出现转折点。此时,易被氧化的污染物消耗殆尽,降解过程进入瓶颈期,反应速度开始减慢。在之后的85min内,反应的去除率仅提高23%。从整个反应过程看,当反应进行时间为30min时,COD浓度已经可以达到 59.4~79.2mg·L-1,达到了所要求的排放标准100mg·L-1,可以通过调整其他反应条件达到目标效果。因此,确定反应进行时间为30min。
2.3 pH值对处理效果的影响
由之前的实验结果,确定考察反应进行30min时,在不同初始pH值情况下的COD去除率,以确定反应适合的初始pH值范围,实验结果见图4。
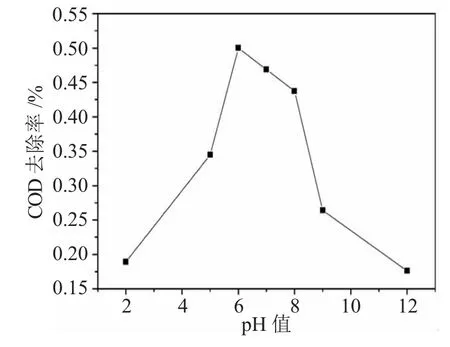
图4 初始pH值对COD去除率的影响Fig.4 Effects of initial pH value on COD removal rate
根据臭氧氧化机理[11]可知,随着pH值升高,溶液OH-离子浓度增加,O3氧化反应方式由偏酸性条件下的直接氧化反应转向羟基自由基(·OH)引发的链式反应,从而促进O3的分解,生成羟基等自由基,表现出高的COD去除率。一方面,当溶液中偏碱性时,O3自分解加剧,产生更多的羟基自由基,此时,自由基型反应占主导位置,与直接O3氧化反应相比,自由基型反应速度更快,选择性更低;另一方面,由于液相中臭氧的快速分解,在气液相界面上O3浓度差增大,扩散速率增加,氧化效率提高较快,也使整个反应加快。但pH值过高时,使O3的自分解速度加快,导致O3对有机物氧化中起关键作用的羟基自由基在水中的浓度降低,O3对COD的降解效果反而有所减弱。
在整个体系中,当反应在pH值小于6.5时,处于偏酸性环境,反应以直接氧化为主,由于O3的氧化能力低于羟基自由基,体系表现出了较低的COD去除率;随着pH值的升高,当pH值在6.5~8.5时,反应体系产生了越来越多的羟基自由基,COD去除率明显升高,可以保持在40%~50%;当pH值大于8.5时,能够溶解在水中的O3分解速度过快,所产生的羟基自由基浓度降低,使COD去除率变小。因此由实验结果可知,适合O3/UV处理腈纶废水生化出水的pH值范围为6.5~8.5。
2.4 投加NaHCO3对处理效果的影响
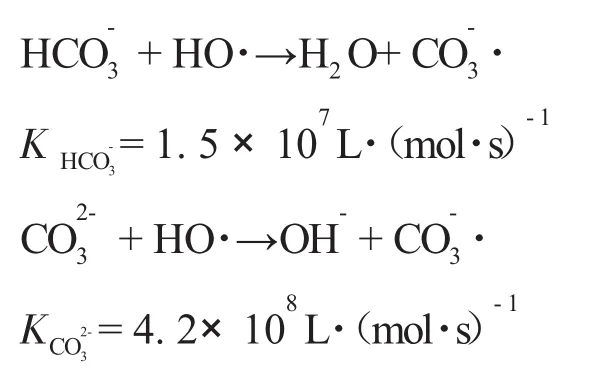
尽管理论如此,但近年来,研究者们在实验中却发现了越来越多的相反现象,甚至有研究表明,的存在有助于COD的去除。因此,试验向实验用水中投加一定量的NaHCO3,观察其COD去除率的变化情况,实验结果见图5。
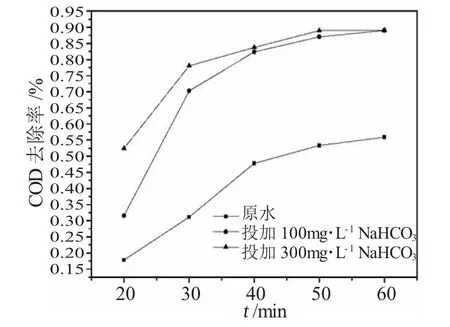
图5 投加NaHCO3对COD去除率的影响Fig.5 Effects of adding NaHCO3on COD removal rate
由实验结果可知,在相同反应时间内,比较在反应体系中投加NaHCO3和不投加的情况,投加NaHCO3的最高COD去除率可以达到89%,远远高于不投加所能达到的56%。早在1998年,Acero和Von Gunten[12,13]曾经在H2O2催化臭氧化过程中发现过类似的现象,的存在促进了有机物的降解。他们分析认为,和与羟基自由基反应生成的可以与H2O2反应生成超氧自由基,超氧自由基与O3进一步反应生成羟基自由基。因此,在有H2O2存在的条件下,也可以成为羟基自由基的促进剂。
O3/UV虽然在机理上与O3/H2O2有一些差异,但其反应过程也会产生羟基自由基和一定量的H2O2。这些H2O2可以与与羟基自由基反应生成的反应,产生超氧自由基促进了有机物的氧化降解,即在O3/UV体系中投加NaHCO3同样有助于COD的降解。
实验中分别向稀释2倍后的实验水中投加100mg·L-1的NaHCO3,经过1h的反应,发现COD的去除率得到了明显的提高,在反应进行到30min时,COD去除率可以超过70%,达到了处理要求;当反应时间为40min时,去除率就达到了82.33%,即水中COD的浓度降低到30mg·L-1以下。当NaHCO3投加量被提高到200mg·L-1时,在相同的污染物浓度、pH值和反应时间内观察COD去除率,发现此条件下反应约25min即可达到处理要求。二者在反应时间超过40min时,COD去除率保持稳定,维持在80%~90%之间。由此可以看出,水中的碳酸氢根的确可以提高COD的去除率,有利于有机物的降解,在O3/UV协同氧化体系中印证了Acero等人对这种现象反应机理的推断。实验还发现,适当的提高NaHCO3的投加量可以有效的缩短反应所需的时间,提高反应效率,降低反应成本。
3 结论
(1)当实验用水直接用于O3/UV反应时,其COD去除率一直保持在很低的水平;当被稀释2或3倍后,去除率得到了大幅度的提高,反应1h时的COD去除率都大于50%,虽然稀释3倍的情况略好于2倍的情况,但当污水被稀释3倍时,本底的COD浓度已经很接近处理所要求的排放标准,并且需要更多的稀释水,失去了处理的意义。因此,稀释2倍后的反应浓度较适宜。
(2)经过实验发现,确定O3/UV反应进行时间为30min,既可以达到满意的处理效果,又缩短了反应时间,节约了处理成本。在这个阶段,COD去除率与时间有明显的线性关系,当反应时间为35.6min时,出现了处理效率的拐点,此时的去除率达到47%;继续延长反应时间至2h,COD去除率仅提高23%,对去除率变化影响不大,反应逐渐趋于稳定。
(3)通过对反应时间为30min时各个初始pH值条件下COD去除率的考察,发现整个反应体系所依赖的反应机理是直接氧化和羟基自由基氧化的共同作用,适合反应进行的初始pH值为6.5~8.5。偏酸性的环境不利于产生氧化能力更强的羟基自由基;偏碱性的环境会导致O3的分解速度过快,同样会降低羟基自由基的浓度。
[1]Ekama G A,Wentzel MC.Difficulties and developments in biological nutrient removal technology and modeling[J].Water Science and Technology,1999,39(6):1-11.
[2]Lu Bin,Wei He-ping.Studyon enhanced treatment nitrilon chemical industry wastewater by internal electrolysis process[J].Journal ofTongji University,2001,29(11):1294-1298.
[3]Zhang Han-Min.Comparison between a sequencing batch membrane bioreactor and a conventional membrane bioreactor[J].Process Biochemistry,2006,41:87-95.
[4]Yang Xiao-yi,Shi Shao-qi,Jiang Zhan-peng et al.Study on treatment of polyacrylonitrile fiber wastewater by coagulation-anaerobic-anoxic-aerobic process[J].Water&Wastewater Engineering,2001,27(6):40-44.
[5]孙剑峰,王智化,刘建忠,等.臭氧/紫外联合降解甲醛的试验研究[J].环境工程学报,2009,3(3):506-510.
[6]吴迪,刘淼,董德明,等.影响羟基自由基在O3/UV体系中生成规律的因素[J].吉林大学学报(地球科学版),2007,37(1):148-152.
[7]王欣泽,王宝贞,王琳.臭氧-紫外光深度氧化去除水中有机污染物的研究[J].哈尔滨建筑大学学报,2001,34(2):70-73.
[8]Yung-Shuen Shen,YoungKu.Treatment of gas-phase volatile organic compounds bythe UV/O3process[J].Chemosphere,1999,38(8):1855-1866.
[9]Temesgen G,Mirat D G.Degradation of Tert-Butyl alcohol in dilute aqueous solution by an O3/UV process[J].Environ.Sci.Technol.,2004,38:5246-5252.
[10]Parag R Gogate,Aniruddha B Pandit.A review of imperative technologies for wastewater treatmentⅡ:hybrid methods[J].Advanced in Environmental Research,2004,(8):553-597.
[11]丁春生,缪佳,秦树林,等.臭氧/活性炭/紫外光联用处理几种高浓度有机废水影响因素[J].环境科学学报,2008,28(3):496-501.
[12]于颖慧,侯艳君,高金胜,等.水中本底成分对O3/H2O2氧化降解2,4-D的影响[J].环境科学学报,2007,27(8):1311-1316.
[13]AceroJ L,Konrad S,Von Gunten U.Influence of Carbonate on the Ozone/Hydrogen Peroxide Based Advanced Oxidation Process For DrinkingWaterTreatment[J].OzoneSci.Eng.,1998,22:305-328.
