钙离子和氯化钴促进成纤维细胞色素上皮衍生因子的表达
2011-02-08杨明峰程厚文孙保亮谢方民张颜波
杨明峰 程厚文 孙保亮,2 袁 慧,2 谢方民,2 张颜波,2
(1泰山医学院附属医院; 2山东省高校脑微循环重点实验室 泰安 271000)
血管新生的调节影响一系列的生理和病理过程,其中最重要的、也是效力最强的血管新生抑制剂是色素上皮衍生因子(pigment epithelium-derived factor,PEDF)[1]。截至目前,多项研究已经证实PEDF广泛表达于人体多种组织中,而且发挥多种不同的生物学功能[2]。已有研究发现,皮肤中PEDF主要表达于真皮层[3]。为了进一步证实PEDF在真皮成纤维细胞的表达,以及钙离子和氯化钴对其表达的影响,我们进行了初步的研究。
材料和方法
1.标 本来源
19例包皮标本均来自男性包皮环切术者,此前三个月内未接受过其它任何治疗。年龄11-59岁,平均年龄31.36±13.19。以40岁为界,将标本分为组 I(40岁以下,13例,平均年龄23.76±6.60)和组 II(40岁以上,6例,平均年龄47.83±6.41)。标本切除后,立即在无菌通风橱中剪取小块真皮组织,置于0.1%I型胶原酶(Gibco,Invitrogen,美国)中4oC过夜。
2.成 纤维细胞的培养
在过夜后的I型胶原酶中加入胎牛血清中止反应,轻轻吹打组织,离心后获得成纤维细胞,使用高糖DMEM培养基(内含10%胎牛血清、100U/ml青霉素、100μg/ml链霉素)种植于 50ml培养瓶中,培养条件为5%CO2、恒温37°C培养箱。
3.免 疫荧光检查
成纤维细胞用0.25%胰酶/EDTA消化并吹打成单个细胞后,以4×105密度接种于预先放置有无菌盖玻片的六孔板中。待细胞爬片至约60-70%后取出盖玻片,4%多聚甲醛室温固定20min,PBS冲洗。置入预热的10m mol/L枸橼酸钠缓冲液(p H 7.5)95°C加热20min进行抗原释放,然后以10%山羊血清室温封闭1h,抗PEDF抗体(Sant-Cruz,美国)4°C孵育过夜。PBS洗后,FITC标记的山羊抗兔二抗(1:50,Jackson,美国)避光条件下室温孵育2h,然后用碘化丙啶复染20min,最后在荧光显微镜下观察并拍照。以正常小鼠血清IgG1取代一抗作阴性对照。
4.钙 离子和氯化钴对PEDF的作用
取生长于50ml培养瓶中融合度约90%的成纤维细胞,用无血清MEM/0.5%BSA饥饿24h后,1.0mM氯化钙或100u mol/L氯化钴孵育24h后中止反应,同时以PBS作为对照。
5.逆 转录-聚合酶链反应(RT-PCR)
细胞总 RNA的提取按照说明书进行操作。20μl逆转录体系包括 4μl 5×逆转录酶缓冲液、50mmol/L dNTP 混合液、0.5μg Oligo(dT)18、2μg总 RNA、20U RNA酶抑制剂 (Promega)、200U MMLV 逆转录酶(Promega)、DEPC水补足 20μl。42°C 60min 逆转录成 cDNA,95°C 10min 热灭活逆转录酶后,-20°C保存备用。
引物参照已发表文献[4],由上海生工公司合成。PEDF 引 物 (5’-GTCTTTGA GAAGAAGCTGCGC-3’/5’-TCCACCTTGAGTCAGCTTGAT-3’)扩增片断长645 bp。PCR反应采用 25μl体系 (10 pmol各对上下游引物、200mmol/L dNTP混合液、2mmol/L MgCl2、p H 8.3 10mmol/L Tris-HCl、50mmol/L KCl、2U Taq 酶、1μl cDNA)。反应程序为:95 °C 5min,1 循环;95°C 1min,59°C 1min,72 °C 1min,35循环;72°C 10min。反应产物在含有适量溴化乙锭的1.5%的琼脂糖凝胶中电泳,在凝胶成像仪观察并拍照,产物测序由上海生工公司完成。以未加逆转录酶的总RNA逆转录产物代替cDNA模板作为阴性对照 ,排除DNA污染。GAPDH(5 ’-ATGCCGCTATCGAAAATGTCTT-3 ’/5 ’-AA TCACTTGCCGCCC TCCTA-3’)作为内对照。
6.统 计学分析
将RT-PCR扩增条带和 Western blot条带密度分别与相对应的 GAPDH条带密度进行比较。计量资料利用SPSS 13.0软件包中ANOVA进行统计学处理。
结 果
1.免 疫荧光结果
免疫荧光检查发现PEDF大量表达于培养的成纤维细胞胞浆中(图1A),而阴性对照未见表达(图 1B)。
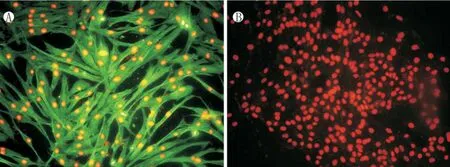
图1 PEDF在成纤维细胞中的免疫荧光定位。A,PEDF抗体孵育,绿色荧光信号为PEDF,红色荧光信号为碘化丙啶负染细胞核。B,阴性对照。(×200)Fig.1 Immunolocalization of PEDF in fibroblasts.A.Fibroblasts incubated with anti-PEDF antibody. Green signal is PEDF,red signal is PI.B.Negative control.(×200)
2.正 常成纤维细胞表达 PEDF mRNA,但在不同年龄段之间差异无显著性
RT-PCR检测发现成纤维细胞表达PEDF mRNA(图2),PCR产物位于645bp。组 I表达条带相对密度值为1.192±0.115,组II条带相对密度值为1.181±0.075,二者相比无统计学差异(P>0.05)(图 2)。
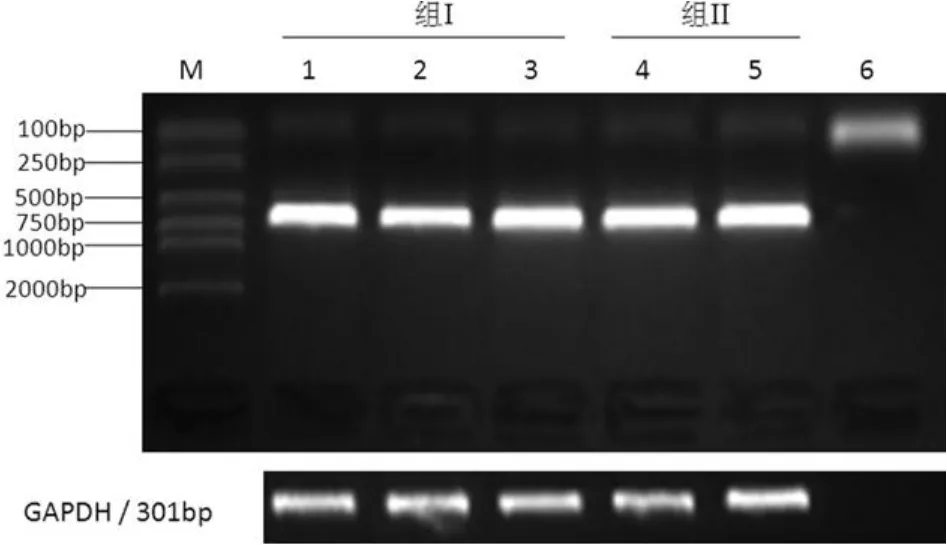
图2 正常成纤维细胞表达 PEDF的 RT-PCR结果。PEDF扩增片断长度为645bp。GAPDH扩增301bp片段作为内参照。M为DNA分子量标准,Lane 6为阴性对照。Fig.2 Expression of PEDF at mRNA level determined by RT-PCR.PCR product of PEDF is at 645bp.GAPDH served as an internal control.M,DNA molecular weight;Lane 6,negative control.
3.钙 离子和氯化钴促进成纤维细胞PEDF mRNA的表达
1.0 mmol/L氯化钙孵育24h后,PEDF mRNA条带相对密度值为 2.592±0.315,是未孵育前(1.122 ±0.091)的 2.3 倍(P<0.01)(图 3);100μ mol/L氯化钴孵育24h后,PEDF mRNA条带相对密度值为1.611±0.155,是未孵育前的1.4倍(P<0.05)(图 3)。

图3 钙离子和氯化钴作用后 PEDF mRNA的表达。M,DNA分子量标准;Lane 1,无钙离子或氯化钴作用的成纤维细胞;Lane 2-4,钙离子孵育的成纤维细胞;Lane 5-7,氯化钴作用的成纤维细胞;Lane 8,PBS对照;Lane 9,阴性对照。Fig.3 Expression of PEDF mRNA after incubated with calcium and CoCl2.Lane 1,fibroblasts without calcium or CoCl2;Lane 2-4,fibroblasts incubated with calcium;Lane 5-7,fibroblasts incubated with CoCl2.Lane 8,a PBS control;Lane 9,negative control.
讨 论
PEDF是一分泌糖蛋白,最初发现于胎儿视网膜色素上皮细胞,能够诱导培养的视网膜母细胞瘤细胞向神经细胞分化[5]。后来的研究发现PEDF表达于多种组织和细胞,包括角膜、肺、肾脏、胰腺、前列腺、骨、睾丸以及软骨基质等[6,7]。而且,PEDF具有很强的血管生成抑制作用[1,8],具有多种生物学功能[2]。最近的一些研究发现,PEDF与多种病理状态如慢性炎症性疾病、动脉粥样硬化、糖尿病并发症以及肿瘤等具有相关性[9,10]。PEDF不仅具有抗血管新生作用,而且是一重要的内源性抗炎症因子[11],PEDF可能通过减少 TNF和 IL-18发挥抗炎症作用[12]。PEDF也能够诱导细胞的分化[13]。正是基于对 PEDF多种作用的认识,我们研究了PEDF在皮肤真皮成纤维细胞中的表达。
1999年,Tresini等发现人真皮成纤维细胞表达PEDF[14],后来又有研究进一步验证了 PEDF在真皮成纤维细胞的表达[3]。我们的研究亦表明,成纤维细胞表达PEDF mRNA及其蛋白质,且免疫荧光结果显示PEDF主要分布在成纤维细胞胞浆中。但是,我们的研究没有发现 PEDF在不同年龄段人群之间的差异,这与 Francis等[3]的研究结果相反,他们发现随着年龄的增加,PEDF表达有降低的趋势。这一结果的差异可能由于我们所研究的高年龄段人群相对较少的缘故。
由于考虑到钙离子在细胞的增殖和分化中的重要作用,以及氯化钴对缺氧的诱导作用,我们又进一步研究了钙离子和氯化钴对 PEDF的调解作用。从我们的研究结果看,钙离子和氯化钴均能促进成纤维细胞PEDF mRNA的表达,而且钙离子的作用似乎更强一些。其中的机制值得进一步深入研究。结合近来有关 PEDF的表达能够被10%FBS促进[15],这些结果说明,PEDF在皮肤中的表达可能受到血清中多种因素的调节,包括血清中的钙离子和由于缺氧导致的血清中某些细胞因子的改变等。
总之,我们的研究发现,PEDF表达于真皮成纤维细胞,而且其表达受钙离子和氯化钴诱导的缺氧的调解。这一结果说明,我们可以通过调节钙离子或缺氧,来调节 PEDF的表达,从而达到调节真皮血管新生的作用。
[1]Dawson,D.W.Pigment epithelium-derived factor:a potent inhibitor of angiogenesis. Science 1999,285:245-248
[2]Ek ET,Dass CR,Choong PF.PEDF:a potential molecular therapeutic target with multiple anti-cancer activities.Trends Mol Med,2006,12:497-502
[3]Francis MK,Appel S,Meyer C,et al.Loss of EPC-1/PEDF Expression During Skin Aging In Vivo.J Invest Dermatol,2004,122,1096-1105
[4]Hattenbach LO,Beck KF,Pfeilschifter J,et al.Pigment-epithelium-derived factor is upregulated in photocoagulated human retinal pigment epithelial cells.Ophthalmic Res,2005,37:341-346
[5]Tombran-Tink J and Johnson L V.Neuronal differentiation of retinoblastoma cells induced by medium conditioned by human RPE cells.Invest.Ophthalmol.Vis.Sci,1989,30:1700-1707
[6]Bard MP,Hegmans J P,HemmesA,et al.Proteomic analysis of exosomes isolated from human malignant pleural effusions.Am J Respir Cell Mol Biol,2004,31(1):114-121
[7]Maik-Rachline G,Seger R.Variable phosphorylation states of pigment-epithelium-derived factor differentially regulate its function.Blood,2006,107(7):2745-2752
[8]Bouck N. PEDF:anti-angiogenic guardian of ocular function.Trends Mol Med,2002,8:330-834
[9]Filleur S,Volz K,Nelius,et al.Two functional epitopes of pigment epithelialderived factor block angiogenesis and induce differentiation in prostate cancer. Cancer Res,2005,65:5144-5152
[10]Zhang SX,Wang JJ,Gao G,et al.Pigment epithelium-derived factor(PEDF)is an endogenous antiinflammatory factor.FASEB J,2006,20:323-325
[11]Zhou X,Li F,Kong L,et al.Anti-inflammatory effect of pigment epithelium-derived factor in DBA/2J mice.Mol Vis,2009,15:438-450
[12]Filleur S,Nelius T,de Riese W,et al.Characterization of PEDF:a multi-functional serpin family protein.J Cell Biochem,2009,106:769-775
[13]Tresini M,Pignolo RJ,Allen RG,et al:Effects of donor age on the expression of a marker of replicative senescence(EPC-1)in human dermal fibroblasts.J Cell Physiol,1999,179:11-17
[14]满孝勇,姚永刚,杨晓红,等.胎牛血清促进色素上皮衍生因子在皮肤角质形成细胞和成纤维细胞中的表达.浙江大学学报医学版,2009,38(4):343-347
