流式细胞仪检测非小细胞肺癌患者活性循环内皮细胞初探
2011-02-06孙洪岩张爱梅操乐杰徐修才
孙洪岩,张爱梅,操乐杰,李 庆,徐修才
(安徽省合肥市安徽医科大学附属省立医院,安徽合肥,230001)
血管生成不仅为肿瘤生长提供新陈代谢的营养物质,也为肿瘤细胞的分化、转移提供了潜在的路径[1]。循环内皮细胞(CECs)在肿瘤血管新生和肿瘤生长方面起着重要作用,它可以作为反映肿瘤血管生成及监测抗血管治疗药物疗效的标记物[2-3]。本研究以 CD45-PC5、CD146-PE、CD106-FITC抗体为标记,测得CD45-/dim CD146+为成熟的 CECs,CD45-/dim CD146+CD106+为活性CECs(aCECs),以了解非小细胞肺癌(NSCLC)患者与健康人群外周血CECs和aCECs数量上的差异。
1 资料与方法
1.1 一般资料
选取本院呼吸科2009年9月~2010年7月期间收治的经组织病理学或细胞学确诊的进展期NSCLC患者 60例,常规行胸部CT、脑 MRI、骨扫描及腹部 B超检查,以2009年版国际肺癌TNM分期标准进行分期。并满足以下标准:年龄>18岁;没有缺血性心脏病、系统性脉管炎、肺动脉高压、感染性疾病、糖尿病、免疫性疾病、其他原发性肿瘤;自愿加入本实验,并签定书面知情同意书。60例肺癌患者(NSCLC 56例)中男40例,女20例,中位年龄64岁(31~81岁)。鳞癌23例,腺癌32例,鳞腺癌1例,小细胞肺癌 4例。NSCLC患者中Ⅰ、Ⅱ期4例,Ⅲ期15例,Ⅳ期37例。选取本院体检中心健康人群30例为对照组,男 19例,女 11例,中位年龄47岁(23~68岁)。
1.2 仪器与试剂
科大创新公司生产KDC-6000R低速冷冻离心机,美国Beckman-Coulter公司生产流式细胞仪(型号为 EPICS-XLⅡMCL;分析系统软件为SystemⅡ)。淋巴细胞分离液(Cat:LTS1077)由天津灏洋生物有限公司生产,CD45-PE-Cy5抗体(PN:IM2653U)由Beckman-Coulter公司生产,CD146-PE抗体(Cat:550315)、CD106-FITC抗体(Cat:551146)均由美国BD Bioscience公司生产,溶血剂为0.83%的氯化铵溶液,由本实验室用去离子蒸馏水自行配制。
1.3 方法
1.3.1 标本的采集:于治疗前1 d抽取NSCLC患者1 mL静脉血于血常规管中检测血常规用,再取5 mL静脉血于肝素钠抗凝管中,4℃冰箱保存备用,2 h内进行标本检测。健康对照组标本在本院体检中心体检时抽取。
1.3.2 标本的处理:取7.5 mL淋巴细胞分离液于专用离心管中,将5 mL肝素钠抗凝管中外周血用塑料吸管缓慢加入淋巴细胞分离液面上;1 800 r/min离心15 min;弃去离心管上层血浆,取尽第2层环状乳白色淋巴细胞层约1.5 mL,加3倍PBS液;1 300 r/min离心5 min;弃上清液,留取下层细胞悬液 100~200 μ L 备测;取50 μ L 备测细胞悬液到已加入 2 μ L CD45-PE-Cy5 、10 μ L CD146-PE、10 μ L CD106-FITC 的专用流式试管中,振荡混匀,室温避光孵育15 min;加入溶血剂500 μ L,振荡混匀,室温避光孵育 10 min;完全溶血后在15 min内上流式细胞仪检测。
1.3.3 标本的检测:检测前常规对流式细胞仪进行光流路质量调控和荧光补偿,使仪器各项指标在质量控制允许值范围。检测时首先根据前向(FSC)和侧向(SSC)散射光信号对单个核细胞群(包括淋巴细胞及单核细胞)进行设门,以避免红细胞、血小板、细胞碎片及中性粒细胞对检测结果的影响,每份标本获取设门内细胞在100000个以上,检测后数据以Listmode文件形式保存。再以CD45(即CD45-/dim/+细胞群)设C门(占单个核细胞群的百分比为R1%),CD45-/dim CD146+的成熟CECs占门内百分比为R2%,CD45-/dim CD146+CD106+aCECs占门内百分比为R3%(图1-3)。
1.3.4 CEC及aCECs的数量计算:根据同期患者的血常规检查结果中淋巴细胞(L)及单核细胞(M)细胞数,把流式细胞仪检测结果换算为每mL细胞数。CECs=(L+M)×R1%×R2%,aCECs=(L+M)×R1%×R3%。
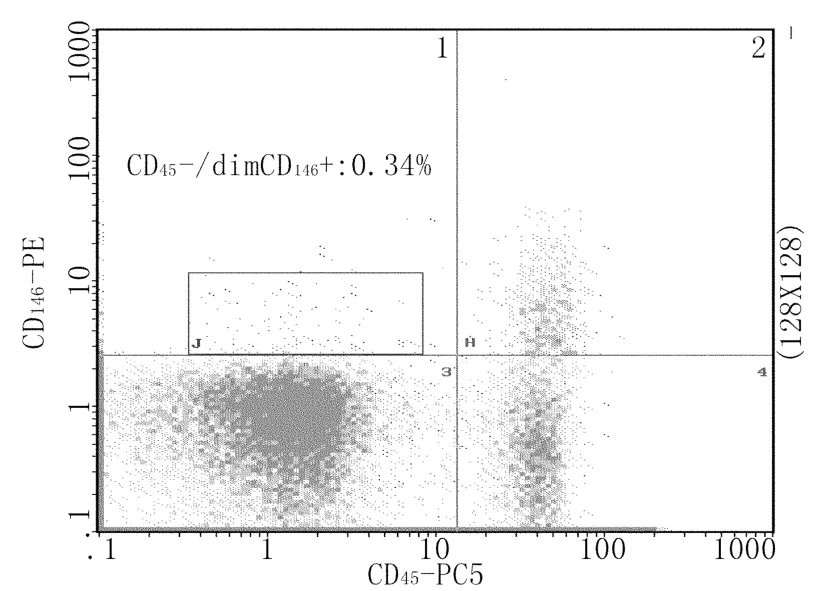
图1 CD45-/dim CD146+细胞流式图
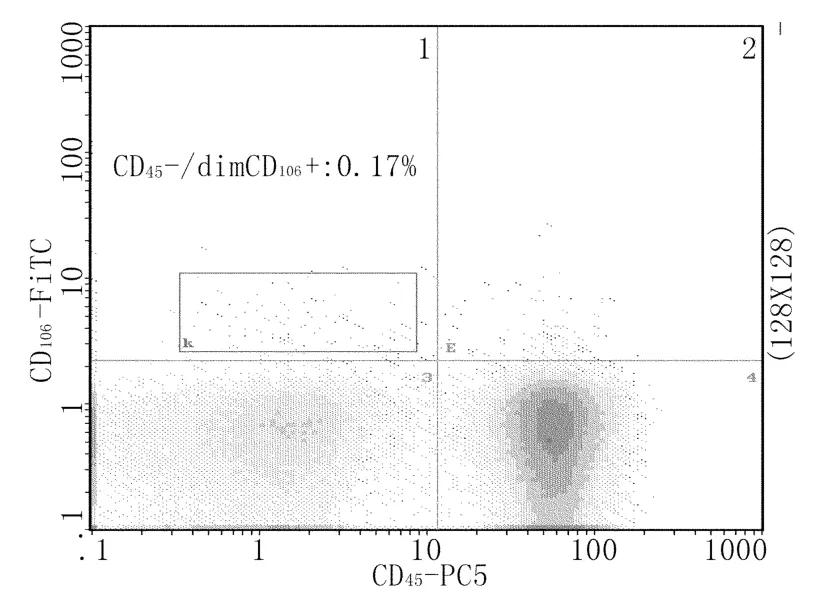
图2 CD45-/dim CD106+细胞流式图
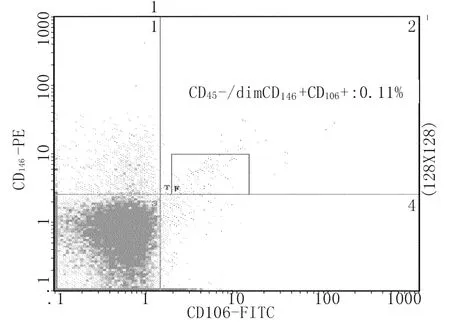
图3 CD45-/dim CD146+CD106+细胞流式图
2 结 果
2.1 肺癌患者及健康对照组CECs、aCECs的数量
肺癌患者及健康对照组CECs、aCECs的检测结果显示。NSCLC与健康对照组比较,NSCLC患者CECs、aCECs的数量明显高于健康人群,由于两组样本的CECs、aCECs总体方差不等(方差齐性检验 F=35.374、19.427,P<0.05),行校正 t检验,t′=8.437、6.113,差异有统计学意义(P<0.01)。
NSCLC与小细胞肺癌CECs、aCECs的数量比较 ,t=-0.347、0.617,P=0.73 、0.54,NSCLC与小细胞肺癌CECs、aCECs的数量差异无统计学意义(P>0.05)。
在NSCLC中鳞癌与腺癌比较,t=-0.214、-0.282,P=0.831、0.779,鳞癌与腺癌患者CECs、aCECs的数量无统计学差异(P>0.05)。
NSCLC中 CECs、aCECs的数量Ⅰ、Ⅱ期,Ⅲ期,Ⅳ期比较,方差分析 F=2.626、2.211,P=0.082、0.12,总体上 3组不同分期 NSCLC患者CECs、aCECs的数量无统计学差异(P>0.05)。两两比较Ⅰ、Ⅱ期与Ⅲ期,P=0.152、0.084,Ⅰ、Ⅱ期与Ⅳ期 P=0.782、0.388,Ⅲ期与Ⅳ期P=0.033、0.087。Ⅲ期CECs的数量明显高于Ⅳ期(P<0.05),余各组之间 CECs、aCECs的数量均无统计学差异(P>0.05)。见表1。
表1 不同病理类型肺癌、不同临床分期及健康对照组CECs/aCECs的比较(±s)
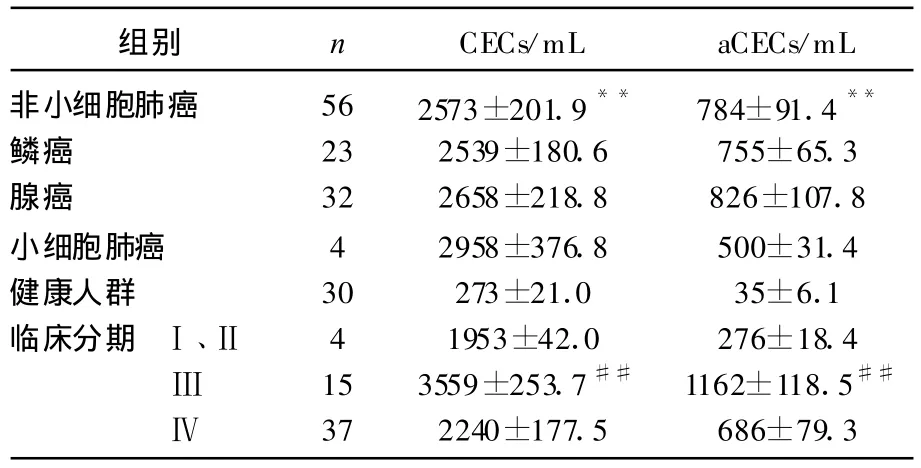
表1 不同病理类型肺癌、不同临床分期及健康对照组CECs/aCECs的比较(±s)
与健康人群比较,**P<0.01;与Ⅳ期比较,##P<0.01。
组别 n CECs/mL aCECs/mL非小细胞肺癌 56 2573±201.9** 784±91.4**鳞癌 23 2539±180.6 755±65.3腺癌 32 2658±218.8 826±107.8小细胞肺癌 4 2958±376.8 500±31.4健康人群 30 273±21.0 35±6.1临床分期 Ⅰ、Ⅱ 4 1953±42.0 276±18.4Ⅲ 15 3559±253.7## 1162±118.5##Ⅳ 37 2240±177.5 686±79.3
2.2 aCECs占CECs的比例
aCECs仅占CECs的一小部分。在NSCLC患者中aCECs占CECs的比例为29.9±17.3%,在健康对照组中占CECs的比例为8.4±13.6%。NSCLC患者aCECs的比例明显高于健康人群,t=5.914,P<0.001,差异有统计学意义。见图4。
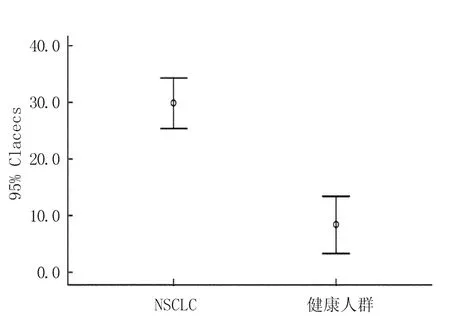
图4 NSCLC与健康人群aCECs占CECs的百分比
2.3 CECs、aCECs的数量与NSCLC肿瘤大小之间的关系
CECs、aCECs的数量与NSCLC肿瘤大小之间的关联性分析 r=0.086、0.03,t=0.637、0.217,P=0.527、0.829。相关性无统计学意义(P>0.05)。
2.4 CECs、aCECs的数量与NSCLC血CEA之间的关系
CECs、aCECs的数量与NSCLC血CEA之间的关联性分析 r=0.205、0.251。行 t检验,t=1.321、1.639,P=0.194、0.109。相关性无统计学意义(P>0.05)。
3 讨 论
CECs在促进肿瘤血管生成过程中发挥重要作用,其数量可以反映肿瘤血管生成的的程度。在肿瘤患者中外周血CECs可以作为评估肿瘤的血管生成及抗血管生成治疗疗效的标志物[2-4]。近期研究进一步将CECs细化为休眠CECs(resting CECs)、活性 CECs(aCECs)及凋亡 CECs(apoptotic CECs),在CECs中大部分是rCECs、apoptotic CECs;仅少部分为aCECs,它可以反映肿瘤的新生血管生成的活力[5-7]。Wang等[8]认为aCECs可以作为NSCLC患者预测抗血管生成疗效、反应预后的理想标志物。
尽管CECs的表型特征及检测技术的标准化仍缺乏一致性,但普遍认为[9]CECs表达内皮细胞标志物如CD31、CD146等,而不表达造血细胞(CD45)及内皮祖细胞(CD133)标志物,aCECs还表达CD106。不同研究分别以多种CD分子标记物检测出 CECs及 aCECs[5-6,9]。由于 CECs、aCECs在外周血中的数量较少,前期实验采用全血三标的流式细胞仪检测方法检测了CECs的存在及其百分比结果,并试验性的检测了aCECs的结果,仅极少数肺癌血标本检测出了aCECs的存在[10]。本实验以Duda等[11]用淋巴细胞分离液对标本进行富集处理(提取单个核细胞)流式细胞仪检测CECs的方法为基础,以目前被广泛认可的 CD45、CD146、CD106抗体为标记,通过 CD45-来排除造血细胞及活化的 T淋巴细胞。测得CD45-/dim CD146+为成熟的 CECs,CD45-/dim CD146+CD106+为 aCECs。Strijbos等[12]认为CECs与血小板之间存在抗原交叉现象,一些较大的血小板团块也表现为CD45-CD31++CD146+。因此本实验上机检测在单个核细胞群设门,每份标本获取设门内细胞要在100 000个以上,以避免红细胞、血小板、细胞碎片、中性粒细胞及其他非特异反应等多种因素影响检测结果,便于CECs及aCECs的计数。在样本处理过程中需注意样本室温长时间存储会影响CECs活性及表型,故在不能立即检测样本时应将样本处于4℃冰箱保存备用;在加入溶血剂完全溶血后应在15 min内上流式细胞仪检测,溶血时间过长会产生过多的细胞碎片,干扰检测结果。
在肺癌患者外周血中存在大量的活化T淋巴细胞(CD45+CD146+),前期实验也发现了上述现象[10]。因此单凭CD146+来测定CECs的方法存在很大的局限性和误差,多种抗体标记联合应用可以明显提高CECs检测的准确性和特异性。
NSCLC患者 CECs、aCECs的数量及 aCECs占CECs百分比都明显高于健康人群(P<0.001),与文献报道一致[5-6]。在CECs中aCECs仅占CECs的一小部分,其余大部分是 rCECs、apoptotic CECs;NSCLC患者CECs比健康人群高10倍左右,aCECs则高于健康人群近20倍,CECs可以作为很好的标记物来NSCLC血管生成状况,而aCECs则更能反映NSCLC新生血管生成的活力。CECs、aCECs的数量在肺癌的病理分型上无统计学差异(P>0.05),其与NSCLC肿瘤大小及血CEA的水平无明显相关性(P>0.05),与相关报道[10,13]结果一致。在NSCLC的临床分期上,Ⅰ、Ⅱ期的CECs、aCECs数量均低于Ⅲ期、Ⅳ期,并以Ⅲ期为最高,但总体上3组间的差异无统计学意义(P>0.05),与文献报道一致[10,13]。由于本实验样本量相对较少,类似相关研究不多,CECs、aCECs的数量在 NSCLC、小细胞肺癌乃至NSCLC不同病理类型、不同临床分期上的差别还有待于进一步检测,以便进一步评估肺癌的血管生成情况,为抗血管生成治疗病人的合理选择及疗效评估提供依据。
采用富集处理(提取单个核细胞)的方法进行流式细胞仪分析能够成功地检测出CECs、aCECs,其在aCECs检测上明显优于前期全血试验性的检测结果。由于CECs在外周血中的数量较少,更多地收集流式细胞仪设门内的细胞数,能够提高检测结果的准确性及可靠性,其在不同功能状态CECs的检测上将会充分显示出它的优势,这为进一步检测休眠 CECs、活性 CECs、凋亡CECs及循环内皮祖细胞(circulating endothelial progenitors,CEPs)奠定了基础,以明确不同类型CECs及 CEPs的活力、动力学特征及其在NSCLC血管生成中的作用及意义。相信随着CECs检测技术的不断完善,CECs、aCECs以及其他类型CECs和CEPs将会成为很好的标记物去监测NSCLC血管生成状况、抗血管生成药物疗效及预后。
[1] D′Amico T A.Angiogenesis in non-small cell lung cancer[J].Semin Thorac Cardiovasc Surg,2004,16(1):13.
[2] Schneider M,Tjwa M,Carmeliet P.A surrogate marker to monitor angiogenesis at last[J].Cancer Cell,2005,7(1):3.
[3] Beerepoot L V,M ehra N,Vermaat J S,et al.Increased levels of viable circulating endothelial cells are indicator of progressive disease in cancer patients[J].Ann Oncol,2004,15(1):139.
[4] Bertolini F,Shaked Y,Mancuso P,et al.The multifaceted circulating endothelial cell in cancer:towards marker and target identification[J].Nat Rev Cancer,2006,6(11):835.
[5] M ariucci S,Rovati B,Chatzileontiadou S,et al.A six-colour flow cytometric method for simultaneous detection of cell phenotype and apoptosis of circulating endothelial cells[J].Scand J Clin Lab Invest,2009,69(3):433.
[6] Mancuso P,Antoniotti P,Quarna J,et al.Validation of a Standardized Method for Enumerating Circulating Endothelial Cells and Progenitors:Flow Cytometry and Molecular and Ultrastructural Analyses[J].Clin Cancer Res,2009,15(1):267.
[7] Bertolini F,Mancuso P,Braidotti P,et al.The multiple personality disorder phenotype(s)of circulating endothelial cells in cancer[J].Biochim BiophysActa,2009,1796(1):27.
[8] Wang J,Huang C,Wei XY,et al.Changes of activated circulating endothelial cells and survivin in patients with nonsmall cell lung cancerafter antiangiogenesis therapy[J].Chin Med J,2008,121(22):2234.
[9] Jacques N,Vimond N,Conforti R,et al.Quantification of circulating mature endothelial cells using a whole blood fourcolor flow cytometric assay[J].J Immunol Methods,2008,337(2):132.
[10] 马倩,孙洪岩,张爱梅,等.流式细胞术检测非小细胞肺癌外周血循环内皮细胞方法初探[J].临床输血与检验,2010,12(2):100.
[11] Duda D G,Cohen K S,Scadden D T,et al.A protocol for phenotypic detection and enumeration of circulating endothelial cells and circulating progenitor cells in human blood[J].Nat Protoc,2007,2(4):805.
[12] Strijbos M H,Kraan J,den Bakker M A,et al.Cells meeting our immunophenotypic criteria of endothelial cells are large platelets[J].Cytometry B Clin Cytom,2007,72(2):86.
[13] Kawaishi M,Fujiwara Y,Fukui T,et al.Circulating endothelial cells in non-small cell lung cancer patients treated with carboplatin and paclitaxel[J].J Thorac Oncol,2009,4(2):208.
