H5N1禽流感病毒实验室检测方法灵敏性比较
2011-02-03战大伟刘伯华颜克松祝庆余
战大伟,李 靖,刘伯华,颜克松,户 义,姜 涛,祝庆余
(1.解放军总医院第一附属医院,北京 100037;2.军事医学科学院微生物流行病研究所,北京 100071)
禽流感病毒(avian influenza virus,AIV)属正黏病毒科(Orthomyxoviridae)流感病毒属A型流感病毒,是分节段的负链单股RNA病毒。高致病性禽流感(high pathogenic avian influenza virus,HPAIV)是由以H5N1、H7N7为代表的H5和H7两个亚型引发的疾病,对养禽业危害巨大,而且影响禽类产品的安全[1,2]。1997年香港首次发生H5N1禽流感病毒跨越种属屏障感染人类并致死的事件,至今在全球范围内,高致病性H5N1亚型禽流感频繁发生并造成人类感染,具有很高的致死率[3,4],H5N1亚型禽流感作为人畜共患病的公共卫生地位更加突出[5-7]。
H5N1禽流感病原学检测的临床与预防意义是早期诊断、确诊,及时识别传染源,尽早隔离与控制,因此应用灵敏、特异和快速的检测方法就显得尤为重要。对于送检的样本及病料,目前实验室常用检测方法主要有传统的细胞接种观察 CPE法(cytopathic effect)、血凝实验 (hemagglutination,HA)以及分子生物学 RT-PCR、Real-time RT-PCR等[8-12]。本研究应用 A/Beijing/01/03 H5N1病毒,鸡胚扩增,蚀斑(plaque form ing unit,PFU)技术定量病毒滴度,应用以上4种常用方法检测稀释的病毒悬液,比较检测的最低稀释度,比对检测方法的灵敏性等特点。
1 材料和方法
1.1 实验材料
1.1.1 病毒与细胞
A/BeiJing/01/03为实验室分离保存的高致病性H5N1禽流感毒株[13];MDCK细胞株为本所细胞库保存。实验中具有感染性病毒粒子的操作均在在本所BSL-3实验室内进行。
1.1.2 试剂
RNA提取应用 Rneasy Mini Kit,购自 QIAGEN公司;RT-PCR应用 One-Step RT-PCR Kit,购自QIAGEN公司;Real-time RT-PCR应用One-Step RTPCR Master M ix,购自 ABI公司;低溶点琼脂糖,购自Invitrogen公司;鸡血红细胞及9日龄SPF鸡胚,购自维通利华公司。
1.1.3 引物
RT-PCR及Real-time RT-PCR检测H5N1病毒的HA基因保守区域[14]。RT-PCR检测引物:上游引物:5’-CTCCCCTGCTCATTGCTATG-3’,下游引物:5’-GCCATTCCACAACATCCACCC-3’,扩增片断长度为219 bp,引物由北京三博远志生物技术公司合成。Real-time PCR检测引物:上游引物:5’-ACATGCCCAAGACATACTGGAA-3’,下游引物:5’-GAATTCGTCACACATTGGGTTTC-3’,探针:FAMCACACAACGGGAAGCTCTGCGATCT-TAMRA,扩增片段长度为130 bp,探针5’端标记的荧光报告基团是 FAM,3’端标记荧光淬灭基团 Non-fluorescent quencher和minor groove binder(MGB),由Invitrogen公司合成。
1.2 方法
1.2.1 病毒增殖:将 H5N1病毒应用 2%FBS DMEM 1∶100倍稀释,经绒毛尿囊腔接种法感染9日龄SPF鸡胚,200μL/枚,石蜡溶化封口,37℃温箱培养。每日照检鸡胚一次。挑出死亡鸡胚,放置4℃冰箱过夜后收获鸡胚尿囊液,1000 r/min离心5 m in,上清分装在细胞冻存管中,-70℃冻存备用。
1.2.2 病毒 PFU定量:采用双层琼脂糖法:应用2%FBS DMEM维持液将病毒液10倍依次稀释,每梯度吸取0.8 m L病毒液进行病毒蚀斑定量。应用生长良好MDCK细胞(2×106个/mL)铺6孔板,过夜培养。吸弃10%FBS DMEM培养液,换为 earle液,浸泡1 h后吸弃。将病毒稀释液加入6孔板中,吸附1 h,加入第一层0.5%乳白蛋白水解物-犊牛血清营养低溶点琼脂糖,1 m L/孔,待琼脂糖充分凝固后放入37℃、5%CO2培养箱中。48 h后加入含0.1%中性红的第二层琼脂糖染色,1 m L/孔,过夜培养,蚀斑观察计数。
1.2.3 RNA提取:病毒核酸提取应用 QIAGEN公司Rneasy Mini Kit,按试剂盒操作说明书进行。
1.2.4 病毒血凝实验:向96孔血凝板各孔中加生理盐水 0.25 m L,吸取0.25 m L病毒,加入第一孔中,与生理盐水充分稀释后吸0.25 m L加入第二孔中,依次2倍稀释。每孔中加入1%鸡红细胞悬液0.25 m L,将血凝板放入湿盒中,室温放置45 m in,观察记录实验结果。
1.2.5 细胞接种:应用生长良好的 MDCK细胞铺96孔板,过夜培养。吸弃 10%FBS DMEM,根据PFU计数,首先用2%FBS DMEM稀释病毒为10整数倍,然后10倍倍比稀释的病毒液,每个梯度接种4孔,100 m L/孔,37℃、5%CO2培养箱中培养,逐日显微镜下观察记录细胞病变。
1.2.6 RT-PCR:50μL反应体系:10μL 5×RTPCR缓冲液,2μL dNTP m ix,10μL 5×Q溶液,6 μL 5μmol/L上游引物,6μL 5μmol/L下游引物,2 μL酶混合液,0.5μL 20U/μl RNase抑制剂,9μL H2O,5μL模板 RNA。PCR参数:反转录50℃ 30 m in,起始 PCR反应95℃ 15 min,三步循环:变性94℃ 30 s,退火55℃ 30 s,延伸72℃ 30 s,循环数40;延伸72℃2 min。PCR产物经0.8%琼脂糖凝胶电泳,80 V,40 min,凝胶成像。
1.2.7 Real-time RT-PCR:25μL反应体系:5μL RNA,15μL 2×Taqman one-step RT-PCR混合液,0.75μL RNase抑制剂,终浓度为0.25μmol/L的上游引物、下游引物及终浓度为0.125μmol/L探针。反应参数:逆转录48℃ 30 m in,起始反应95℃ 10 m in,预变性,95℃ 15 s,60℃ 1 m in扩增40个循环。在60℃进行单点荧光检测。
2 结果
2.1 待检病毒定量
收获得到含有大量感染性H5N1病毒粒子的鸡胚尿囊液。A/BeiJing/01/03 H5N1病毒稀释液在六孔板形成清晰的白色、大小不均一的混合病毒蚀斑,病毒滴度为2.25×107PFU/m L(彩插2图1)。
2.2 灵敏性实验结果
2.2.1 CPE观察:高浓度病毒接种的MDCK细胞自48 h在显微镜能观察到明显病变,细胞发生融合,后期细胞变圆、崩解。至第5天,10-6病毒稀释液接种的MDCK细胞病毒死亡,107稀释的病毒接种细胞及对照细胞生长良好(彩插2图2)。细胞接种方法检出灵敏度至10 PFU/m L。
2.2.2 血凝实验:2-1~2-6血凝结果为“4+”,2-7血凝结果为“3+”。鸡血红细胞血凝实验能够检出2-7病毒稀释液,检出灵敏度至3.52×105PFU/m L (彩插2图3)。
2.2.3 RT-PCR检测结果:10-1~10-4病毒稀释样本能够清晰检出特异性219 bp条带,检出灵敏度至103PFU/m L(图4)。
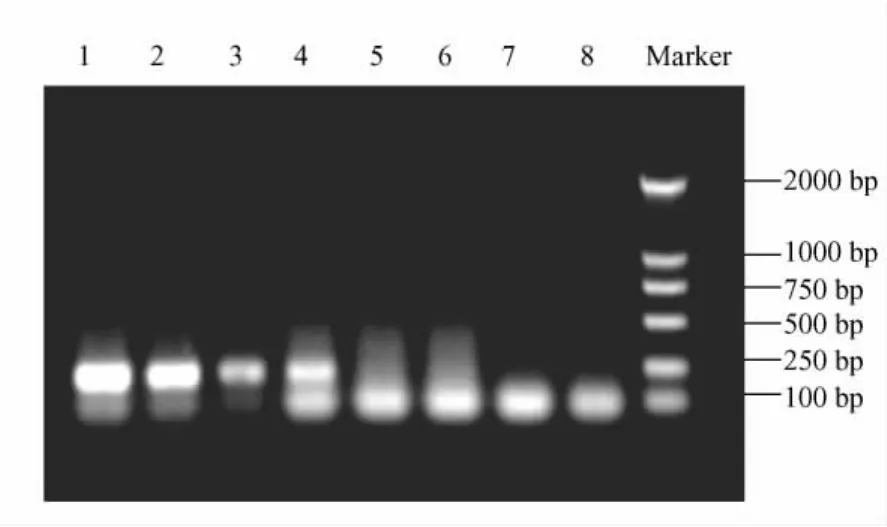
图4 RT-PCR检测结果Fig.4 The Results of detection with one step RT-PCR
2.2.4 Real-time RT-PCR检测结果:根据实验室对荧光定量RT-PCR反应体系与反应条件的标准选择与优化,10-4,10-5为阳性,10-6为弱阳性结果,所以该方法能够检出10-6病毒稀释液,检出灵敏度至10 PFU/m L(图5)。
3 讨论
几种检测方法灵敏度比较:细胞接种与 Realtime RT-PCR病毒检测灵敏度最高,能够检出 10 PFU/m L病毒粒子;RT-PCR能够检出103PFU/m L病毒粒子,检测灵敏度比细胞CPE及Real-time RTPCR低 100倍;血凝实验灵敏度最低,仅能检出3.52×105PFU/m L病毒粒子。对于病毒含量较低的待检样本,细胞接种与Real-time RT-PCR是首选的检测方法。

图5 Real-time RT-PCR检测结果Fig.5 The Results of detection with Real-time RT-PCR
几种检测方法检测用时比较:细胞接种方法用时最长,高浓度病毒接种的敏感MDCK细胞也需要2 d才能够观察到显著病变,低浓度病毒接种的细胞需要5 d出现病变,实验前期细胞培养、材料处理等工作也需要一定时间;血凝实验费时最短,能够在2~3 h完成检测;RT-PCR及 Real-time RT-PCR需要样本处理、RNA提取等前期工作,但能够在6~7 h得到结果。
不同的送检样本、采集方法、送检条件及方式影响感染性H5N1病毒的存活,从而会直接细胞接种方法的检出灵敏度。此外,传统的细胞接种实验及血凝实验条件要求高,只能在BSL-3实验室内进行,实验结果也需要尚需要如电镜观察或分子生物学方法进一步验证。但是细胞接种检测方法能够同时分离获得病原体,有利于病原学的进一步研究。
RT-PCR及Real-time RT-PCR等分子生物学方法应用世界卫生组织推荐的针对H5亚型HA基因保守序列检测引物,实验证明均具有高保真性[14],用于检测病毒核酸,对病原体要求低,只要有达到检测下限的未降解AIV核酸即可,具有特异性,高度灵敏性,又检测快速,而且简便易操作,不需要高级别生物安全实验室条件等保障条件,所以更适合于H5亚型禽流感病毒的快速诊断,因而分子生物学方法在H5N1禽流感的检测中得以广泛的应用。RT-PCR产物能够进行扩增片段的序列测定及序列比对分析,为流行病学调查研究提供重要数据。Real-time RT-PCR检测技术,闭管式操作能够最大程度避免污染与假阳性结果的出现,还可以实现实时定量,适合用于病原体的早期快速诊断[15-17]。
综上所述,将传统的检测手段与分子生物学方法结合,检测中相互印证,能够准确、快速完成H5N1禽流感病原学检测工作,为禽流感的快速诊断和分子流行病学调查提供技术支持。
[1]Kilbourne ED.Influenza pandemics of the 20th century[J].Emerg Infect Dis,2006,12(1):9-14.
[2]Ligon BL.Avian influenza virus H5N1:A review of its history and information regarding its potential to cause the next pandemic[J].Semin Pediatr Infect Dis,2005,16(4):326-335.
[3]Kuiken T,Holmes EC,McCauley J,et al.Host species barriers to influenza virus infections[J].Science,2006,312(3):94 -97.
[4]Dybing JK,Shultz-Cherry S,etal.Distinct pathogenesis of Hong Kong-origin H5N1 viruses in mice compared to that of other highly pathogenic H5 avian influenza viruses[J].JVirol,2000,74:1443-1450.
[5]Maines TR,Lu XH,Erb SM,et al.Avian influenza(H5N1) viruses isolated from humans in asia in 2004 exhibit increased Virulence in mammals[J].J Virol,2005,79(18):11788 -11800.
[6]Liu J,Xiao H,Lei F,et al.Highly pathogenic H5N1 influenza virus infection in migratory birds[J]. Science,2005,309:1206.
[7]Wang GH,Zhan DW,Li LX,et al.Reemergence of H5N1 Avian Influenza in Qinghai in 2006:Implications for the Potential Role of Migratory Birds in Its Global Circulation.J Gen Virol,2008,89:697-702.
[8]黄祯祥,洪涛,刘崇柏,等.医学病毒学基础及实验技术[M].北京:科学技术出版社,1990:149-156.
[9]殷震,刘景华.动物病毒学(第2版)[M].北京:科学出版社,1997:84-86,93-98.
[10]Lee MS,Chang PC,Shien JH,et al.Identification and subtyping of avian influenza viruses by reverse transcription-PCR[J].JVirol Methods,2001,97(1-2):13-22.
[11]Starick E,Romer-Oberdorfer A,Werner O.Type-and sutypespecific RT-PCR assays for avian influenza A viruses(AIV)[J].JVet Med B Infect Dis Vet Public Health,2000,47(4):295-301.
[12]Chen WJ,He B,Li CG.Real-time RT-PCR for H5N1 avian influenza A virus detection[J].J Med Microbiol,2007,56:603-607.
[13]Zhu QY,Qin ED,Wang W,et al.Fatal infection with influenza A(H5N1)virus in China[J].N Engl J Med,2006,354 (25):2731-2.
[14]Wang W,Ren PJ,Sek Mardi,et al.Design of multiplexed detection assays for identification of avian influenza Avirus subtypes pathogenic to humans by smartcycler Real-time reverse transcription-PCR[J].J Clin Microbiol,2009,47(1):86 -92.
[15]包红梅,王秀荣,刘丽玲,等.H5亚型禽流感病毒一步法RT-PCR检测方法的建立[J].中国生物工程杂志,2007,27 (5):65-69.
[16]曾显营,耿士忠,潘志明,等.红细胞富集与多重RT-PCR联合检测禽流感病毒[J].中国人兽共患病学报,2007,23 (2):153-155.
[17]卢亦愚,严菊英,冯 燕,等.TaqMan-MGB荧光定量RT-PCR技术快速检测H5亚型禽流感病毒[J].中国病毒学,2006,472-476.
