黄芪对肺腺癌细胞生长抑制的实验研究*
2011-02-02耿国军姜杰杜好信钱文轩张义杨丽华陈端扬陈隽鹏
耿国军 姜杰 杜好信 钱文轩 张义 杨丽华 陈端扬 陈隽鹏
(1福建省厦门市中医院 厦门 361000;2厦门大学医学院 福建厦门 361009)
黄芪对肺腺癌细胞生长抑制的实验研究*
耿国军1姜杰1杜好信1钱文轩1张义1杨丽华2陈端扬1陈隽鹏1
(1福建省厦门市中医院 厦门 361000;2厦门大学医学院 福建厦门 361009)
目的:研究分化诱导剂黄芪(Astragalus)在体外对人肺腺癌SPC-A-1细胞生长抑制的影响。方法:用不同浓度的黄芪分别处理肺腺癌SPC-A-1细胞后,镜下观察癌细胞的生长情况;测定软琼脂克隆形成率;MTT(噻唑蓝)法测定生长抑制率。结果:不同浓度黄芪处理后细胞的生长明显受到抑制,细胞生长抑制率随黄芪的浓度增加而增加。结论:黄芪对肺腺癌SPC-A-1细胞的生长有明显的抑制作用。
黄芪;肺腺癌;SPC-A-1;MTT法;生长抑制
近年研究表明,黄芪具有提高免疫、增强造血、增强细胞代谢、清除自由基、抗肿瘤免疫应答等作用[1]。为探讨黄芪对肺腺癌细胞的生长抑制作用,本研究选择肺腺癌细胞进行体外实验,通过一定浓度的黄芪处理肺腺癌细胞一定时间后,观察其对肺腺癌细胞的生长抑制效果,为临床治疗肺癌提供一定的理论依据。
1 材料与方法
1.1 材料 黄芪购自浙江杭州,配制为20 g/L的无菌溶液备用。流式细胞仪,为美国产品。SPC-A-1细胞株为厦门大学生命科学学院提供。小牛血清购自上海江莱生物科技有限公司,实验时选用对数生长期细胞。
1.2 细胞培养观察增殖力 随机取5瓶处于对数生长期的SPC-A-1细胞,在其中的4瓶内加入不同浓度的黄芪(0.25、0.50、0.75、1.00 mg/mL)。及时更换新鲜培养基,同时保持药物浓度不变,连续培养,观察细胞增殖情况。剩余的1瓶正常培养做对照。
1.3 软琼脂克隆形成测定 参照鄂征[2]报道的方法,黄芪的浓度分别为 0、0.25、0.50、0.75、1.00 mg/mL,连续培养2周,计算克隆形成率与克隆抑制率。克隆形成率=克隆数/接种细胞数×100%;克隆抑制率=(1-实验组克隆数/对照组克隆数)× 100%。
1.4 MTT法 检测细胞生长抑制率。参照司徒镇强[3]方法,调整细胞浓度至103~104/mL,并使细胞分散良好;将稀释的细胞悬液加到96孔培养板内,每孔200 μL。4~5 h细胞贴壁后,加入不同浓度的黄芪,使不同组的终浓度分别为 0.25、0.50、0.75、1.00 mg/mL,对照组加等量的培养基,微型震荡器震荡后,用酶标仪于波长492 nm处测吸光度值(OD),计算抑制率。
1.5 统计学分析 全部数据以(±S)表示,显著性比较用t检验。
2 结果
2.1 不同浓度的黄芪对SPC-A-1细胞生长的影响黄芪对SPC-A-1细胞24 h显示出生长抑制作用,48 h和72 h抑制作用较明显。0.25、0.50、0.75、1.00 mg/mL黄芪对SPC-A-1均可抑制细胞增殖,且随浓度增加对SPC-A-1的抑制率也增加,不同浓度组间有统计学意义;而且同一浓度黄芪对SPC-A-1的抑制率随时间延长而增加,不同时间组间有统计学意义。结果见表1。
表1 黄芪对SPC-A-1细胞增殖的影响 (±S)%
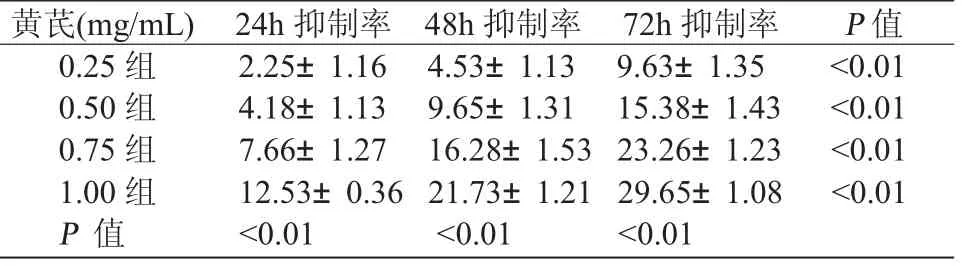
表1 黄芪对SPC-A-1细胞增殖的影响 (±S)%
黄芪(mg/mL) 24h抑制率 48h抑制率 72h抑制率 P值0.25组 2.25±1.16 4.53±1.13 9.63±1.35 <0.01 0.50组 4.18±1.13 9.65±1.31 15.38±1.43 <0.01 0.75组 7.66±1.27 16.28±1.53 23.26±1.23 <0.01 1.00组 12.53±0.36 21.73±1.21 29.65±1.08 <0.01 P值 <0.01 <0.01 <0.01
2.2 不同浓度的黄芪对SPC-A-1细胞软琼脂克隆形成能力的影响 随黄芪浓度增加,其克隆形成率逐渐下降,克隆抑制率逐渐上升,增殖抑制更加明显。结果见表2。
表2 SPC-A-1细胞克隆形成率及抑制率 (±S)%
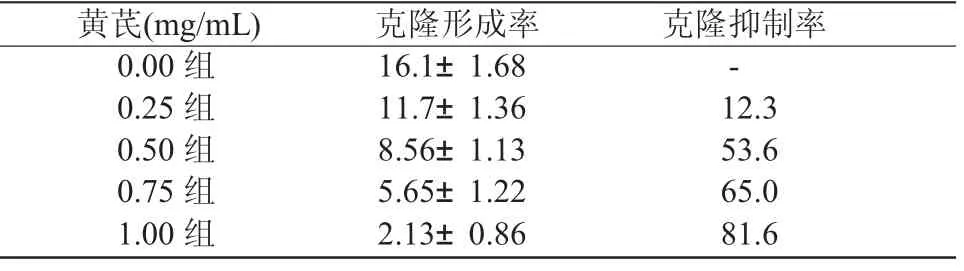
表2 SPC-A-1细胞克隆形成率及抑制率 (±S)%
黄芪(mg/mL) 克隆形成率 克隆抑制率0.00组 16.1±1.68 -0.25组 11.7±1.36 12.3 0.50组 8.56±1.13 53.6 0.75组 5.65±1.22 65.0 1.00组 2.13±0.86 81.6
2.3 不同浓度的黄芪对SPC-A-1细胞作用24 h后吸光度值 吸光度值逐渐下降,其生长抑制率逐渐增加。结果见表3。
表3 SPC-A-1细胞的生长抑制率 (±S) %
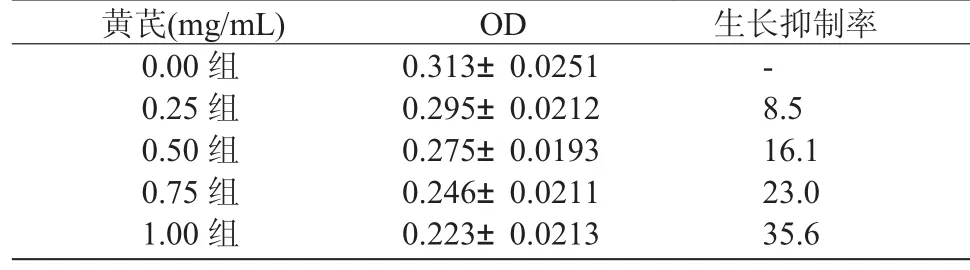
表3 SPC-A-1细胞的生长抑制率 (±S) %
黄芪(mg/mL) OD 生长抑制率0.00组 0.313±0.0251 -0.25组 0.295±0.0212 8.5 0.50组 0.275±0.0193 16.1 0.75组 0.246±0.0211 23.0 1.00组 0.223±0.0213 35.6
3 讨论
肺癌是目前发病率和死亡率增长最快、对人类健康和生命威胁最大的恶性肿瘤。由于其具体发病机制仍然不十分清楚,以手术、化疗、放疗为主的综合治疗手段仍不尽人意,肺癌的预后仍较差[4]。中药作为生物调节剂,具有长效、持久、副作用少的特点,容易为广大患者所接受,可能会成为肿瘤治疗的一条新途径。现代药理学研究证实,黄芪、氧化黄芪等生物碱成分具有提高免疫、增强造血、增强细胞代谢、清除自由基、抗肿瘤免疫应答等多方面生物活性而备受关注[5~6]。肺癌的高侵袭及转移的生物学特性多年来一直困扰着临床治疗工作,寻找新的治疗方法和有效抗癌药物具有相当重要的意义。
近年来,随着恶性肿瘤的诱导分化疗法的日益兴起,黄芪作为一种具有临床应用价值的诱导分化剂引起研究者越来越多的关注和兴趣。细胞持续分裂和不断增殖是肿瘤区别于正常细胞的一个重要特征,因此,观察对肿瘤细胞的增殖活性的抑制作用是筛选诱导分化剂的基本指标。在本研究中,我们通过较长时间的观察SPC-A-1细胞的扩增传代发现:在黄芪的作用下,SPC-A-1细胞增殖减慢,随黄芪浓度增加,其增殖抑制更加明显,最后停止生长。虽然其中可能发生细胞的凋亡或死亡,但细胞增殖抑制是肯定的。软琼脂克隆形成实验及MTT法是测定单个细胞增殖能力及检测细胞存活和生长的有效方法[6],为进一步证实黄芪对SPC-A-1细胞的抑制作用,我们应用软琼脂克隆形成实验及MTT法。结果表明,除0.25 mg/mL组外,其余各组与对照组相比,均有显著性差异(P<0.01),且随着药物浓度的增加,其生长抑制率及克隆抑制率明显增高。这与其他的研究报道[7~9]一致。
综上结果分析,一定浓度的黄芪能有效地抑制SPC-A-1细胞的生长增殖,并且随浓度的增加其抑制作用明显增加。其作用机制可能与黄芪调控SPC-A-1细胞的凋亡有关,不是单纯的细胞毒性坏死[10]。随着分子生物学技术的不断发展,特别是基因芯片和蛋白芯片技术的发展,必将对黄芪类抗肿瘤机制[12]的研究起到很大的推动作用,而针对这些机制的研究定会开发出新型的与黄芪类抗肿瘤作用同一分子靶点的药物,这将为肿瘤的治疗开辟一条新途径。
[1]许杜娟,吴强,杨雁,等.黄芪总苷的抑瘤作用及其作用机制[J].中国药理学通报,2003,19(7):823-826
[2]鄂征.组织培养与分子细胞学技术[M].北京:北京出版社,1996.312
[3]司徒镇强.细胞培养[M].西安:兴国图书出版公司,2001.186
[4]张毅,支修益.非小细胞肺癌术后辅助治疗现状及进展[J].中华临床医师杂志,2009,3(11):12-14
[5]杨雁,陈敏珠.黄芪总苷对肝癌细胞凋亡及wtp53基因表达的影响[J].中国药理学通报,2001,17(4):447-451
[6]刘成军,韦世秀,李牡艳,等.黄芪注射液对人类小涎腺腺样囊性癌细胞株的抑制作用[J].中国医院药学杂志,2005,25(5):406-408
[7]李琼,刘胜.黄芪注射液对人类乳腺癌细胞株生长的抑制作用[J].中国中医药科技,2007,14(2):100-102
[8]Trody I,Maura Whitenmi1,Jodi A.Hormone replacement therapy and breast cancer:a qualitative review [J].Estrogen and breast cancer, 2001,98(3):497-501
[9]沈洪,刘增巍,张坤,等.黄芪对SGC7901胃癌细胞COX-1、COX-2、VEGF和PGE2表达的影响[J].肿瘤,2007,27(3):194-198
[10]杨海贤,赵钢.免疫杀伤中LAK细胞的坏死和凋亡及黄芪多糖的影响[J].中国肿瘤临床,1998,25(9):669-670
[11]谷俊朝,余微波,王宇,等.黄芪多糖对TA2小鼠乳腺癌MA-891移植瘤生长及HSP70表达的影响 [J].中华肿瘤防治杂志,2006,13 (20):1 534-1 537
Objective:To study the activity of the growth suppression effects with Astragalus on SPC-A-1 human lung adenocarcinoma cel1.Methods:Different concentrations of Astragalus were used in the culture of SPC-A-1 cells.Determination of clone forming ability on soft agar and growth suppression effects with Astragalus were measured by a tetrazolium-based volorimetric assay (MTT assay).Results:Proliferation of SPC-A-1 cells was inhibited effectively after being treated by different concentrations of Astragalus, the rate of growth suppression was increasing with increased concentration of Astragalus.Conclusion:Astragalus have the significant effect on inhibiting on SPC-A-1 human lung adenocarcinoma cel1.
Astragalus;Lung adenocarcinoma cel1;SPC-A-1;Thiazolyl blue;Growth suppression
R 285.5
B
10.3969/j.issn.1671-4040.2011.01.002
*福建省自然科学基金项目:闽科计[2008]59号文
2010-09-06)
