用于治疗多发性硬化症的药物特立氟胺
2011-02-02杨臻峥
用于治疗多发性硬化症的药物特立氟胺
特立氟胺;多发性硬化症;二氢乳清酸脱氢酶
赛诺菲-安万特公司(Sanofi-Aventis)开发的二氢乳清酸脱氢酶(DHODH)抑制剂特立氟胺(teriflunomide)其实是类风湿性关节炎治疗药来氟米特(leflunomide)的一种活性代谢产物,可用于治疗多发性硬化症(MS)。目前,本品已知的作用机制包括通过抑制DHODH来阻止淋巴细胞中嘧啶的从头合成,以及对酪氨酸激酶活性的干扰。
本品化学结构式:
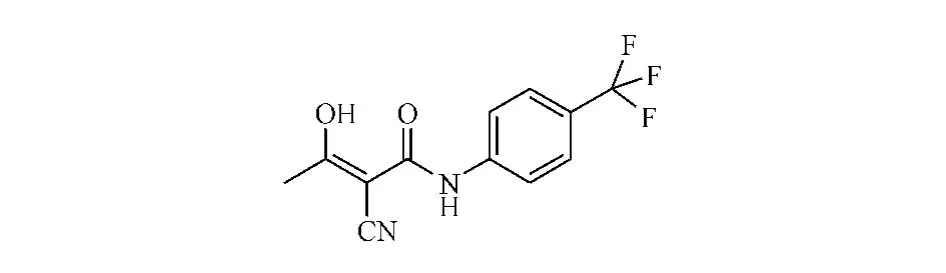
CAS:108605-62-5
药理学研究研究显示,特立氟胺抑制淋巴细胞增殖的作用可被尿苷拮抗,基于该结果,研究人员推测该化合物可能对嘧啶从头合成级联反应中的一种酶有抑制作用。进一步试验发现,该酶即催化嘧啶从头合成过程中第四步反应的关键酶DHODH,特立氟胺可竞争性结合DHODH的辅酶Q10结合位点。特立氟胺对人体细胞中DHODH及纯化的重组人源DHODH抑制常数(Ki)分别为(2.7±0.7)和(179 ±19)μmol·L-1。
研究人员考察了特立氟胺对鼠源白血病LSTRA细胞株中嘧啶生物合成、蛋白酪氨酸磷酸化以及细胞增殖的抑制作用。结果显示,本品对LSTRA细胞中DHODH 的 IC50为 220 μmol·L-1;对胞内蛋白酪氨酸磷酸化的 IC50为 50 ~100 μmol·L-1,且对细胞膜中的酪氨酸蛋白激酶p56lck的活性亦有抑制作用,在用p56lck的免疫沉淀物进行的试验显示,本品对p56lck自磷酸化作用的 IC50为 80 μmol·L-1。尿苷不影响本品对酪氨酸磷酸化的抑制作用。本品对LSTRA 细胞株增殖的IC50为10 ~30 μmol·L-1,与曾经的研究结果相同,外源性尿苷可逆转该抑制作用。
特立氟胺可浓度依赖性地抑制人外周血白血病 T 细胞的增殖,IC50为20 ~25 μmol·L-1,且该作用可被外源性尿苷逆转。此外,将特立氟胺与上述细胞共孵育,可检测到胞内二氢乳清酸水平随药物浓度的增加及作用时间的延长而升高。细胞周期分析结果显示,特立氟胺可导致人外周血白血病T细胞周期受到阻滞。将上述细胞与具有嘧啶从头合成抑制作用的抗肿瘤药布喹那共孵育,也得到了相似结果。
特立氟胺可浓度依赖性地抑制由血小板源性生长因子(PDGF)激活的大鼠平滑肌细胞的增殖,IC50为3μmol·L-1,且这种对增殖的抑制作用可被尿苷(1 mmol·L-1)逆转。同时,本品还可浓度依赖性抑制人和小鼠的巨噬细胞及大鼠外周血单核细胞中的氧自由基生成。此外,本品亦可延缓非肥胖糖尿病(NOD)模型小鼠病情的发展,并抑制巨噬细胞介导的氧自由基生成。基于上述结果,研究人员认为特立氟胺对巨噬细胞功能的抑制也是其免疫抑制作用的重要原因之一。
研究人员还考察了特立氟胺对T细胞整合素的激活、免疫突触的形成以及T细胞-抗原递呈细胞(APC)稳定复合物形成的作用。结果显示,本品对大多数关键的T细胞信号通路,包括丝裂原活化蛋白激酶(MAPK)和核因子κB(NF-κB)的激活没有影响。然而,本品可抑制T细胞受体(TCR)/CD3介导的钙的移动和转运,从而导致β1和β2整合素亲和力以及整合素介导的信号途径受到损害。值得一提的是,整合素激活途径受损并不依赖于嘧啶合成过程的改变。此外,特立氟胺可干扰免疫突触的成熟,从而导致APC与T细胞无法特异性结合。上述研究结果提示特立氟胺的免疫抑制作用可能还包括除DHODH及酪氨酸激酶抑制作用以外的其他机制。
研究显示,特立氟胺能抑制B6C3F1杂交小鼠的移植物排异反应,且该作用可被外源性尿苷拮抗。
研究人员采用雌性Lewis大鼠考察了特立氟胺对实验性变态反应性脑脊髓炎(EAE)模型动物行为的影响,以评价特立氟胺治疗多发性硬化症的潜在价值。将豚鼠新鲜脊髓加完全弗氏佐剂充分乳化后注射到大鼠体内,注射后10天(此时大鼠体内炎症细胞和免疫细胞数量已明显升高),经口给予本品(3 和10mg·kg-1)或地塞米松(1mg·kg-1),结果显示,上述2种化合物均可显著延迟疾病发生,并改善症状。
临床研究基于特立氟胺临床前研究结果,研究人员开展了一项有179名复发型多发性硬化症(RMS)患者(包括157名复发-缓解型MS患者和22名复发性继发进展型MS患者)参加的随机、双盲、安慰剂对照的Ⅱ期临床研究,对口服特立氟胺治疗的安全性和有效性进行了评价。研究中,受试者随机接受安慰剂、特立氟胺(7或14 mg·d-1),连续36周,每6周对患者进行1次核磁共振(MRI)扫描。主要指标为每次MRI扫描上的孤立活动病灶总数,次要指标包括MRI显示的病灶数、复发率以及残疾加重程度。结果,安慰剂组、特立氟胺低剂量组、特立氟胺高剂量组的孤立活动病灶总数的中位数依次为0.6、0.17和0.33[与安慰剂组比较,低剂量和高剂量用药组的活动病灶数明显减少(P<0.03和P<0.01)];各组的病灶数平均值分别为2.69、1.06和0.98[与安慰剂组比较,低剂量和高剂量用药组的病灶数明显减少(P<0.024和P<0.006)]。相比于安慰剂组,特立氟胺2个剂量组的患者每次扫描发现的新T1、T2病灶均显著减少,特立氟胺高剂量组患者的病灶数也有明显减少(P<0.03)。且特立氟胺组患者的年复发率亦比安慰剂组减少。此外,特立氟胺高剂量组患者的扩展残疾状态量表评分(EDSS)升高的患者数明显少于安慰剂组(P<0.04)。研究证实,特立氟胺高剂量组中残疾程度加重的患者数比安慰剂组少。患者对特立氟胺的耐受性好,各治疗组中不良反应和严重不良反应的发生率相近。最常见不良反应为头痛、鼻咽炎和上呼吸道感染。
此外,一项Ⅱ期研究结果显示,特立氟胺在长达8年的治疗过程中,仍可被较好地耐受,且具有较高的安全性,与赛诺菲-安万特公司公布的首个为期36周的双盲设计的临床研究结果一致。
另外,研究人员采集了9名MS患者的外周血单核细胞进行体外细胞试验。结果显示,受试者接受特立氟胺(7或14 mg)后,细胞DNA和RNA合成量比用药前降低了30%~40%。研究也考察了特立氟胺对外周血单核细胞IgG分泌功能的影响,9名受试者治疗前每106个细胞7天累积分泌量为(1 527±375)ng,接受特立氟胺7或14 mg治疗后则分别下降为(469±97)和(641±148)ng。特立氟胺低剂量组和高剂量组受试者的淋巴细胞黏附活性比给药前分别降低了(26±2.6)%和(39±3)%。
赛诺菲-安万特公司开展了一项名为TEMSO、为期2年、有1 088名RMS患者(来自21个国家,年龄为18~55岁,EDSS≤5.5分,且在入组前1年内出现至少1次复发或入组前2年内出现至少2次复发,平均EDSS为2.5分)参加的Ⅲ期研究,对口服特立氟胺(7或14 mg·d-1)的疗效进行了进一步评价。研究的主要指标为年复发率(ARR,定义为患者每年确诊复发次数),次级指标为EDSS衡量的残疾进展时间。结果,特立氟胺2个剂量组受试者的ARR均为0.37,安慰剂组为0.54,即本品可使RMS患者的ARR降低31%(P≤0.000 5);相比于安慰剂组,特立氟胺高剂量组的残疾进展风险显著降低30%(P=0.02),低剂量组也降低了24%,但与安慰剂组无统计学上的明显差异(P=0.08)。特立氟胺组不良反应如腹泻、恶心、丙氨酸氨基转移酶升高,头发稀疏的发生率高于安慰剂组,但程度均为轻度,极少受试者因此而停止治疗。该研究结果现已在欧洲MS治疗与研究委员会(ECTRIMS)年会上公布。
除TEMSO外,赛诺菲-安万特公司还在进行多项有关特立氟胺的Ⅲ期临床研究,如一项名为TOWER的研究采用安慰剂对照的设计以确认特立氟胺的疗效;另一项名为TENERE的研究则将特立氟胺与Merck KGaA公司的Rebif(注射用干扰素β-1a)进行疗效比较。这两项研究结果有望于2011年年底公布,如获成功,特立氟胺将有望获准用于RMS的治疗;而一项名为TOPIC,在MS患者或临床孤立综合征(CIS)患者中进行的Ⅲ期研究有望于2015年完成。
基于一项Ⅱ期研究结果——特立氟胺与干扰素有协同作用,赛诺菲-安万特公司还计划启动一项比较特立氟胺+干扰素和干扰素+安慰剂的疗效的Ⅲ期研究;公司还在2010年底启动了一项名为TERACLES、由1 455名患者参加的安慰剂对照的Ⅲ期临床研究,考察特立氟胺(7或14 mg)作为干扰素β的辅助用药对RMS患者的疗效和安全性。预计治疗时间为1~3年,平均治疗时间为2年。主要考察指标为ARR,次级指标为每次MRI钆增强扫描发现的T1病灶数目以及残疾进展时间。
研究人员根据两项分别名为FREEDOMS和CLARITY的研究结果,对3种MS治疗药物——特立氟胺、诺华公司的Gilenya(芬戈莫德)及Merck KGaA公司的口服克拉屈滨片的疗效和安全性进行了综合分析。FREEDOMS 研究中,Gilenya(0.5 mg·kg-1)组的ARR比安慰剂组降低了54%,CLARITY研究中,克拉屈滨片低剂量和高剂量组受试者ARR分别比安慰剂组降低了58%和55%。从上述结果来看,特立氟胺疗效仅与目前作为标准疗法的注射用β-干扰素相近,且不及芬戈莫德和克拉屈滨片,但其优势在于安全性好,不会引起感染风险上升或肿瘤发生。而克拉屈滨有潜在的致癌风险,芬戈莫德则会导致心率降低、感染率升高、黄斑水肿、肺功能下降、肝效应和胎儿风险。由此看来,特立氟胺在MS治疗药物中还是颇具竞争力的。
R 744.51
