熊果酸衍生物构效关系研究进展
2011-02-02李彩莲
李彩莲, 冯 锋
(中国药科大学天然药物化学教研室,江苏南京 210009)
熊果酸衍生物构效关系研究进展
李彩莲, 冯 锋*
(中国药科大学天然药物化学教研室,江苏南京 210009)
综述了近年来对熊果酸的结构修饰及其衍生物构效关系的研究进展。熊果酸是一种广泛存在于天然植物中的五环三萜类化合物,具有抗肿瘤、降血糖、抗炎、抗HIV等药理活性,故而受到研究人员的广泛关注。对熊果酸进行结构修饰及构效关系探索,以获得高效低毒的候选化合物,已成为该化合物的研究热点之一。
熊果酸;结构修饰;构效关系
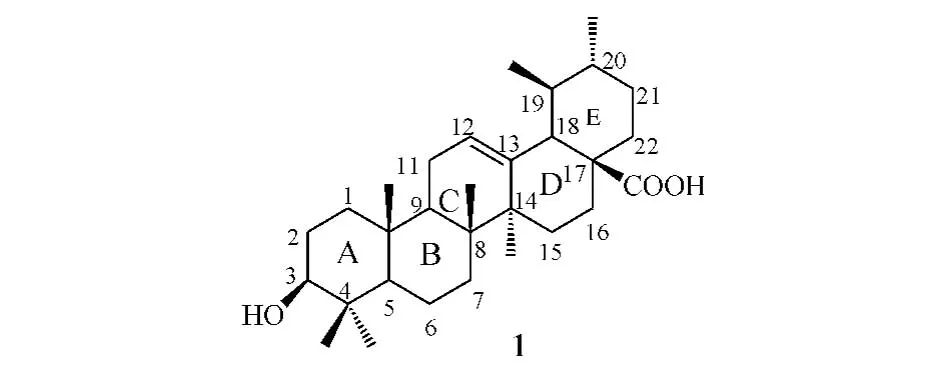
熊果酸(ursolic acid,1)又名乌苏酸、乌索酸,属乌苏烷型三萜类化合物,其广泛分布于植物界,在女贞子、山楂、珍珠菜、夏枯草、车前草、甘草、连翘及苦丁茶等植物中均可分离得到该化合物。熊果酸具有多种生物活性,包括抗肿瘤、抗炎、抗病毒、抗氧化以及对肝损伤的保护等,且其资源较为丰富,价格低廉,故而具有良好的开发前景。为了进一步增强熊果酸的生物活性并改善其理化性质,研究人员对其展开了大量的结构修饰及构效关系研究。
本文综述了近年来对熊果酸进行的结构修饰及其衍生物构效关系的研究成果,旨在为熊果酸的进一步利用和开发提供参考。
1 抗肿瘤作用的构效关系
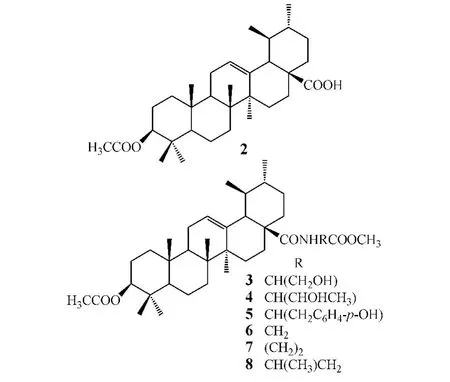
Muto等[1]曾报道,熊果酸对多种肿瘤细胞的生长和扩散具有抑制作用,同时可明显增强机体免疫功能,是一种潜在的较为理想的抗癌药。一般认为,熊果酸C3位羟基和C17位羧基是熊果酸维持抗肿瘤活性的关键基团。Meng等[2]发现,当熊果酸C3位羟基发生乙酰化后,其抗肿瘤活性增加:化合物 2 在 10 μmol·L-1下,对宫颈癌 Hela细胞96 h内的生长抑制率为37.84%,而熊果酸仅为12.36%。该课题组在化合物2的结构基础上,再将带有氨基的侧链连接到C17位羧基上,得到衍生物3~8,其抗肿瘤活性明显高于熊果酸和化合物2,在10 μmol·L-1下对 Hela细胞96 h 内的生长抑制率分别为 59.90%、55.92%、51.53%、61.69%、73.50%和69.34%。
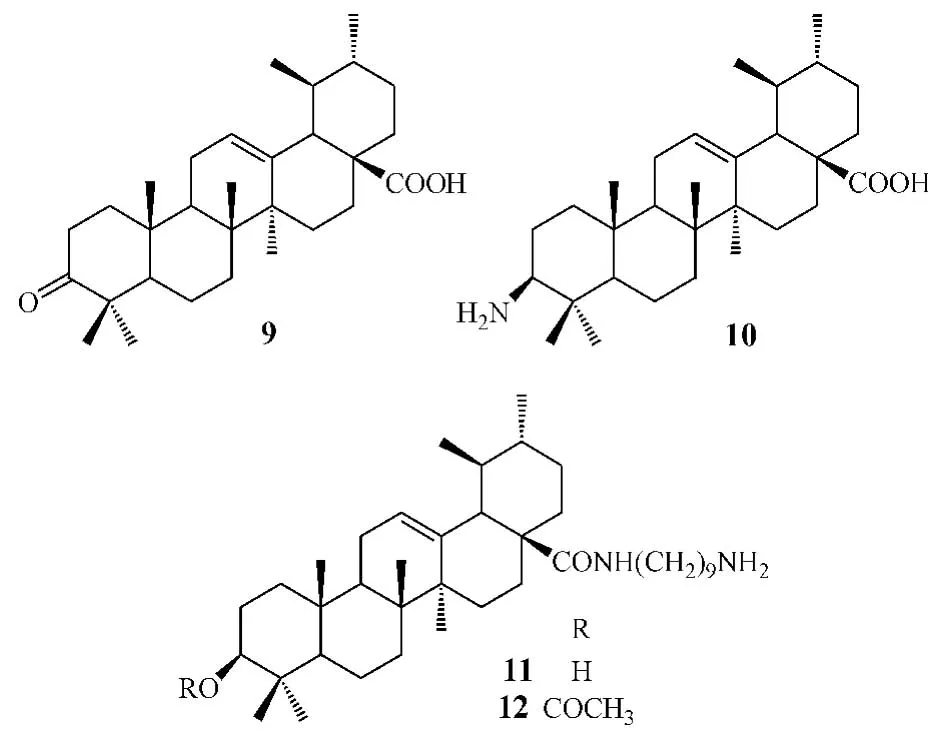
Ma等[3]对熊果酸的C3位羟基和C17位羧基进行结构修饰,得到了化合物9~12,并通过人原髓白血病HL-60细胞、人胃癌BGC细胞、人肝癌Bel-7402细胞及Hela细胞对该类衍生物的细胞毒作用进行了评价。结果显示,化合物9对上述4种肿瘤细胞的ED50分别为 19.5、60.0、58.5 和 76.5 mg·L-1;化合物10 分别为2.0、2.5、1.7 和2.4 mg·L-1;熊果酸则分别为72.0、53.7、45.0 和49.4mg·L-1。分析构效关系可知,熊果酸C3位的羟基替换为酮基后,对HL-60细胞的活性增强,而对另外3种细胞的活性略微下降;替换为β-NH2后对上述4种细胞的抗肿瘤活性均显著增强。化合物11和12对HL-60细胞的 ED50均为 5.0 mg·L-1,对 BGC 细胞分别为 30.0和35.0 mg·L-1,提示当熊果酸C17位羧基上连有带氨基的侧链时,不论C3位羟基游离还是乙酰化,化合物对HL-60及BGC细胞的抑制作用均不受影响;上述2种化合物对Bel-7402细胞的ED50分别为8.0和95.0 mg·L-1,表明 C3位乙酰化可使化合物对Bel-7402细胞的活性明显降低。
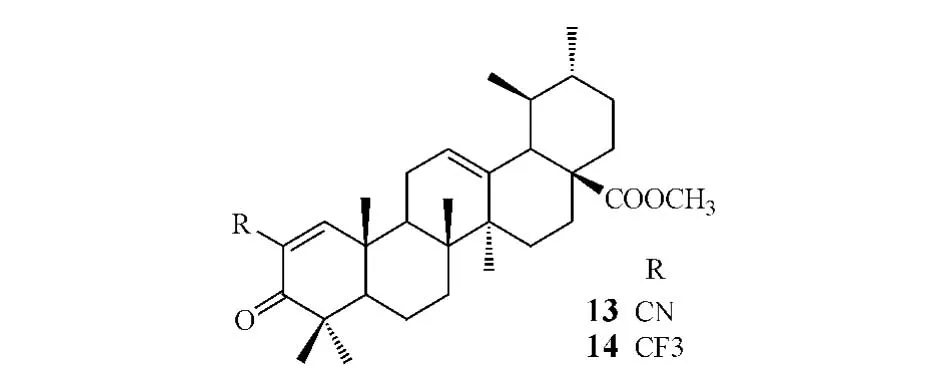
熊果酸A环结构的改变也能影响其抗肿瘤活性。Chadalapaka等[4]对熊果酸A环进行结构修饰,合成了一系列衍生物,并通过膀胱癌KU7和253JB-V 细胞株及胰腺癌 Panc-1 和 Panc-28 细胞株考察其抗肿瘤活性。结果,其中2种化合物显示有活性:化合物13对上述4种细胞的IC50为0.17~0.97 μmol·L-1,化合物 14 则为 0.17 ~1.13μmol·L-1,抗肿瘤活性较熊果酸提高了10~30倍。提示A环的烯酮结构及C2位的氰基和三氟甲基可使化合物抗肿瘤活性增强。
Tu等[5]合成了一系列A环裂环的熊果酸衍生物,发现其对人体膀胱癌NTUB1细胞的生长抑制活性略强于熊果酸,如化合物15和16的 IC50分别为25.49和 15.63 μmol·L-1,而熊果酸为 29.44 μmol·L-1。Finlay等[6]合成了一系列A环裂环的熊果酸衍生物,并用可作为前列腺癌癌前或早期的细胞研究模型、用于对前列腺癌变具有潜在预防作用的化合物筛选的NRP-152细胞株检测衍生物的活性,结果显示,衍生物17和18对NRP-152细胞的IC50分别为2.4 和0.5 μmol·L-1,而熊果酸则在 5 μmol·L-1以上,提示熊果酸A环裂环后,对细胞的增殖抑制作用有所增强,尤其是氨基衍生物活性较为显著。
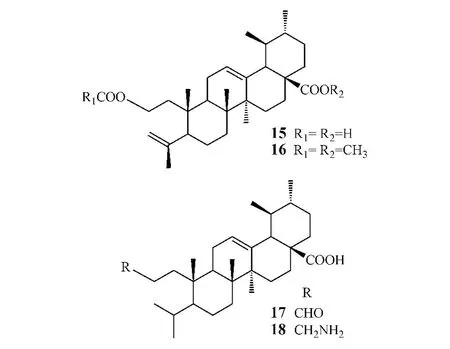
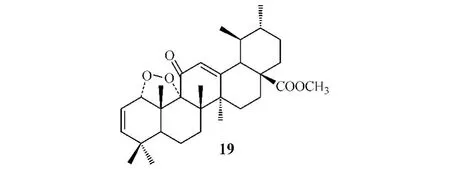
另外,Niesen等[7]合成熊果酸的内生过氧化物,并通过黑素瘤518A2细胞株、人表皮鳞状细胞癌A431细胞、结肠癌SW-480细胞等15种人肿瘤细胞对其进行抗肿瘤活性筛选。将上述内生过氧化物(30 μmol·L-1)或白桦酸(30 μmol·L-1)与受试肿瘤细胞共孵育48小时,然后用流式细胞仪检测48小时后细胞存活率以评价化合物的促细胞凋亡作用。结果显示,化合物19活性最佳,15种细胞的细胞存活率为0.76% ~6.10%,白桦酸为6.41% ~17.82%,表明化合物19促凋亡作用强于白桦酸。
2 降血糖作用的构效关系
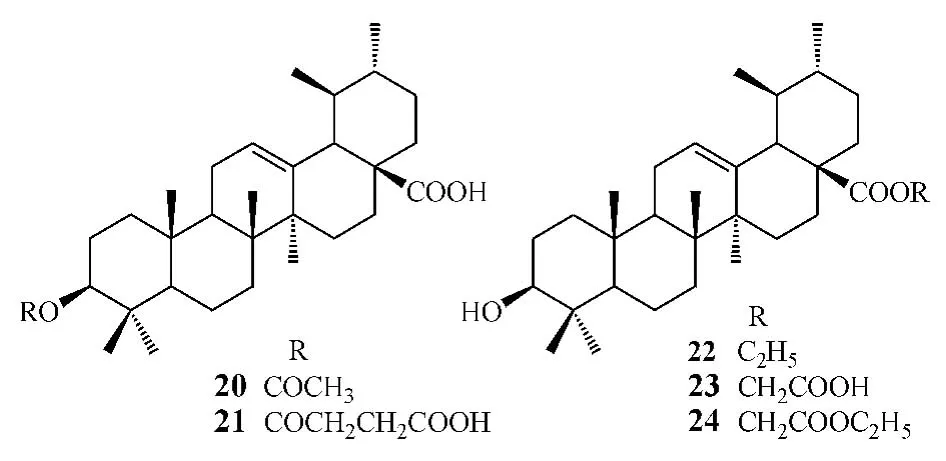
除抗肿瘤活性外,熊果酸还具有一定的降血糖作用。近年来,研究人员对其进行了大量的结构修饰工作,通过糖原磷酸化酶(glycogen phosphorylase,GP)活性抑制试验进行筛选,以期获得有更好降糖作用的化合物。糖原磷酸化酶是糖原分解为葡萄糖过程中的关键酶,在肝糖原代谢中发挥着重要作用,通过抑制糖原磷酸化酶活性减少肝糖原的分解,是抑制血糖升高、治疗2型糖尿病的有效途径之一。陈军等[8]以熊果酸为先导化合物进行结构修饰,并采用兔肌糖原磷酸化酶对所合成的衍生物进行了抑酶活性试验,结果显示,化合物20~24对该酶的IC50分别为 131.0、27.6、911.0、188.0 和 4.1 μmol·L-1,熊果酸为9.0μmol·L-1,提示C3位羟基酰化后化合物活性减弱;C17位羧基与乙醇形成酯键后,化合物活性会下降,但随着酯基的增大,活性又会提高,如化合物24对兔肌糖原磷酸化酶的抑制作用强于熊果酸。由此可见,C17位羧基作为熊果酸的修饰位点之一,对于化合物活性的改善具有十分重要的作用。
熊果酸衍生物中羟基的数量和位置对化合物活性也有一定影响。Wen等[9]合成了一系列羟基数量和位置不同的熊果酸衍生物,亦采用兔糖原磷酸化酶对上述衍生物的降糖活性进行了测试。结果显示,化合物25~30对酶的 IC50分别为19.0、20.0、213.0、216.0、97.0 和 106.0 μmol·L-1,熊果酸为9.0 μmol·L-1。提示:羟基数量并非越多越好,羟基数量增多,化合物降糖活性反而可能下降,上述化合物中仅化合物25和26活性较佳;羟基在母核上的取代位置对化合物活性也有一定影响。另外,在C17位羧基上连接糖环后也会导致熊果酸活性降低。
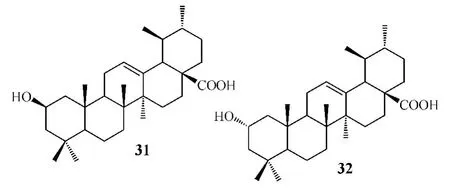
Zhang等[10]以熊果酸为原料合成了3位去氧的五环三萜,并对其进行结构修饰得到一系列衍生物。体外抑酶试验结果显示,化合物31和32对兔肌糖原磷酸化酶的 IC50分别为 5.5 和 1.2 μmol·L-1,而熊果酸为15.3μmol·L-1,提示熊果酸的 C3位羟基转移到C2位后,可显著增强对兔肌糖原磷酸化酶的抑制作用。
科罗索酸(corosolic acid,33)与熊果酸具有相同的母核,亦属于乌苏烷型三萜类化合物,本品能明显降低2型糖尿病的血糖水平,还具有减肥作用,已作为降糖药和减肥药在美国和日本上市[11]。科罗索酸在植物中含量极低,仅靠分离提纯无法满足生产需要,因此研究人员尝试通过相对廉价的原料来合成该化合物。2005年,Wen等[12]以熊果酸为原料,通过5步反应合成了科罗索酸,体外抑酶试验结果显示,其对兔肌糖原磷酸化酶的 IC50为20 μmol·L-1,活性明显强于对照品咖啡因(IC50为114μmol·L-1)。需注意的是,科罗索酸对糖原磷酸化酶的抑制活性不及熊果酸,但后者因细胞毒性大限制了其临床应用,相比而言科罗索酸的安全性更高,故而可直接作为药物上市。此后,Wen等[13]又对科罗索酸进行了结构修饰,所得衍生物对兔肌磷酸化酶的抑制活性显著增强,化合物34~36的IC50分别为7.31、5.1和3.26 μmol·L-1,表明科罗索酸的 C2 位羟基酰化或C1~C3位形成烯酮结构能明显增强化合物对糖原磷酸化酶的抑制活性。
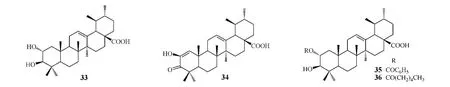
3 抗炎活性的构效关系
现代医学研究发现,机体在急慢性炎症发生时可出现NO过量释放,后者会破坏正常的器官及组织,因此抑制巨噬细胞中NO的过量释放为抗炎药物开发的思路之一。近年来研究人员发现部分熊果酸衍生物具有这种生物活性,由此将其列为抗炎药物的候选化合物并加大了研发力度。
Kwon等[14]分别对熊果酸的C3位羟基和C17位羧基进行烷基化和酰基化修饰,结果发现所得衍生物中有不少均能抑制巨噬细胞系RAW264.7中由脂多糖诱导的NO释放,但同时也存在一定的细胞毒性。所有衍生物中,化合物37对NO释放的抑制作用及安全性较为理想,其在10μmol·L-1浓度下使RAW264.7细胞NO释放量减少了27%,细胞存活率达到70%;熊果酸组巨噬细胞在相同浓度下NO释放量仅减少9.3%,细胞存活率为43.8%,提示在C3位引入甲氧基可增强化合物对NO释放的抑制作用,同时又大大降低了化合物的细胞毒性。
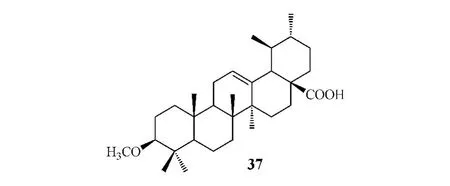
Honda等[15]合成了一系列熊果酸的烯酮衍生物,并考察了上述衍生物对小鼠巨噬细胞中由γ-干扰素(γ-IFN)所诱导的NO释放的抑制活性。结果显示,化合物38~40对NO释放具有显著的抑制作用,其 IC50分别为13、5.1 和6.2 μmol·L-1,对照品熊果酸在浓度低于10μmol·L-1时无抑制活性,在浓度高于10μmol·L-1时反而使NO释放量增加,这可能是因为其在该浓度下对小鼠巨噬细胞毒性较高。分析构效关系可知,C1~C3位的烯酮结构能使化合物抗炎活性增强,在此结构基础上于C2位引入氰基可进一步增强其抗炎活性。此后,Honda等[16]又合成了一些熊果酸的烯酮衍生物,发现其对小鼠巨噬细胞中由γ-干扰素诱导的NO释放也存在一定抑制作用,其中衍生物 41 的 IC50为 5.1 μmol·L-1,活性强于化合物38。从上述结果中不难发现,化合物38仅有 1-烯-3-酮结构,而化合物 41 中有 1-烯 3-酮和11-烯-10-酮,提示烯酮结构为化合物抑制NO释放的重要药效基团,且双烯酮结构的衍生物活性强于单烯酮衍生物,若在熊果酸中同时引入双烯酮结构和C2位氰基,很可能大幅度增强其抗炎作用。
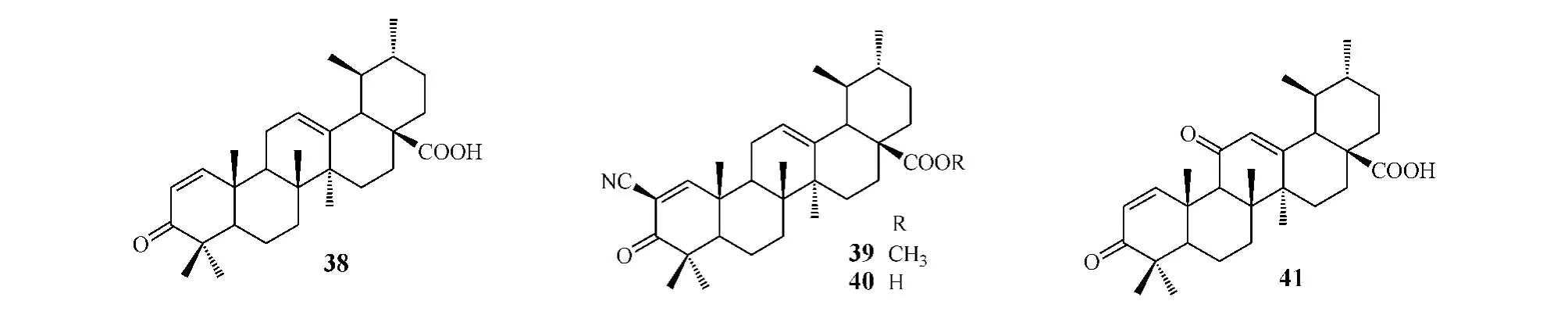
基于上述研究结果,Honda等[17]又合成了一系列既有双烯酮结构,2位又有氰基取代的熊果酸衍生物,其中化合物42和43对NO释放的抑制活性远强于该实验室以往合成的任何一种熊果酸衍生物,IC50分别为 0.2 和 0.1 nmol·L-1,与地塞米松效果相近,有望开发为新型抗炎药应用于临床,同时也为熊果酸的结构修饰提供了新思路。另外,杨定菊等[18]合成了一系列C3位羟基乙酰化,C17位羧基上连接1,3,4-噁二唑啉结构的熊果酸衍生物,并进行了抗炎活性筛选。结果显示,化合物44 ~47(40 mg·kg-1·d-1)能明显减轻二甲苯所致的小鼠耳廓炎症反应,小鼠炎症及正常耳片的质量差(用以表征耳廓肿胀程度)分别为8.78、9.82、10.70和9.94 mg,效果优于熊果酸(两耳片质量差为22.90 mg)。
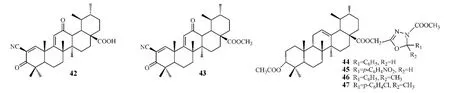
4 抗HIV活性的构效关系
田瑛等[19]对天然产物中抗HIV活性成分进行了总结,指出熊果酸和熊果酸丙二酸盐半酯对HIV蛋白酶有抑制作用。熊果酸虽然具有抗HIV活性,但同时也有轻微的细胞毒性,不能直接开发为抗HIV药物,需通过结构修饰来增强抗病毒活性,减少毒副作用。
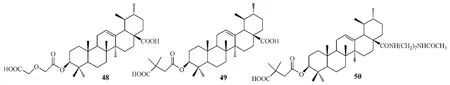
Kashiwada 等[20]发现,熊果酸的 3-O-酰基衍生物48和49对人T淋巴细胞H9中HIV病毒的复制具有显著抑制作用,EC50分别为0.31 和2.1 μmol·L-1,治疗指数(TI)分别为155.5和23.6,抗HIV活性和安全性均优于熊果酸(EC50为 4.4 μmol·L-1,TI为3.3)。Huang等[21]对熊果酸的C3位和C17位羧基进行结构修饰,合成了一系列衍生物,其中化合物50系在化合物49的C17位羧基上引入了较长的氨基侧链所得,其活性更强,抑制病毒复制的EC50为0.23 μmol·L-1,TI为 47.0。
5 其他生物活性
陈荣等[22]合成了一系列熊果酸酯,并对其肝保护作用进行了考察。结果显示,熊果酸和熊果酸乙酯对四氯化碳所致的小鼠急性肝损伤均有保护作用且效果相近,而熊果酸辛酯的肝保护作用更强,可见与熊果酸成酯的脂肪醇链越长,抗肝损伤作用越显著。
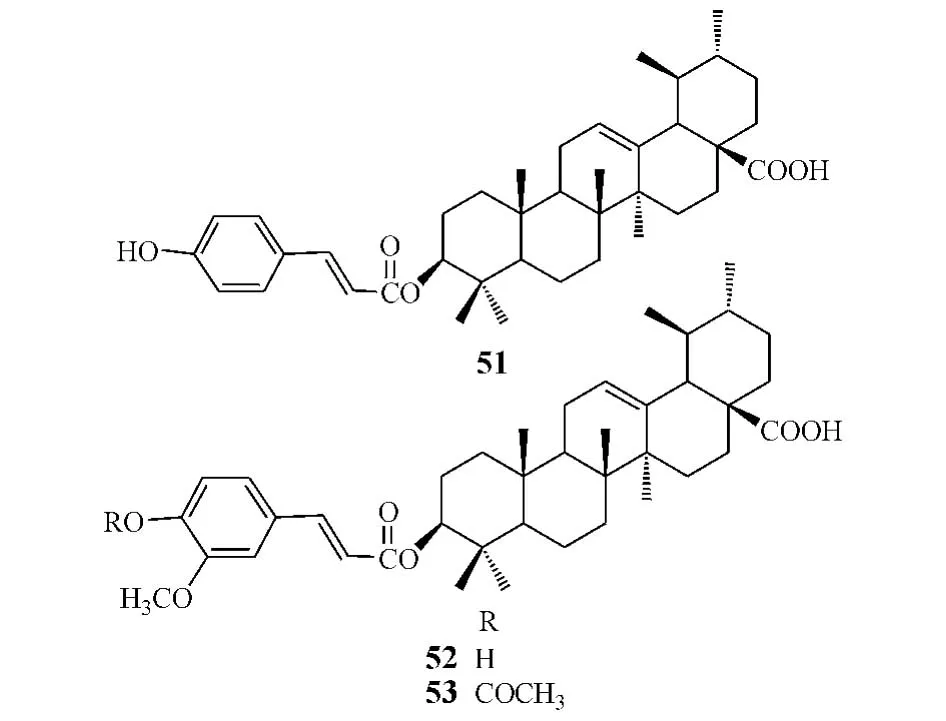
Tanachatchairatana等[23]以多种肉桂酸衍生物对熊果酸C3位羟基进行酰化,并对所得到的多种化合物抗结核分支杆菌H37Ra株的活性进行了测试,结果显示,熊果酸C3位羟基被酰化后,抗菌活性增强,其中化合物51~53的最低抑菌浓度(MIC)分别为 6.25、3.13 和 3.13 mg·L-1,而熊果酸为 12.0 mg·L-1。
肉桂酸是从肉桂皮或安息香中分离出的一种有机酸,其本身就具有长效杀菌作用而广泛应用于果蔬防腐,Tanud等将肉桂酸衍生物与熊果酸成功组合为抗菌活性更强的化合物,为新型抗菌药物的开发提供了宝贵的思路。
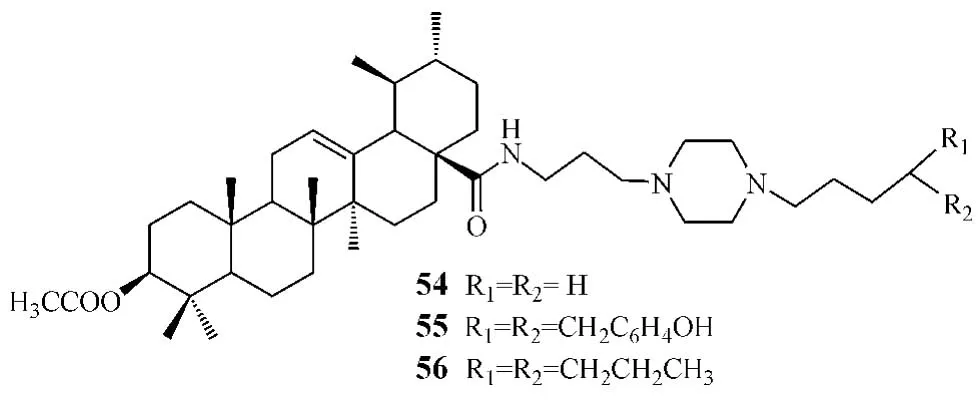
此外,熊果酸还具有抗疟活性。Gnoatto等[24]发现,将熊果酸的C3位羟基乙酰化、C17位羧基上引入含有哌嗪环的氨基侧链后,其抗疟活性得到显著增强,如化合物54~56对恶性疟原虫的IC50分别为0.17、0.16 和 0.8 μmol·L-1,而熊果酸的 IC50为52.93 μmol·L-1。
6 结语
熊果酸具有广泛的生物活性,且存在于多种植物中,资源丰富,廉价易得,故而极具开发前景。目前国内外有关熊果酸结构修饰及其衍生物构效关系的研究报道也越来越多,为该类化合物作为潜在药物的进一步研究提供了基础。笔者所在课题组正在对与熊果酸具有相同母核的毛冬青甲素进行结构修饰工作,已合成一部分在母核中同时引入2个氨基侧链的衍生物,并计划对其进行抗炎、抗肿瘤等多种活性的筛选,以期获得有望开发为新型抗炎药及抗肿瘤药物的候选化合物。
另外,一些研究尚不深入的课题值得我们考虑,例如,目前国内外相关文献中,对于熊果酸抗肿瘤作用的研究较多,而降血糖作用及抗HIV作用等方面的报道较少;此外,笔者发现国内外诸多文献中报道的熊果酸结构修饰方法,绝大多数是在C3位羟基或C17位羧基上连接其他基团,且相比于其他环,母核中A环受到的关注较多,若能拓宽思路,尽可能尝试在熊果酸的其他位置进行改造,或以与熊果酸结构类似的化合物为研究对象,也许会有更多的候选化合物被发现,也能大大提高筛选工作的成功率。
[1]Muto Y,Ninomiya M,Fujiki H.Present status of research on cancer chemoprevention in Japan[J].JpnJClin Oncol,1990,20(3):219-224.
[2]Meng Y Q,Liu D,Cai L L,etal.The synthesis of ursolic acid derivatives with cytotoxic activity and the investigation of their preliminary mechanism of action[J].Bioorg MedChem,2009,17(2):848-854.
[3]Ma CM,Cai SQ,Cui JR,etal.The cytotoxic activity of ursolic acid derivatives[J].EurJMedChem,2005,40 (6):582-589.
[4]Chadalapaka G,Jutooru I,McAlees A,etal.Structuredependent inhibition of bladder and pancreatic cancer cell growth by 2-substituted glycyrrhetinic and ursolic acid derivatives[J].BioorgMedChemLett,2008,18(8): 2633-2639.
[5]Tu H Y,Huang A M,Wei B L,etal.Ursolic acid derivatives induce cell cycle arrest and apoptosis in NTUB1 cells associated with reactive oxygen species[J].Bioorg MedChem,2009,17(20):7265-7274.
[6]Finlay H J,Honda Tadashi,Gribble GW,etal.Novel A-ring cleaved analogs of oleanolic and ursolic acids which affect growth regulation in NRP.152 prostate cells[J].BioorgMedChemLett,1997,7(13):1769-1772.
[7]Niesen A,Barthel A,Kluge R,etal.Antitumoractive endoperoxides from triterpenes[J].ArchPharm,2009,342(10):569-576.
[8]陈军,柳军,龚彦春,等.新型糖原磷酸化酶抑制剂熊果酸衍生物的合成及其生物活性[J].中国药科大学学报,2006,37(5):397-402.
[9]Wen XA,Sun H B,Liu J,etal.Naturally occurring pentacyclic triterpenes as inhibitors of glycogen phosphorylase:synthesis,structure-activity relationships,and X-ray crystallographic studies[J].JMedChem,2008,51 (12):3540-3554.
[10] Zhang P,Hao J,Liu J,etal.Synthesis of 3-deoxypentacyclic triterpene derivatives as inhibitors of glycogen phosphorylase[J].JNatProd,2009,72(8):1414-1418.
[11] Judy W V,Hari S P,Stogsdill W W,etal.Antidiabetic activity of a standardized extract(Glucosol)fromLagerstroemiaspeciosaleaves in Type II diabetics A dosedependence study[J].JEthnopharmacol,2003,87(1): 115-117.
[12] Wen XA,Sun H B,Liu J,etal.Pentacyclic triterpenes. Part 1:the first examples of naturally occurring pentacyclic triterpenes as a new class of inhibitors of glycogen phosphorylases[J].BioorgMedChemLett,2005,15 (22):4944-4948.
[13] Wen XA,Xia J,Cheng K,etal.Pentacyclic triterpenes. Part5:synthesis and SAR study of corosolic acid derivatives as inhibitors of glycogen phosphorylases[J].Bioorg MedChemLett,2007,17(21):5777-5782.
[14] Kwon T H,Lee B,Chung S H,etal.Synthesis and NO production inhibitory activities of ursolic acid and oleanolic acid derivatives[J].BullKoreanChemSoc,2009,30(1): 119-123.
[15] Honda Tadashi,Gribble GW,Suh N,etal.Novel synthetic oleanane and ursane triterpenoids with various enone functionalities in ring A as inhibitors of nitric oxide production in mousemacrophages[J].JMedChem,2000,43 (9):1866-1877.
[16] Honda Tadashi,Finlay H J,Gribble GW,etal.New enone derivatives of oleanolic acid and ursolic acid as inhibitors of nitric oxide production inmousemacrophages[J].BioorgMedChemLett,1997,7(13):1623-1628.
[17] Honda Tadashi,Rounds B V,Bore L,etal.Synthetic oleanane and ursane triterpenoids with modified rings A and C:a series of highly active inhibitors of nitric oxide production in mouse macrophages[J].JMedChem,2000,43(22):4233-4246.
[18] 杨定菊,李颖,尹述凡.3-O-乙酰基熊果酸 3-乙酰基-2-[(未)取代苯基]-2,3-二氢-1,3,4-噁二唑-5-甲酯的合成及其抗炎活性研究[J].有机化学,2008,28(6): 1055-1060.
[19]田瑛,董俊兴.天然产物中抗艾滋病病毒活性成分的研究进展[J].中国中药杂志,2002,37(6):401-406.
[20] Kashiwada Yoshiki,Nagao Tsuneatsu,Hashimoto Ayumi,etal.Anti-AIDS agents 38.Anti-HIV activity of 3-O-acyl ursolic acid derivatives[J].JNatProd,2000,63(12): 1619-1622.
[21] Huang L,Yu D L,Ho P,etal.Synthesis and anti-HIV activity of bi-functional triterpene derivatives[J].Lett DrugDesDiscov,2007,4(7):471-478.
[22]陈荣,廖晓峰.熊果酸酯的合成研究[J].现代食品科技,2006,22(4):181-182.
[23] Tanachatchairatana T,Bremner JB,ChokchaisiriR,etal. Antimycobacterialactivity of cinnamate-based esters of the triterpenes betulinic,oleanolic and ursolic acids[J].Chem PharmBull,2008,56(2):194-198.
[24] Gnoatto SC,Susplugas S,Dalla Vechia L,etal.Pharmacomodulation on the 3-acetylursolic acid skeleton:design,synthesis,and biological evaluation of novelN-{3-[4-(3-aminopropyl)piperazinyl]propyl}-3-O-acetylursolamide derivatives as antimalarial agents[J].BioorgMedChem,2008,16(2):771-782.
Advances in Research on Structure-activity Relationships of Ursolic Acid Derivatives
LICai-lian, FENG Feng
(DepartmentofPhytochemistry,ChinaPharmaceuticalUniversity,Nanjing210009,China)
The advances in research on the structural modification of ursolic acid and the structureactivity relationships(SARs)of ursolic acid derivatives were reviewed in this paper.Ursolic acid is a kind of pentacyclic triterpenoid which is widely found in natural plants and has a variety of pharmacological acti-vities such as anti-tumor activity, anti-diabetic activity, anti-inflammatory activity and anti-HIV activity.Therefore,it has been paid a great attention by more and more researchers.The research on the structural modification of ursolic acid and the SARs of ursolic acid derivatives has become a hotspot,from which the ideal candidate compounds might be aquired.
ursolic acid;structural modification;structure-activity relationship
R 284
A
1001-5094(2011)01-0023-07
10.3969/j.issn.1001-5094.2011.01.004
[接受日期]2010-11-04
*通讯作者:冯锋,教授;
研究方向:天然产物活性成分研究;
Tel:025-83271038; E-mail:fengsunlight@163.com
(责任编辑:杨臻峥)
热点药物追踪
