IL-22对人气道细胞的作用
2011-02-01蓝海兵周丽丽赖文岩黎振兴任敦强钟浩海罗雅玲
张 旃 蓝海兵 周丽丽 赖文岩 徐 建 黎振兴 任敦强 叶 涵 钟浩海 罗雅玲
(南方医科大学附属南方医院呼吸内科,广东 广州 510515)
IL-22对人气道细胞的作用
张 旃 蓝海兵 周丽丽1赖文岩2徐 建3黎振兴 任敦强 叶 涵 钟浩海 罗雅玲
(南方医科大学附属南方医院呼吸内科,广东 广州 510515)
目的 探讨IL-22对人气道上皮细胞、气道平滑肌细胞、气道成纤维细胞的生理学作用。方法 用实时定量PCR检测气道上皮细胞、气道平滑肌细胞、气道成纤维细胞哮喘血清刺激前后IL-22R1 mRNA表达的变化。不同浓度的IL-22(10 ng/ml,100 ng/ml,1 000 ng/ml)刺激气道上皮细胞、气道平滑肌细胞和气道成纤维细胞后,用MTT法检测细胞的增殖,用流式细胞技术(FACS)检测细胞的凋亡和坏死。结果 哮喘血清刺激后气道上皮细胞IL-22R1 mRNA表达降至正常对照组的9%,气道平滑肌细胞IL-22R1 mRNA表达升高至正常对照组的345倍,而气道成纤维细胞IL-22R1 mRNA表达无明显变化。高剂量(1 000 ng/ml)的IL-22刺激气道上皮细胞和气道成纤维细胞12、24 h可显著降低细胞增殖(P<0.05,P<0.01)。三种不同浓度的IL-22刺激气道上皮细胞24 h后均导致细胞凋亡显著下降(P<0.05),低浓度的IL-22(10 ng/ml)导致细胞坏死增加(P<0.01)。不同浓度的IL-22刺激气道平滑肌细胞后,细胞凋亡和坏死无显著性变化。中、高浓度IL-22(100 ng/ml,1 000 ng/ml)刺激气道成纤维细胞后,细胞坏死率显著下降(P<0.05)。结论 IL-22在支气管哮喘中对气道上皮的作用具有双重性,并与支气管哮喘的病程相关;而对气道平滑肌细胞的作用则可能与浓度及病程相关。支气管哮喘后续阶段,IL-22对气道成纤维细胞作用轻微。
白细胞介素-22;气道上皮细胞;气道平滑肌细胞;气道成纤维细胞
白细胞介素-22(IL-22)与呼吸系统疾病密切相关,能增加肺上皮细胞的增殖及对抗经上皮的损伤〔1〕。在呼吸机相关的肺损伤中IL-22通过增加肺泡上皮细胞的抵抗性,防止细胞拉伸和肺损伤,因而吸入IL-22对高压通气导致的肺损伤具有保护作用〔2〕。产生IL-22的Th17细胞同时也产生IL-17,而IL-17涉及支气管哮喘的发生发展〔3,4〕,且Th17细胞也与支气管哮喘密切相关〔5〕,因而推测IL-22也与支气管哮喘相关联。资料显示气道上皮参与IL-22对呼吸系统疾病产生的作用〔6〕。此外,重度过敏性哮喘患者的血清IL-22水平呈增高趋势〔7〕。而近来有报道显示IL-22能够诱导人气道平滑肌细胞迁移〔8〕,显然IL-22在支气管哮喘的发生发展中能够对气道平滑肌产生一定的作用。支气管哮喘患者的气道重构有多种间质细胞参与,本文前期的研究显示在人气道上皮细胞、气道平滑肌细胞以及气道成纤维细胞均有IL-22R1受体的表达,因而这些细胞是IL-22在气道的靶细胞。本实验通过不同浓度的IL-22刺激人气道上皮细胞、气道平滑肌细胞、气道成纤维细胞,观察IL-22对这些细胞增殖及凋亡坏死的影响。
1 材料与方法
1.1 材料
1.1.1 主要试剂 Trizol(Invitrogen公司);逆转录试剂盒(晶美公司);SYBR Green试剂盒(NEB公司);IL-22R1一抗(eBIOSCIENCE公司,种属来源:兔);β-actin一抗(Santa Cruz公司,种属来源:小鼠);抗α-actin(北京博奥森,种属来源:兔);重组人 IL-4(晶美公司);γ-干扰素(IFN-γ)、转化生长因子(TGF-β)(Sigma公司)。
1.1.2 细胞来源 正常人支气管上皮细胞株HBE135-E6E7(美国ATCC,CRL-2741TM);人胚肺成纤维细胞株MRC-5(购自中国科学院上海细胞生物学研究所);正常人支气管平滑肌细胞由南方医科大学附属南方医院呼吸内科罗雅玲实验室黎振兴赠送。
1.1.3 哮喘血清 经患者同意,从南方医科大学附属南方医院呼吸门诊重度哮喘患者(男2例,女4例)提取血清(抗原皮试试验阳性,IgE>1 000 U/ml),近期均未用过激素。取全血样品,37℃温浴1 h,1 500 r/min,离心 10 min,在超净台内无菌环境下提取上清,-20℃冻存备用。
1.2 方法
1.2.1 细胞分组准备 0.125%胰酶消化,按1∶2比例传代至4~8代,换成无血清DMEM培养基,另补充胰岛素1 U/L、转铁蛋白5μmol/L和TGF-β15 mg/L培养24 h后,实验组分别加入10%哮喘血清,10%哮喘血清 +地塞米松(10 nmol/L),IL-4(10 ng/m l),IFN-γ(10 ng/m l),TGF-β(10 ng/ml),继续孵育24 h。收集六孔板细胞提取RNA或蛋白。
1.2.2 实时PCR检测人气道细胞IL-22R1 mRNA的表达
1.2.2.1 引物、探针的合成 IL-22R1基因引物序列:上游5'-CCCCACTGGGACACTTTCTA-3'(20 bp),下游 5'-TGGCCCTTTAGGTACTGTGG-3'(20 bp)〔9〕。内参基因 GAPDH 引物序列:上游 5'-TTCGACAGTCAGCCGCATCTT-3'(±21 bp),下游 5'-ATCCGTTGACTCCGACCTTCA-3'(21 bp)。引物由Invitrogen公司合成。
1.2.2.2 细胞总RNA的提取及逆转录反应 按Trizol试剂盒提供的操作步骤提取各组细胞的RNA,-70℃保存,按逆转录试剂盒提供的操作步骤合成cDNA(-20℃保存)。将得到的PCR产物进行跑胶,回收纯化,计算浓度及纯度。
1.2.3 免疫荧光PCR 采用Sybrgreen染料法,按照试剂说明书配好反应体系,制备标准曲线后,将每个样本重复3次,上机(7000 real-time PCR System,ABI)。反应体系及条件如下:Mix+Sybr 10 μl,F 4P 2 μl,R4P 2 μl,H2O 5 μl,模板1 μl,总量20 μl,扩增条件:95℃ 2 min,94℃ 30 s,60℃ 30 s,72℃ 45 s,40个循环。
1.2.4 结果分析 以GAPDH为内参校准基因,对比IL-22R1基因的扩增效率,以人气道平滑肌细胞组为对照样品,每个样品中IL-22R1基因相对于对照样品的表达量,以2-△△Ct值表示(Ct值代表到达检测荧光阈值的循环数)。
1.2.5 噻唑蓝(MTT)法检测细胞增殖
1.2.5.1 细胞培养与传代 所有细胞均贴壁培养于10 m l完全培养液细胞培养瓶中,37℃、5%CO2条件下培养。细胞长满瓶底后用灭菌磷酸盐缓冲液(PBS)洗2次,加0.25%胰蛋白酶消化1 min,倒掉胰蛋白酶,待轻摇细胞能完全脱落后,加完全培养基30 m l,用移液管吹散细胞,分装于3个新的细胞培养瓶中,继续培养。
1.2.5.2 细胞刺激处理 待细胞长满后,取其中一瓶,胰蛋白酶消化后收集细胞,用移液管吹打均匀,取两滴细胞悬液用台盼蓝染色,于显微镜下计数活细胞数目,以每孔10 000个细胞接种到96孔板,每孔体积200μl。将培养板置于CO2培养箱中培养,细胞贴壁后换无血清培养液培养24 h,使细胞同步化于G0期。取出培养板后弃去无血清培养基,加入含不同浓度IL-22的完全培养液,使 IL-22终浓度分别为:1 000 ng/ml,100 ng/ml,10 ng/ml。每个浓度设3个复孔,另设3孔细胞加入不含IL-22的完全培养液作阴性对照孔。置于CO2培养箱继续培养24 h。刺激结束后,每孔加入5 mg/ml MTT 20μl,振荡混匀,于37℃、5%CO2继续孵育 4 h,小心吸弃上清,每孔加150μl二甲基亚砜(DMSO),振荡10 min,使结晶物充分融解。选择492 nm波长于Bio-Tek酶标仪上测定各孔光吸收值。
1.2.6 流式细胞术(FACS)测细胞凋亡及坏死 台盼蓝记数细胞活力>95%的气道上皮细胞、气道平滑肌细胞和成纤维细胞以106/孔接种于6孔细胞培养板,细胞贴壁后换无血清1640或DMEM培养基24 h,使细胞同步于 G0期。分别以0,10,100,1 000 ng/ml IL-22刺激24 h,设3复孔。刺激结束以无二乙胺四乙酸(EDTA)的0.25%胰蛋白酶收集上清和底壁细胞。2 000 r/min,离心5 min。沉淀以无菌PBS洗,2 000 r/min,离心5 min。重复2次。沉淀以200μl binding缓冲液重悬。加入2μl AnnexinV-EGFP,5μl碘化丙啶(PI)。流式细胞仪检测凋亡率。
1.3 统计学分析 采用SPSS16.0软件进行比较分析,统计数据用±s表示,多组间比较用单因素方差(ONE-WAY ANOVA)分析,组间两两比较用LSD法。
2 结果
2.1 气道细胞在10%哮喘血清刺激后IL-22R1 mRNA的表达变化 哮喘血清刺激后的气道上皮细胞IL-22R1mRNA表达明显下降,仅为对照细胞表达的9%;而气道平滑肌细胞经哮喘血清刺激后IL-22R1 mRNA表达显著性上升,为对照组气道平滑肌细胞的345倍;但气道成纤维细胞在哮喘血清刺激前后IL-22R1 mRNA表达无明显变化。
2.2 MTT检测人气道细胞增殖 高浓度IL-22(1 000 ng/ml)作用人气道上皮细胞平滑肌细胞12、24 h后与对照组相比较,细胞OD值显著性下降(P<0.01,P<0.05),高浓度IL-22作用细胞6 h细胞增殖无显著性差异(P>0.05)。中、低浓度的IL-22(10 ng/m l,100 ng/ml)作用细胞后 6、12、24 h,气道上皮细胞增殖呈下降趋势,而气道平滑肌细胞增殖呈增高趋势,但差异均无统计学意义(P>0.05)。不同浓度的IL-22作用于人气道成纤维细胞6、12 h或24 h后,细胞增殖与对照组相比无显著性差异(P>0.05)。见图1。
2.3 流式细胞术观察不同浓度IL-22刺激下气道细胞凋亡及坏死百分比 不同浓度的IL-22刺激时气道上皮细胞凋亡率显著下降(P<0.05),低剂量的IL-22(10 ng/ml)作用细胞时坏死率显著升高(P <0.01),中、高浓度(100 ng/ml,1 000 ng/m l)的IL-22刺激下的气道上皮细胞坏死率呈增高趋势,但差异无统计学意义(P>0.05)。不同浓度的IL-22(10 ng/m l、100 ng/m l、1 000 ng/ml)刺激气道平滑肌细胞后凋亡率及细胞坏死率无显著性差异(P>0.05)。不同浓度的IL-22刺激气道成纤维细胞后细胞凋亡率无显著性改变(P>0.05)。中、高浓度 IL-22(100 ng/m l,1 000 ng/ml)刺激成纤维细胞后细胞坏死率显著下降(P<0.05),低浓度的IL-22(10 ng/ml)作用后成纤维细胞坏死率呈下降趋势,但差异无统计学意义。见表1~表3。

图1 不同浓度IL-22刺激人气道细胞不同时间点的OD值
表1 不同浓度IL-22刺激下气道上皮细胞各成分百分比(±s,%)

表1 不同浓度IL-22刺激下气道上皮细胞各成分百分比(±s,%)
与 IL-22 0 ng/ml组比较:1)P <0.05,2)P <0.01,下表同
74.27±2.55 12.73±1.25 0.27±0.06 IL-22 10 ng/ml组 82.07±1.25 8.50±0.731) 0.9±0.262)IL-22 100 ng/ml组 82.07±1.25 8.07±0.91) 1.20±0.662)IL-22 1 000 ng/ml组 80.43±1.75 9.10±1.301) 1.33±0.902)组别 正常 凋亡 坏死IL-22 0 ng/ml组
表2 不同浓度IL-22刺激下气道平滑肌细胞各成分百分比(±s,%)
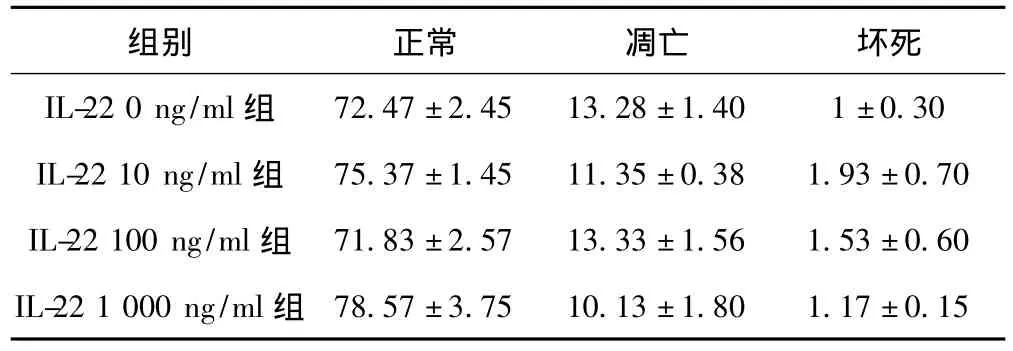
表2 不同浓度IL-22刺激下气道平滑肌细胞各成分百分比(±s,%)
72.47±2.45 13.28±1.40 1±0.30 IL-22 10 ng/m l组 75.37±1.45 11.35±0.38 1.93±0.70 IL-22 100 ng/ml组 71.83±2.57 13.33±1.56 1.53±0.60 IL-22 1 000 ng/ml组组别 正常 凋亡 坏死IL-22 0 ng/ml组78.57±3.75 10.13±1.80 1.17±0.15
表3 不同浓度IL-22刺激下气道成纤维细胞各成分百分比(±s,%)

表3 不同浓度IL-22刺激下气道成纤维细胞各成分百分比(±s,%)
44.07±3.45 25.18±2.95 5.53±2.40 IL-22 10 ng/m l组 50.77±7.06 23.55±3.88 2.13±0.70 IL-22 100 ng/ml组 52.87±2.30 22.83±0.93 1.47±0.451)IL-22 1 000 ng/ml组 53.23±0.25 22.55±0.20 1.67±0.061)组别 正常 凋亡 坏死IL-22 0 ng/ml组
3 讨论
IL-22最初被描述为一种IL-10相关的T细胞来源的诱导因子(IL-TIF),属于IL-10家族。最初认为产生IL-22的辅助性T淋巴细胞(Th)细胞是一种Th17细胞的变体〔10〕,但近来报道显示除了 Th17 细胞外,其他细胞如 Th22〔11〕、Th1、γδT 细胞(10-12)、经典的和非经典的自然杀伤(NK)细胞以及CD11c+细胞均可以产生 IL-22〔12~15,1〕,但不包括组织细胞〔16~18〕。支气管哮喘患者气道上皮细胞屏障破坏,上皮细胞或坏死脱落,或细胞受损导致一些生长因子如上皮生长因子(EGF)、血小板来源生长因子(PDGF)释放、TGF-β、血管内皮生长因子(VEGF)及乙酰胆碱释放,从而促进包括气道平滑肌细胞增生、细胞外基质沉积、血管再生在内的气管壁重构〔19〕。数据显示IL-22对人气道上皮细胞的增殖具有抑制作用,并能使细胞凋亡,坏死增加。Besnard等人发现与野生型小鼠相比,IL-22缺失的小鼠过敏性气道炎症显著下降,伴随着嗜酸性粒细胞聚集下降和炎性细胞因子显著下降。此外,野生型小鼠在致敏阶段注入IL-22抗体可以减弱肺部过敏性炎症。且资料显示过敏性哮喘患者血清中IL-22水平增高。综合这些数据表明IL-22可能促进了支气管哮喘气道炎症的发生,并且通过气道上皮细胞发挥一定的作用。
哮喘血清刺激后的人气道上皮细胞IL-22R1mRNA表达显著降低,仅为对照组细胞的9%,显示出哮喘血清通过降低人气道上皮细胞对IL-22的敏感性,减少IL-22对气道上皮细胞的作用,提示IL-22在支气管哮喘的过程中对气道上皮具有保护作用。研究者将IL-22抗体中和剂注入卵清蛋白(OVA)致敏后的OVA刺激阶段的过敏性哮喘小鼠,发现气道炎症加重了,而给予重组IL-22则能防止肺部炎症。此外一份近来的研究显示IL-22可防止博莱霉素诱导的凋亡〔6〕。这些资料表明IL-22具有组织保护作用,这似乎表明IL-22在实验中显示出对气道上皮乃至对支气管哮喘的双重作用,认为这可能与支气管哮喘的病程即启动阶段或持续阶段、气道上皮的状态即生理状态或是病理状态相关。在支气管哮喘疾病的启动阶段,抑制气道上皮细胞凋亡,促进气道上皮细胞坏死,抑制细胞增殖修复,从而促进气道炎症的发生;而在支气管哮喘的后续状态则可能具有组织保护作用。
本实验结果显示高浓度的IL-22显著抑制人气道平滑肌细胞增殖,而中低浓度的IL-22作用后,气道平滑肌细胞的增殖呈增高趋势,这提示IL-22对人气道平滑肌细胞的增殖作用可能具有浓度依赖性。IL-22作用人气道平滑肌细胞后细胞凋亡和坏死无显著性变化,表明IL-22可能没有参与人气道平滑肌细胞的凋亡和坏死程序。有趣的是,与气道上皮细胞显然不同,哮喘血清刺激下的气道平滑肌细胞IL-22R1mRNA表达显著上升。这提示支气管哮喘的启动阶段,IL-22很可能通过释放不同浓度来发挥其对气道平滑肌细胞的作用;而在支气管哮喘的后续阶段,IL-22的浓度可能下降,这时IL-22很可能通过气道平滑肌细胞IL-22R1对IL-22敏感性发生变化来调节其对气道平滑肌的作用。在气道成纤维细胞,中、高浓度的IL-22能显著降低细胞坏死率。由此推测在气道成纤维细胞,IL-22可能更多的是一种保护因子。然而直接用IL-22刺激后发现细胞增殖无统计学差异,且人气道成纤维细胞在IL-22刺激后细胞凋亡无显著性变化;此外,哮喘血清刺激后气道成纤维细胞IL-22R1 mRNA的表达未显示出任何变化,因而推测支气管哮喘后续阶段,IL-22对气道成纤维细胞作用轻微。
总之,哮喘血清刺激下的气道上皮细胞、气道平滑肌细胞IL-22R1 mRNA表达变化明显,由此推测IL-22在支气管哮喘中的作用是通过气道上皮细胞和气道平滑肌来完成。IL-22在支气管哮喘中对气道上皮的作用具有双重性,并与支气管哮喘的病程相关;而对气道平滑肌细胞的作用则可能与浓度及病程相关。支气管哮喘后续阶段,IL-22对气道成纤维细胞作用轻微。
1 Zheng Y,Valdez PA,Danilenko DM,et al.Interleukin-22 mediates early host defense against attaching and effacing bacterial pathogens〔J〕.Nat Med,2008;14(3):282-9.
2 Hoegl S,Bachmann M,Scheiermann P,et al.Protective properties of inhaled IL-22 in amodelof ventilator-induced lung injury〔J〕.Am JRespir Cell Mol Biol,2011;44(3):369-76.
3 Agache I,Ciobanu C,Agache C,et al.Increased serum IL-17 is an independent risk factor for severe asthma〔J〕.Respir Med,2010;104(8):1131-7.
4 Barczyk A,PierzchalaW,Sozanska E.Interleukin-17 in sputum correlates with airway hyperresponsiveness tomethacholine〔J〕.Respir Med,2003;97(6):726-33.
5 Zhu J,Yamane H,PaulWE.Differentiation of effector CD4 T cell populations〔J〕.Annu Rev Immunol,2010;28:445-89.
6 Sonnenberg GF,Nair MG,Kirn TJ,et al.Pathological versus protective functions of IL-22 in airway inflammation are regulated by IL-17A〔J〕.J Exp Med,2010;207(6):1293-305.
7 Zhao Y,Yang J,Gao YD,et al.Th17 immunity in patients with allergic asthma〔J〕.Int Arch Allergy Immunol,2010;151(4):297-307.
8 Chang Y,Al-Alwan L,Risse PA,et al.T(H)17 cytokines induce human airway smooth muscle cellmigration〔J〕.JAllergy Clin Immunol,2011;127(4):1046-53.
9 Ikeuchi H,Kuroiwa T,Hiramatsu N,etal.Expression of interleukin-22 in rheumatoid arthritis:potential role as a proinflammatory cytokine〔J〕.Arthritis Rheum,2005;52(4):1037-46.
10 Wolk K,Witte E,Witte K,et al.Biology of interleukin-22〔J〕.Semin Immunopathol,2010;32(1):17-31.
11 Duhen T,Geiger R,Jarrossay D,et al.Production of interleukin 22 but not interleukin 17 by a subset of human skin-homing memory T cells〔J〕.Nat Immunol,2009;10(8):857-63.
12 Martin B,Hirota K,Cua DJ,et al.Interleukin-17-producing gammadelta T cells selectively expand in response to pathogen products and environmental signals〔J〕.Immunity,2009;31(2):321-30.
13 Siegemund S,Schutze N,Schulz S,et al.Differential IL-23 requirement for IL-22 and IL-17A production during innate immunity against salmonella enterica serovar enteritidis〔J〕.Int Immunol,2009;21(5):555-65.
14 Colonna M.Interleukin-22-producing natural killer cells and lymphoid tissue inducer-like cells in mucosal immunity〔J〕.Immunity,2009;31(1):15-23.
15 Satoh-Takayama N,Vosshenrich CA,Lesjean-Pottier S,et al.Microbial flora drives interleukin 22 production in intestinal NKp46+cells that provide innatemucosal immune defense〔J〕.Immunity,2008;29(6):958-70.
16 Eyerich S,Eyerich K,Pennino D,et al.Th22 cells represent a distinct human T cell subset involved in epidermal immunity and remodeling〔J〕.JClin Invest,2009;119(12):3573-85.
17 Nograles KE,Zaba LC,Shemer A,et al.IL-22-producing“T22”T cells account for upregulated IL-22 in atopic dermatitis despite reduced IL-17-producing TH17 T cells〔J〕.JAllergy Clin Immunol,2009;123(6):1244-52.
18 Trifari S,Kaplan CD,Tran EH,et al.Identification of a human helper T cell population that has abundant production of interleukin 22 and is distinct from T(H)-17,T(H)1 and T(H)2 cells〔J〕.Nat Immunol,2009;10(8):864-71.
19 Dekkers BG,Maarsingh H,Meurs H,etal.Airway structural components drive airway smooth muscle remodeling in asthma〔J〕.Proc Am Thorac Soc,2009;6(8):683-92.
The effect of IL-22 on hum an airway structural cell
ZHANG Zhan,LAN Hai-Bing,ZHOU Li-Li,et al.
Department of Respiratory Disease,Nanfang Hospital,Southern M edical University,Guangzhou 510515,Guangdong,China
Objective To study the role of IL-22 on human airway epithelial cells,airway smooth muscle cell and airway fibroblasts.M ethods IL-22R1 mRNA of the above three cells in different groups weremeasured by real-time PCR.Cell proliferation of such three cellswere stimulated by IL-22 of different concentrations in different groups weremeasured by MTT assay.Cell apoptosis and necrosis in the above group weremeasured by FACS.Results IL-22 mRNA of airway epithelial cells stimulated by asthmatic sera was significantly reduced,while airway smoothmuscle cellswas increased to 345 times of control group.Therewas not difference between treatmentand control groups of airway fibroblasts.Cell proliferation was decreased in airway epithelial cells and airway smooth muscle cells in 1 000 g/m l IL-22 group(P<0.05).IL-22 significantly reduced cell apoptosis and 10 ng/ml IL-22 increased cell necrosis in airway epithelial cells(P<0.01).There were not significant difference of cell apoptosis and necrosis among different groups of airway smoothmuscle cells.Cell necrosis were significantly reduced in airway fibroblast stimulated by 100 ng/ml and 1 000 ng/m l IL-22(P<0.05).Conclusions IL-22 has a dual role on airway epithelial cells in asthma pathologic process.The role of IL-22 on airway smoothmuscle cellsmaybe related to IL-22 concentration and disease course.The role of IL-22 on airway fibroblastsmay be very mild to asthma.
IL-22R1;IL-22;Human airway epithelial cells;Human airway smooth muscle cell;Human airway fibroblasts;Cell proliferation;Cell apoptosis;Cell necrosis
R33
A
1005-9202(2011)12-2222-04
国家自然科学基金资助项目(No.30770936)
1 肾内科 2 心血管内科重点实验室 3 肾移植科
罗雅玲(1946-),女,教授,主任医师,主要从事呼吸系统哮喘病学研究。
张 旃(1974-),女,在读博士,主要从事呼吸系统哮喘病学研究。
〔2011-04-11收稿 2011-04-22修回〕
(编辑 袁左鸣/徐 杰)
