淫羊藿素体外抗淋巴瘤细胞增殖效应
2011-02-01范双翼余英豪
范双翼,余英豪
(南京军区福州总医院病理科,福州 350025)
抗肿瘤药物的研究一直是药物研发的热点,而植物药成为抗肿瘤药物的重要来源之一,如紫杉醇、长春花碱等,都是一线抗肿瘤药物。淫羊藿素(icaritin,ICT),是来源于小檗科淫羊藿属植物的活性成分,其化学结构属黄酮类化合物。分子式为C20H20O6,分子量356.38。其化学结构式为:

近年来,ICT抗肿瘤作用备受人们关注[1,2],但对淋巴瘤的作用尚未见报道。本实验选择EL-4细胞做为载体,研究 ICT体外对淋巴瘤细胞的作用并分析其可能机制。
1 材料和方法
1.1 细胞株
EL-4小鼠淋巴瘤细胞,购自中国科学院上海细胞生物研究所细胞库。悬浮生长于含10%胎牛血清的RPMI-1640培养液中,置5%CO2、37℃培养箱中常规培养。1~2 d换液一次,3~4 d传代。
1.2 主要试剂
淫羊藿素(ICT)由第二军医大学殷正丰教授馈赠(纯度99%)。RPMI-1640为Hyclone公司产品。胎牛血清(FBS)为奥地利PAA公司产品。二甲基亚砜(DMSO)、MTT(噻唑蓝)为 Sigma公司产品。TrizolTM RNA Isolation Reagent、DEPC 为 美 国Invitrogen公司产品。AMV 反转录试剂盒为Promega Reverse Transcription System A3500。PCR试剂盒为Takara rTaq。DNA Marker(600 bp)为上海生工生物工程技术服务有限公司产品。Caspase-3、9分光光度法检测试剂盒为南京凯基生物科技发展有限公司产品。DNA-PREP RENGENT KIT为美国COULER公司产品。
1.3 M TT法检测细胞增殖
根据 ICT浓度不同,分为1.25、2.5、5、10、20、40μmol/L组,同时设未加药物的阴性对照组。每组样本设4个平行孔,选取生长状况良好,活细胞数大于95%的细胞,起始浓度1×105个/L接种于96孔板中,在37℃,5%CO2及饱和湿度条件下,分别培养24 h、48 h和72 h,置酶标仪下测定OD值。以下列公式计算细胞增殖抑制率:细胞增殖抑制率(%)=(1-实验组OD值/对照组OD值)×100%。量效关系曲线分析计算IC50值。
1.4 超微结构观察
未加药物组EL-4细胞与40μmol/L ICT作用6 h细胞各一瓶,经 PBS漂洗,2.5%戊二醛-1.5%多聚甲醛及1%锇酸固定,环氧树脂618包埋,超薄切片,醋酸铀及柠檬酸铅染色,Philips-EM208S透射电镜观察并摄片。
1.5 流式细胞术检测
实验组ICT浓度分别为40μmol/L、80μmol/L。对照组为未加药物的细胞。收集细胞,离心,PBS洗涤,300目过滤网过滤后制成单细胞悬液,调整细胞浓度为1×106/m L,按DNA-PREP RENGENT KIT试剂盒操作步骤进行操作,在染色20 min后上机检测。用COULER Muticycle分析系统对检测结果进行分析。
1.6 基因m RNA表达的半定量RT-PCR检测
40μmol/L ICT处理6 h的EL-4细胞,用Trizol法提取总RNA,逆转录成cDNA,以获得的cDNA为第一链,以Bcl-2、P21基因引物进行PCR扩增,同时选用GAPDH作为内参照。DNA扩增产物进行凝胶电泳分析。
1.7 Caspase-3与Caspase-9活力测定
40μmol/L ICT作用EL-4细胞6 h,同时设立阴性对照组,用PBS洗涤细胞二次,收集细胞沉淀,加入裂解液置冰上裂解40 m in,离心后取少量上清,BCA法测定蛋白浓度。吸取50μL含100~200μg蛋白的细胞裂解上清,加入50μL的反应液及5μL Caspase-3,于37℃避光孵育4 h。设立空白对照组,用分光光度计在λ=400 nm测定其吸光值。通过计算OD实验组/OD对照组的倍数来确定实验组 Caspase-3活化程度。同法确定Caspase-9活化程度。
1.8 统计学处理
应用 SPSS13.0统计分析软件对 Caspase-3、Caspase-9采用t检验分析,抑制率采用x2检验进行统计学处理。数据以均数±标准差(±s)表示,以P<0.05为有显著性差异;P<0.01为极显著性差异。
2 结果
2.1 M TT法检测 ICT对 EL-4细胞增殖的抑制作用
采用不同浓度ICT处理EL-4细胞24 h,各实验组与对照组细胞增殖抑制率比较均具有显著性差异(P<0.05),见表1。算得ICT作用24 h IC50值为5.26μmol/L。10μmol/L ICT分别作用于 EL-4细胞12 h、24 h、48 h,各作用时间点EL-4细胞的增殖均受到抑制,与对照组比较具有显著性差异(P< 0.05),见表2。上述结果表明,ICT对EL-4细胞增殖的抑制作用有剂量和时间性。

表1 不同浓度ICT处理24 h的EL-4细胞增殖抑制率Tab.1 The inhibition ratio of EL-4 cells in differrent dose of ICT after 24 h

图1 倒置显微镜下不同浓度ICT处理24 h细胞形态比较Fig.1 Themorphology comparison of cells in different dose of ICT after 24 h under inverted microscope

表2 10μmol/L ICT处理不同时间的EL-4细胞增殖抑制率Tab.2 The inhibition ratio of EL-4 cells in 10μmol/LICT after different time
倒置显微镜下可见实验组细胞结构不完整,细胞内颗粒增多,细胞数量减少,且随着加药浓度的增加,这种变化趋于明显(图1A-D)。
2.2 ICT对EL-4细胞凋亡的诱导作用
2.2.1 EL-4细胞超微结构观察
(1)对照组EL-4细胞:镜下瘤细胞弥漫成片分布,细胞间不粘着,无连接复合体及桥粒。瘤细胞中等大小,形态单一,圆形或椭圆形,胞质稍丰富,胞质内细胞器量中等,部分细胞表面有小突起。瘤细胞核较大,圆形或卵圆形,部分不规则。染色质以常染色质为主,异染色质少,分散排列或位于核膜下,核仁明显,1个或多个。瘤细胞核浆比例高。可见到个别凋亡细胞(彩插1图2~4)。
(2)40μmol/L ICT作用EL-4细胞6 h:出现大量凋亡细胞,呈现典型的细胞凋亡形态学改变。早期表现为核异染色质增多、浓缩、结块边集,核膜水肿、间隙增宽,胞质浓缩深染;中期染色质聚集在核膜下形成半月形、环状、块状和其它不规则形状,核膜水肿加重,间隙加宽;后期核裂解,形成多个凋亡小体(彩插1图5~7)。
2.2.2 流式细胞术检测ICT作用后EL-4细胞凋亡
40μmol/L、80μmol/L的 ICT作用 EL-4细胞6 h,凋亡细胞百分率分别为12.3%和71.7%。随着剂量增高,凋亡百分率亦增高。如图8~10所示。
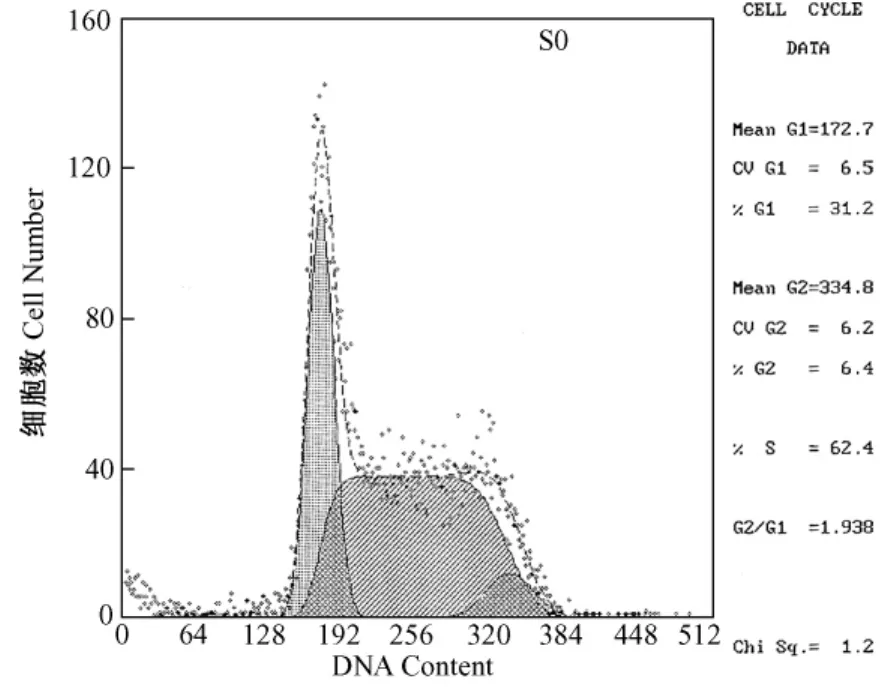
图8 对照组Fig.8 The control group
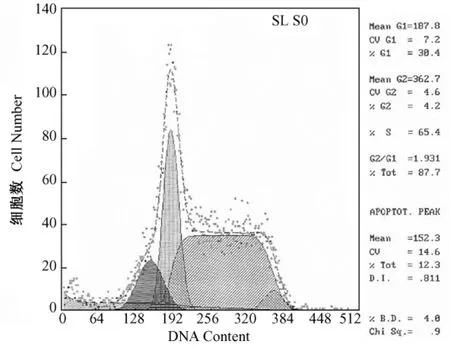
图9 40μmol/L实验组,可见到明显凋亡峰Fig.9 40μmol/L group,the apoptotic peak can be seen clearly
2.3 ICT对EL-4细胞凋亡相关基因m RNA表达的影响
由图11可见紫外光下显示明亮清晰的18 s与28 s两条rRNA带,说明提取的RNA完整。EL-4细胞处理组(40μmol/L ICT作用6 h)与对照组比较显示,Bcl-2、P21的 mRNA在药物作用后表达明显下调(图11)。

图10 80μmol/L实验组,凋亡峰愈加明显Fig.10 80μmol/L group,the apoptotic peakbecame more obvious

图11 ICT对EL-4细胞凋亡相关基因 mRNA表达的影响Fig.11 The effect of ICT on the expression ofmRNA of apoptosis-related gene of EL-4 cells
2.4 ICT对EL-4细胞Caspase-3、Caspase-9酶活性的影响
经40μmol/L、80μmol/L的 ICT处理 EL-4细胞6 h后 Caspase-3与 Caspase-9酶活性明显提高(表3、图12)。
3 讨论
有研究表明,ICT具有雌激素样活性[3],并可诱导小鼠胚胎干细胞定向分化为神经细胞[4];增强诱导的神经元细胞共表达神经元特异性微管蛋白(βtubulin III)和胆碱乙酰基转移酶[5]。近年来,其抗肿瘤作用备受人们关注。文献表明ICT可通过G1期阻滞抑制前列腺癌细胞的增殖[1],具有一定的抗肿瘤活性。但其对淋巴瘤的作用尚未见报道。
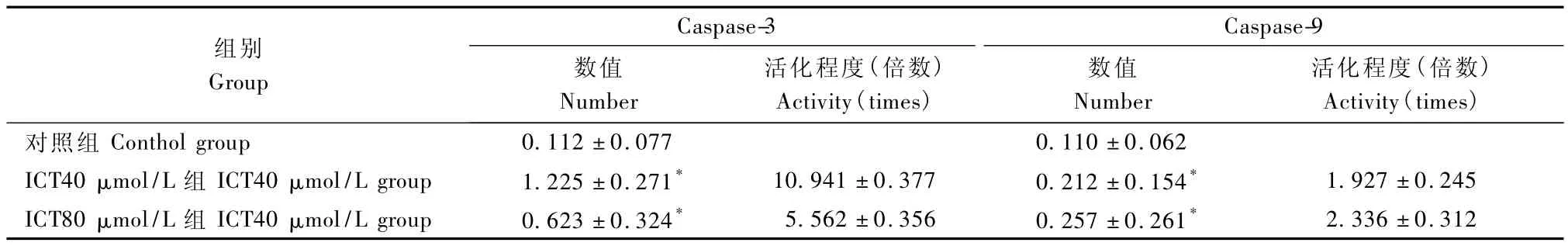
表3 不同浓度ICT对Caspase-3与Caspase-9酶活性的影响Tab.3 The effect on the enzyme activity of Caspase-3 and Caspase-9 of ICT in different dose
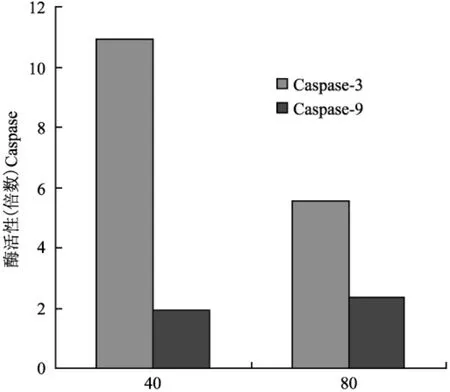
图12 不同浓度ICT(μmol/L)对Caspase-3与Caspase-9酶活性的影响Fig.12 The effect on the enzyme activity of Caspase-3 and Caspase-9 of ICT in different dose
本研究将不同浓度的ICT与EL-4细胞共培养,采用 MTT比色法检测其对EL-4细胞生长的影响,结果显示在5~20μmol/L浓度范围内,ICT对EL-4细胞的生长产生明显的抑制作用,并且随着浓度的提高,作用时间的延长,抑制作用愈明显,呈时间和浓度依赖性。
细胞凋亡(apoptosis)是为调控机体发育、维持内环境稳定,由基因控制的细胞主动死亡的过程。细胞凋亡失常与肿瘤发生密切相关,诱导肿瘤细胞凋亡对于肿瘤的治疗具有重大意义[6]。本研究采用流式细胞术分析发现,与对照组相比,实验组在二倍体峰的左侧出现明显的亚二倍体凋亡特征峰,且随着剂量的增加,凋亡峰也愈加明显,显示出剂量依赖性。在透射电镜下,可发现对照组很难见到凋亡细胞,而实验组则能观察到成片较多的典型的凋亡细胞,不仅能看到凋亡各个时期的表现,而且能看到大量凋亡小体。这些结果提示ICT能够诱导EL-4细胞的凋亡。
在此基础上,本实验进一步研究了ICT诱导凋亡的可能机制。
细胞凋亡受到各种凋亡调控蛋白的调控[7]。Bcl-2首先在人类滤泡性淋巴瘤中被确认,是发现最早的抗凋亡基因[8],是细胞凋亡的重要调节者。这一家族的某些成员为凋亡激动蛋白(如 Bax,Bak,Bcl-xs,Bad,Bid等),而另一些成员则为凋亡拮抗蛋白(如Bcl-2,Bcl-XL,Bcl-w等)。我们的研究结果显示ICT能使 EL-4细胞Bcl-2 mRNA表达下调,提示Bcl-2参与了ICT诱导EL-4细胞发生凋亡的过程。
P21蛋白最初被认为是一种能引起细胞周期停滞的细胞周期调控蛋白,在药物诱导的肿瘤抑制中起重要作用。近来,大量研究表明根据细胞类型及微环境不同,P21既有促凋亡作用,也有抑制调亡作用[9]。其阻止凋亡作用的机制可能与 Caspase-3介导的 P21裂解使 cyclinA/CDK2活性改变有关。Adachi等[10]研究发现缺氧可增加 Caspase-3活性,裂解P21,使其表达下降而致cyclinA/CDK2活性上调,引起细胞凋亡。本实验发现,ICT作用EL-4细胞后,P21 mRNA表达下调,提示P21可能参与EL-4细胞凋亡的过程。
Caspase家族是一类蛋白水解酶,在细胞内以无活性的酶原形式存在。是执行凋亡的主要酶类,绝大部分细胞凋亡依赖于其存在[11]。通常认为Caspase-9属于凋亡起始组,而 Caspase-3是凋亡的主要执行者,属于凋亡效应组。一旦被激活,起始Caspase即转活化其他 Caspase酶原,引起级联激活效应,导致细胞凋亡[11]。激活的 Caspase-3作用于底物PARP,使之发生水解,其水解产物促进细胞骨架降解和 DNA片断化[12]。本研究通过比色法Caspase-3、Caspase-9酶活性检测显示 40μmol/L ICT能够显著增强 EL-4细胞 Caspase-3酶活性,也可同时增强Caspase-9酶活性,可能是促进 EL-4细胞的凋亡的因素之一。
综上所述,ICT体外可有效抑制EL-4细胞的生长,并诱导其细胞凋亡。考虑其作用可能通过下调bcl-2、P21 mRNA表达,激活Caspase-3、Caspase-9蛋白等途径实现的。
[1]Huang X,Zhu D,Lou Y.A novel anticancer agent,icaritin,induced cell growth inhibition,G1 arrest and mitochondrial transmembrane potential drop in human prostate carcinoma PC-3 cells[J].Eur JPharmacol,2007;564(1):26-36.
[2]Ye HY,Lou YJ.Estrogenic effects of two derivatives of icariin on human breast cancer MCF-7 cells[J].Phytomedicine.2005; 12:735-741.
[3]Wang ZQ,Lou YJ.Proliferation-stimulating effects of icaritin and desmethylicaritin in MCF-7 cells[J].Eur J Pharmacol.2004,504(3):147-153.
[4]Zhu DY,Zhang XN,Du Y.Directed differentiation of mouse embryonic stem cells into neuronal cells induced by icaritin in vitro[J].Journal of ZheJiang University(Medical Sciences).2007,36(3):217-223.
[5]Wang Z,Wang H,Wu J,et al.Enhanced co-expression of betatubulin III and choline acetyltransferase in neurons from mouse embryonic stem cells promoted by icaritin in an estrogen receptorindependentmanner[J].Chem Biol Interact.2009,179(2-3):375-85.
[6]Kataoka S,Tsuruo T.Physician Education:Apoptosis[J].Oncologist.1996,1(6):399-401.
[7]Nagata S.Apoptosis by death factor[J].Cell,1997;88(3): 355-336.
[8]Kockenbery D,Nunez G,Milliman C,et al.Bcl-2 is an inner m itochondrial membrane protein that blocks programmed cell death[J].Nature,1990,348(6299):334-336.
[9]Liu S,Bishop WR,Liu M.Differential effects of cell cycle regulatory protein p21(WAF1/Cip1)on apoptosis and sensitivity to cancer chemotherapy[J].Drug Resist Updat.2003,6(4): 183-195.
[10]Adachi S,Ito H,Tamamori-Adachi M,et al.Cyclin A/cdk2 activation is involved in hypoxia-induced apoptosis in cardiomyocytes[J].Circ Res.2001,88(4):408-414.
[11]袁长青,丁振华.Caspase的结构与功能[J].国外医学分子生物学分册,2002,24(3):146-150.
[12]Perfettini JL,Kroemer RT,Kroemer G.Fatal liaisons of p53 with Bax and Bak[J].Nature Cell Biology,2004,6:386-388.
