轴突生长抑制因子重组疫苗预防免疫减轻阿尔茨海默症模型小鼠行为学损伤
2011-02-01张玲玲马全红杨武林马春梅徐艳峰肖志成
张玲玲,马全红,杨武林,刘 颖,马春梅,黄 澜,徐艳峰,朱 华,邓 巍,肖志成,秦 川
(1.北京协和医学院比较医学中心,中国医学科学院医学实验动物研究所,卫生部人类疾病比较医学重点实验室;北京协和医学院比较医学中心,中国医学科学院医学实验动物研究所,国家中医药管理局人类疾病动物模型三级实验室,北京 100021;2.苏州大学神经科学研究所,苏州 215123;3.蒙纳士大学免疫干细胞实验室,维多利亚,澳大利亚 3800;4.昆明医学院分子临床医学研究所,昆明 650031)
阿尔茨海默症(A lzheimer's disease,AD)又名老年痴呆症是引发痴呆的最常见疾病。随着人口老龄化的加重,阿尔茨海默症越来越受到人们的重视。虽然目前有大量阿尔茨海默症的相关研究报道但并未阐明该病病因机理,而一系列药物也并不能起到实质性治疗作用。轴突损伤,神经元丢失不可再生是老年痴呆症患者学习记忆渐进性损伤并最终导致痴呆的直接原因。而脑内神经元不可再生主要是由脑内环境造成的,其中髓鞘相关轴突生长抑制因子蛋白(NGI)在抑制神经元,轴突再生过程中扮演重要角色[1-3]。NGI是一系列以抑制轴突生长为主要功能的蛋白。轴突生长抑制因子蛋白重组疫苗能够促进脊髓横断损伤小鼠轴突生长,恢复脊髓功能[4-5],该研究结果为该疫苗在神经退行性变疾病中的应用提供了可能。基于以上研究,本研究构建NGI重组疫苗并观察NGI重组疫苗对阿尔茨海默症转基因模型小鼠的预防效果。
1 材料和方法
1.1 质粒
NGI重组DNA质粒包含小鼠 Tenascin-R(TNR)和Tenascin-C(TN-C)蛋白的表皮生长因子样区域,以及人受体样蛋白酪氨酸磷酸酶β的cDNA,每个亚克隆序列末端加入三个丙氨酸作为连接[6]。以上三个片段顺次连接后经 Bg1II和 XbaI酶切位点插入 pcDNA3.1+载体(pcDNA-NGI),产物经过PCR和测序验证。PcDNA3.1+和pcDNA-NGI质粒在大肠杆菌中扩增,质粒大提试剂盒(美国Promega公司)提取无内毒素质粒,制备成1μg/μL溶解在磷酸盐溶液中,-20℃冻存备用。

图1 重组DNA疫苗示意图Fig.1 recombinant DAN vaccine
1.2 H is蛋白的表达及纯化
设计带有Pet28载体(李万波教授馈赠)限制性酶切位点的 Tenascin R引物,构建质粒 Pet28-Tenascin R,将质粒转染入 BL21(DE3)细胞,LB固体培养基过夜培养,挑取单克隆菌落加入 LB液体培养基,37℃振荡培养至OD值为0.6~0.9,加入终浓度1 mM IPTG,25℃诱导6~8 h,超声破碎菌体,SDS-PAGE电泳分析蛋白表达。GE 1m L HP His蛋白纯化柱纯化蛋白。
1.3 实验动物及分组
APP/PS1转基因小鼠由我所遗传中心实验室构建,该转基因小鼠三月龄出现认知行为学改变,4.5月脑内出现老年斑沉积[7-8]。无任何行为学改变及脑内老年斑沉积的4~5周小鼠随机分为四组:野生对照组(注射PBS);模型对照组(注射PBS);空载体对照组(注射pcDNA3.1质粒);疫苗组(注射pcDNA-NGI)。每组12只,雌雄各半。实验动物饲养室温18℃ ~25℃,相对湿度(30% ~70%),每日光照12 h,自由摄食引水,实验动物使用及操作均严格按照中国医学科学院实验动物伦理委员会标准进行(证号ILAS-PL-2010-003)。
1.4 免疫和抗体测定
小鼠免疫采用DNA疫苗肌肉注射免疫,具体如下:4~5周小鼠肌肉注射质粒100μg/只,两周一次,连续免疫直至实验结束。四只小鼠用来进行抗体检测,免疫前及免疫后每两周取血,分离血清,-80℃冻存,检测抗体使用。
抗体检测采用双夹心Elisa法,具体步骤简述如下:纯化蛋白his-TNR 10 ng/孔包被板(美国corning公司)4℃过夜孵育,5%脱脂奶粉与0.5%BSA混合液37℃1 h封闭,血清样品1∶200稀释,37℃1 h孵育,山羊抗小鼠二抗(中衫金桥PS-6002)室温1 h孵育,TBS发光液室温孵育15 min,含有2M硫酸的终止液终止显色,酶标仪450 nm读数。
1.5 行为学检测:M orris水迷宫
利用荷兰Noldus ethvision XT行为学分析软件及监测系统对小鼠学习记忆能力进行测试与数据分析。Morris水迷宫 DMS-2系统由中国科学院药物研究所提供,包括一个圆形不锈钢水池,直径100 cm,高50 cm;将水池等分为4个象限;目标象限的中央放置一直径为9 cm,高27 cm的圆形隐藏平台,整个实验期间其位置保持不变;水池中水面高于平台且加入奶粉,以隐藏平台并使水不透明,水温保持(26±1)℃;实验期间迷宫外设足够的参照物,且始终保持不变。迷宫上方安置带有显示系统的摄像机,同步记录小鼠运动轨迹,Morris水迷宫数据采集和分析软件记录相关数据及图象结果。整个实验过程分为隐藏平台获得实验和空间搜索实验两部分。
1.5.1 隐藏平台获得实验:用于测量动物在水迷宫中的学习和记忆能力。实验历时5 d。正式实验每天训练4次,每次60 s,随机从东、西、南、北4个入水点选择一个,将动物面向池壁放入水中,记录动物寻找并爬上平台所需时间即潜伏期(latency)。如果动物在60 s内未找到平台,由实验者将其引至平台,潜伏期记为60 s;动物在平台上停留20 s(此种停留对在水中高度紧张的小鼠非常重要,它可避免小鼠再跳回水中,以保证实验的成功)。每次训练之间和4次训练完成后,迅速将动物洗净擦干,置于加热器旁,以防动物低体温。每只动物共计训练20次。计算每天各组4次逃避潜伏期的平均值。
1.5.2 空间搜索实验:用于测量动物对平台空间位置准确记忆,即记忆保持能力。第6天撤除平台,任选一个入水点将动物放入水中,动物在水中游泳60 s,测量60 s内:(1)动物在目标象限(原平台所在象限)(target quadrant)的游泳时间;(2)穿越目标(原平台所在区域及象限)次数。Noldus ethvision XT行为学分析软件记录数据后,采用SPSS13.0统计学软件进行数据分析。
2 结果
2.1 抗体检测
在裸DNA免疫两次后抗体OD平均值由免疫前的0升至0.3并一直维持在0.3左右直至实验结束(图2)。结果显示裸DNA疫苗注射在整个实验过程都产生了有效的抗体。
2.2 水迷宫检测
5天的隐藏平台获得实验中转基因组和空载体组潜伏期虽然在第2,3天缩短,但第4,5天的训练却出现潜伏期再次延长的现象,表明其学习能力受损。疫苗组潜伏期在第3天出现平台期(较第2天并无缩短)但随着训练次数的增加在第4,5天显著缩短并较模型对照组和空载体对照组有显著差异(P<0.05),疫苗组潜伏期随训练天数变化趋势与野生组一致,表明疫苗对痴呆小鼠的学习能力起到了改善作用(图3)。在探索实验中,转基因和空载体组穿越原平台及原平台所在象限的次数,停留时间均较野生组缩短表明其记忆功能受损。疫苗组穿越次数增加停留时间延长表明预防免疫能够改善APP/PS1的记忆功能(图3)。

图2 抗体动态检测示意图Fig.2 Fig.re of antibody
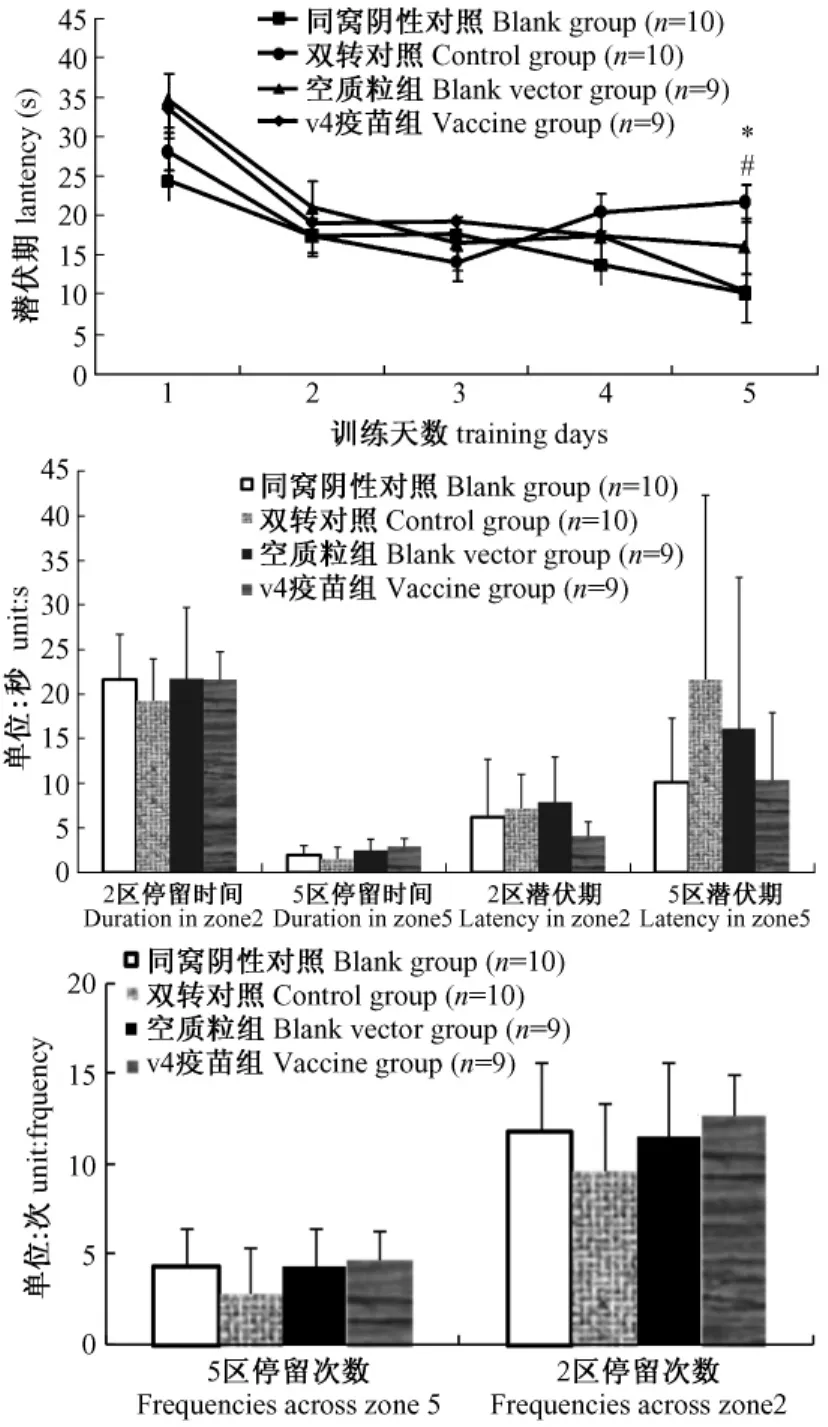
图3 Morris水迷宫实验结果(*P<0.05,P<0.01野生对照组VS双转对照组;#P<0.05空质粒对照组VS疫苗组)Fig.3 Open field test result(*P<0.05,WT group vs placebo group;#P<0.05,vehicle vs vaccine group)
3 讨论
阿尔茨海默症是以神经元丢失为病变基础的神经退行性变疾病,神经元的损伤不可再生是导致病人出现各种症状的根本原因。神经元的不可逆性损伤大部分归咎于髓鞘及少突胶质细胞相关的轴突生长抑制因子蛋白。Tenascin R,Tenascin C,受体样蛋白酪氨酸磷酸酶β,均为髓鞘相关轴突生长抑制因子蛋白[11-12]。髓鞘相关轴突生长抑制因子重组疫苗能够应用于神经退行性疾病治疗[1-3,13],由MAG Ig1-5区域,TN-R的EGFL区域,NogoA的66氨基酸胞外区域及N端构成的DNA疫苗能在大鼠体内产生有效抗体,促进脱髓鞘大鼠的皮质脊髓束轴突再生[4],增加脊髓损伤大鼠体内神经生长因子蛋白的表达[5],并无脱髓鞘副反应的产生[4]。本文中我们检验了轴突生长抑制因子疫苗是否也能有效的改善阿尔茨海默症的症状。DNA疫苗便于构建,生产方便,且DNA疫苗注射可产生有效抗体[4]。我们采用裸DNA疫苗连续注射的免疫方式。实验结果表明此方法在免疫期间产生了虽然不高但持续有效的抗体。APP/PS1双转小鼠是由过表达人的 APP swedon双突变(K594N/ M595L)和 PS1单突变(deltaE9)小鼠杂交而成,两种突变均为家族性老年痴呆症的患病基因,双转小鼠的老年斑随年龄的增长而不断增多,学习记忆损伤也不断加重[7-8,9]。行为学检测方法水迷宫实验表明疫苗能有效改善模型小鼠的行为学损伤。到目前为止针对阿尔茨海默症的治疗药物只能取得症状的改善,疫苗治疗也多聚焦于 Aβ蛋白的被动或主动免疫以期待减少Aβ蛋白的表达,而对于与老年痴呆症状学习记忆损伤直接相关的轴突改善却被人忽略。本文中髓鞘相关轴突生长抑制因子重组疫苗预防免疫能改善模型小鼠的行为学,可能机制推测为该疫苗预防阿尔茨海默症导致的轴突损伤,为阿尔茨海默症的免疫治疗提供了新契机。其具体机制尚待我们进一步实验研究证实。本实验中DNA免疫虽产生有效抗体,但需连续免疫,为疫苗发展前景带来阻碍,我们会进一步在免疫剂量,方式方面进行改善,期待得到更加有效简便的免疫方式。另外,本实验中的疫苗免疫在小鼠产生行为学症状前进行,至于该疫苗是否对小鼠有治疗效果还需我们进一步实验证实。
致谢:感谢李万波教授、刘江宁博士对实验中质粒构建及蛋白表达纯化的帮助和指导。
[1]Ang BT,Xu G,Xiao ZC.Therapeutic vaccination for central nervous systemrepair[J].Clin Exp Pharmacol Physiol,2006,33 (5-6):541-5.
[2]Ma QH,Yang WL,Nie DY,et al.Physiological roles of neurite outgrowth inhibitors in myelinated axons of the central nervous system——implications for the therapeutic neutralization of neurite outgrowth inhibitors[J].Curr Pharm Des,2007,13 (24):2529-37.
[3]Nie DY,Xu G,Ahmed S,et al.DNA vaccine and the CNS axonal regeneration[J].Curr Pharm Des,2007,13(24):2500-6.
[4]Gang Xu,Duyu Nie,Jutao Chen,et al.Recombinant DNA vaccine encoding multiple domains related to inhibition of neurite outgrowth:a potential strategy for axonal regeneration.[J].Neurochem,2004,91:1018-1023.
[5]Zhang Y,Hao CG,Hu LQ,et al.Recombinant DNA vaccine against inhibition of neurite outgrowth promotes functional recovery associated with endogenous NGF expression in spinal cord hemisected adult rats[J].Neurochem Res.2009 Sep;34 (9):1635-41.
[6]高伟,张玲玲.NGI重组DNA疫苗对转基因AD小鼠的治疗作用[J].中国比较医学志,2009,19(6):13-16.
[7]Jankowsky JL;Fadale DJ;Anderson J et al.Mutant presenilins specifically elevate the levels of the 42 residue beta-amyloid peptide in vivo:evidence for augmentation of a 42-specific gamma secretase[J].Hum Mol Genet,2004,13(2):159-70.
[8]宗园媛,王晓映.APP/PPS双转基因阿尔茨海默病小鼠模型的老年斑及行为学动态分析[J].中国比较医学杂志,2008,18(9):8-12.
[9]袁树民,张晓娟.阿尔茨海默病模型小鼠自主活动能力的分析[J].中国比较医学杂志,2010,20(4):5-8.
[10]Zhao Y,Pei J,Ji Z,et al.Effect of amyloid precursor protein 17mer peptide on microtubule structure and tau protein hyperphosphorylation in hippocampal neurons of experimental diabetic m ice[J].NeuroReport,2003,14(20):61-66
[11]Prinjha R,Moore SE,Vinson M,et al.Inhibitor of neurite outgrowth in humans[J].Nature,2000,403(6768):383-4.
[12]Pesheva P,Spiess E,Schachner M.J1-160 and J1-180 are oligodendrocyte-secreted nonperm issive substrates for cell adhesion[J].JCell Biol,1989,109(4):1765-1778.
[13]Strittmatter SM. Modulation of axonal regeneration in neurodegenerative disease:focus on Nogo[J].JMol Neurosci,2002,19(1-2):117-21.
