西藏小型猪Leptin及其受体胞外区片段的克隆及原核表达
2011-02-01吴丽红王丛莉刘玉鹏黄黎珍施振旦顾为望
吴丽红,范 沛,王丛莉,刘玉鹏,黄黎珍,施振旦,顾为望
(1.南方医科大学实验动物中心暨比较医学研究所,广州 510515;2.华南农业大学动物科学学院,广州 510642)
1994年Zhang等[1]在肥胖小鼠(ob/ob)中发现了肥胖基因,其编码的蛋白质产物为瘦素(leptin)。体内瘦素水平的高低影响脂肪的沉积。但后来有人在先天肥胖动物(如db/db小鼠和fa/fa大鼠)和过量摄食导致的肥胖动物中血 leptin的水平升高,说明这些动物体内对leptin的反应减弱或无反应,此现象称为 leptin抵抗[2]。Brown等[3]发现瘦素受体(leptin receptor,OBR)基因第12外显子一个鸟苷酸残基缺失,导致编码序列框架移码,小鼠出现糖尿病和肥胖。1995年,Tartaglia等[4]第一个成功地从小鼠脉络丛中克隆出瘦素受体基因。
瘦素进入血液循环后游离或与瘦素受体结合,通过多种组织及多种形式的瘦素受体,作用于中枢及外周的多个位点,影响机体的许多生理和代谢过程,参与糖、脂肪及能量代谢的调节,促使机体减少摄食,增加能量释放,抑制脂肪细胞的合成,进而使体重减轻,从而维持体内脂肪或能量平衡[5-7]。
本实验主要通过体外克隆西藏小型猪瘦素成熟肽和瘦素受体编码的部分基因,在大肠杆菌中定向表达重组猪瘦素成熟肽和瘦素受体蛋白片段,为进一步研究瘦素及其受体蛋白的生物学功能和利用瘦素及其受体重组融合蛋白预防与控制肥胖奠定研究基础。
1 材料和方法
1.1 试验材料
皮下脂肪、肝脏组织取自南方医科大学实验动物中心暨比较医学研究所提供的西藏小型猪(1头、1周岁、雄性、25 kg、实验动物合格证号:粤监证字2006A055号),液氮运输,-80℃低温冰箱冻存备用。DH5α大肠杆菌、BL21(DE3)大肠杆菌和pRSETA载体均在华南农业大学动物科学学院遗传与育种实验室保存。
1.2 试剂和酶类
用于RNA抽提的Trizol,pMD18-T载体试剂盒,限制性内切酶BamHⅠ、HindⅢ,Taq DNA聚合酶,DNA分子量标准(DL2000),T4连接酶均为 TaKaRa产品;胶回收试剂盒、质粒小量提取试剂盒为Omega产品;反转录试剂盒为日本东洋纺(Toyobo)产品;用于纯化的、带有 His-tag的 50% Ni-NTA 凝胶(Qiagen)和生物素化分子量标准(CST)购自基因公司(广州);OBR基因引物由上海生工生物工程技术有限公司合成;其它试剂均为进口或国产分析纯。
1.3 RNA抽提与反转录
RNA抽提按照Trizol试剂盒说明书操作,反转录根据日本东洋纺反转录试剂盒说明书操作。
1.4 套式PCR引物的设计
根据公布的西藏小型猪瘦素基因序列(GenBank号:GQ240885.1)和猪瘦素受体基因胞外域序列(GenBank号:AF167719.1)设计引物序列如下:


1.5 OBR基因片段扩增(套式PCR法)
瘦素成熟肽PCR反应扩增体系为:上下游引物(20μmol/L)各 1μL、反转录产物 1μL、2× GC buffer I 2.5μL、dNTP(2 mmol/L)2.5μL、LA Taq(5 U/μL)0.25μL、双蒸 H2O 16.75μL。反应条件: 98℃ 3 m in;98℃ 30 s,61℃ 30 s,72℃ 30 s;30个循环;72℃5 m in;10℃保存。1%琼脂糖凝胶电泳检测后纯化,-20℃保存备用。以F1、R1为引物扩增得到的PCR产物命名为 OB。再以 OB为模板进行PCR扩增,反应体系为:引物(M1+N1)(20μmol/ L)1μL、OB 1.5μL、2×GC buffer I 2.5μL、dNTP(2 mmol/L)2.5μL、LA Taq(5U/μL)0.25μL、ddH2O 17.25μL。反应条件:98℃ 3 m in;98℃ 30 s,69℃30 s,72℃ 30 s;30个循环;72℃ 5 min;10℃保存。1%琼脂糖凝胶电泳检测纯化后 -20℃保存备用。扩增得到的PCR产物命名为mOB。
瘦素受体片段PCR反应扩增体系为:上下游引物(20μmol/L)各1μL、反转录产物1μL、10×Ex Taq缓冲液 2.5μL、dNTP(2 mmol/L)2.5μL、Ex Taq(5U/μL)0.25μL、ddH2O 16.75μL。反应条件:94℃ 3 m in;94℃ 30 s,55℃ 30 s,72℃ 1 min;30个循环;72℃5 min;10℃保存。1%琼脂糖凝胶电泳检测后纯化,-20℃保存备用。以F2、R2为引物扩增得到的PCR产物命名为AQ。再以AQ为模板进行PCR扩增,反应体系为:引物(M2+N2)(20 μmol/L)1μL、AQ1.5μL、10×Ex Taq缓冲液2.5 μL、dNTP(2 mmol/L)2.5μL、Ex Taq 0.25μL、ddH2O 17.25μL。反应条件:94℃ 3 min;94℃ 30 s,57℃ 30 s,72℃ 45 s;30个循环;72℃ 5 m in;10℃保存。1%琼脂糖凝胶电泳检测纯化后-20℃保存备用。扩增得到的PCR产物命名为mAQ。
1.6 OBR基因片段的T-A克隆和序列分析
将 PCR纯化得到片段 mOB、mAQ分别与pMD18-T vector连接,转化大肠杆菌 DH5α,挑取单菌落 7℃振荡培养 12 h,提取质粒,经 PCR和BamHⅠ、HindⅢ双酶切鉴定后,将含正确插入片段的重组质粒分别命名为TmOB、TmAQ,由上海英骏生物技术有限公司进行序列测定。
1.7 原核表达载体的构建
将经测序的阳性重组质粒 TmOB、TmAQ用BamHⅠ、HindⅢ进行双酶切,切胶回收目的片段,同时将pRSETA质粒载体用BamHⅠ、HindⅢ进行双酶切并切胶回收。然后将目的片段与质粒连接,转化BL21大肠杆菌,小量提取质粒DNA进行PCR、酶切和测序鉴定,阳性重组质粒命名为pR-OB、pROBR-a。将鉴定正确的质粒细菌-20℃保种备用。
1.8 pR-OB、pR-OBR-a重组质粒的诱导表达和蛋白检测、纯化
将含有重组质粒pR-OB、pR-OBR-a的保种菌液划板接种于含有终浓度为2.5%的氨苄青霉素钠LB平板上,37℃培养箱静置培养12 h。随机挑取单菌落于2 m L离心管,37℃ 220 r/m in摇床培养过夜。次日吸取50μL菌液接种于含有1 m LLB培养基的4 m L离心管中,37℃ 220 r/m in摇床培养3 h后,加入IPTG使终浓度为1 mmol/L,于37℃220 r/ m in继续培养5 h,离心收集菌液。菌体加入适量的buffer B(8 mol/L尿素溶液)和5×SDS-PAGE上样缓冲液,100℃煮沸5 m in,快速离心取上清于12% SDS-PAGE进行电泳分析。并用 Ni-NTA凝胶在变性条件下按说明书纯化蛋白,最后用含有 8 mol/L尿素的洗脱液洗脱下pR-OB、pR-OBR-a重组融合蛋白。
2 结果
2.1 西藏小型猪组织总RNA提取
将提取的西藏小型猪组织总RNA进行琼脂糖电泳检测,电泳结果显示28S、18S、5SRNA条带清晰(见图1),并且用核酸蛋白测定 RNA纯度 A260/ A280=1.89(肝组织)、A260/A280=1.81(脂肪组织),说明提取的总RNA的完整性良好。
2.2 西藏小型猪瘦素成熟肽和瘦素受体编码基因cDNA片段的扩增
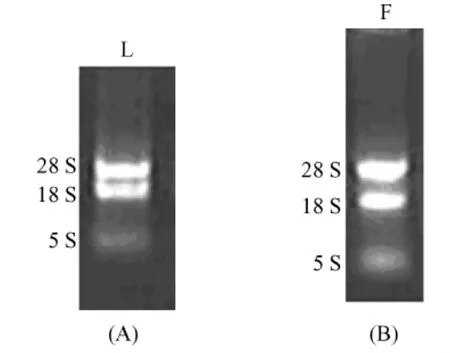
图1 组织总RNA琼脂糖(1%)电泳图Fig.1 Fig.1 Electrophoresismapping of tissuetotal RNA on 1%agarose gel.(A)L:liver tissue RNA;(B)F:adipose tissue RNA
采用套式PCR法扩增后,两个片段分别取5μL PCR扩增产物进行琼脂糖凝胶电泳分析,在溴化乙锭染色后的凝胶上分别出现大小约为460 bp、660 bp左右的单一条带,与预计结果相符。
2.3 西藏小型猪瘦素成熟肽和瘦素受体编码基因片段的T-A克隆与测序
将套式PCR产物切胶回收纯化mOB、mAQ分别与pMD18-T Vector连接,转化大肠杆菌DH5α,挑取单菌落7℃振荡培养12 h,提取质粒,经 PCR和BamHⅠ、HindⅢ双酶切鉴定后,将含正确插入片段的重组质粒分别命名为TmOB、TmAQ,由海英骏生物技术有限公司进行序列测定。测序结果与GenBank上公布的序列对比(GenBank登录号: GQ240885.1、AF167719.1)显示,TmAQ与GenBank上公布的序列一致,TmOB与GenBank上公布的序列对比第 246位点碱基发生突变,但氨基酸序列一致。
2.4 重组原核表达载体的鉴定
将重组好的原核表达载体pR-OB、pR-OBR-a用限制性内切酶BamHⅠ、HindⅢ进行PCR和双酶切鉴定。结果如图2所示。图2A在>2 kb和460 kb处左右有明显的条带,图2B在 >2 kb和660 kb处左右有明显的条带,说明重组质粒构建正确。
2.5 重组质粒 pR-OB、pR-OBR-a诱导表达与纯化
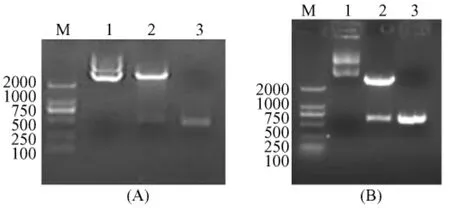
图2 重组原核表达载体PCR和双酶切鉴定琼脂糖(1.2%)电泳图Fig.1 The electrophoresis results of PCRand enzyme digestion of recombined prokaryote expression vector by 1.2%agarose.
经SDS-PAGE分析,大肠杆菌 BL21(DE3)经IPTG诱导表达、纯化,pR-OB在14.3~20.1×103之间约18×103处出现一条蛋白条带(图3B),占菌体总蛋白40%左右。pR-OBR-a在20.1~29.0× 103之间约27×103处出现一条蛋白条带(图3A),占菌体总蛋白值<10%,分子量大小与预计的相符。而pRsetA空菌体均无相应的表达带。说明重组质粒pR-OB、pR-OBR-a分别在大肠杆菌BL21(DE3)中可表达西藏小型猪瘦素成熟肽和瘦素受体片段蛋白。

图3 重组质粒pR-OBR-a和pR-OB诱导表达与纯化12%SDS-PAGE电泳图Fig.3 The electrophoresis results of induced expression and purification of recombined pR-OBR-a and pR-OB by 12%SDS-PAGE.
3 讨论
猪的物质代谢形式与人非常接近。西藏小型猪为新型的实验动物,作为一种稀有的动物资源,其体形小,属于瘦肉型的猪种,其在体脂调节机制上可能与其它猪种存在差异[8]。本研究对西藏小型猪瘦素成熟肽和瘦素受体胞外区部分基因片段进行克隆和测序,为日后进行西藏小型猪与不同猪种间、不同物种间瘦素基因及瘦素受体基因的对比分析奠定工作基础。
已有研究表明,动物免疫瘦素重组融合蛋白后,抗体阻断瘦素与瘦素受体结合,Leptin的作用得不到发挥,采食量下降,脂肪生长沉积,引起动物肥胖及与肥胖相关医学并发症出现。利用受体蛋白片段免疫,产生的抗体可以结合到受体胞外区[9,10],根据不同的片段、不同的动物,抗体可能阻断瘦素或抑制瘦素功能的发挥。如果抗体阻断瘦素的作用,那么可以在促进脂肪沉积的作用,导致动物肥胖综合症的发生。如果受体上某个区域肽片段产生的抗体能够模拟瘦素抑制脂肪生长沉积的作用,这将更好地改善动物肉质及控制肥胖,同时也可能通过影响营养水平而对生殖性能产生影响[11,12]。
国内广西大学兰干球等对巴马小型猪leptin克隆,利用pRSETA载体进行原核表达载体的构建且酶切位点选择EcoRⅠ和HindⅢ,在大肠杆菌BL21中表达[13];中国农业大学胡晓湘等[14]对猪 leptin受体基因进行表达检测与部分片段克隆分析,但猪瘦素受体重组融合蛋白的研究几乎空白。本实验对西藏小型猪 leptin的克隆和原核表达,与巴马小型猪leptin原核表达相比,酶切位点选用的是BamHⅠ和HindⅢ,并在下游酶切位点增加终止密码的一个碱基A。这使得所表达出来的重组融合蛋白大小更接近自然蛋白;对西藏小型猪瘦素受体胞外区片段的克隆和原核表达,制备重组融合蛋白,为研究瘦素及其受体的生理功能和应用提供实验基础。
本实验在基因片段克隆时,采用了套式PCR的方法以获得目的片段。套式PCR的优点在于其特异性较高,如果第一次扩增产生了错误片断,则第二次能在错误片段上进行引物配对并扩增的概率极低。因此,本实验采用套式PCR法,提高PCR扩增获得的目的基因片段的准确性。另外,瘦素基因编码区序列中GC值较高,本实验使用了LA酶搭配GC Buffer进行 PCR扩增,以保证扩增的效率和准确性。
重组质粒pR-OB诱导表达与纯化结果显示,所表达的蛋白量占菌体总蛋白的40%左右,表达量相对较高,纯化的结果也比较理想。这为日后制备融合蛋白作为抗原免疫动物,提供足够的高纯度瘦素奠定了基础。
重组质粒 pR-OBR-a诱导表达与纯化结果显示,所表达的蛋白量少,不到菌体总蛋白的10%。表达菌的活性、诱导条件、目的蛋白毒性、蛋白的空间构型等可影响重组质粒表达效率。若日后需要大部分蛋白时,还需要优化表达的系统。
瘦素及其受体可用于调控人和动物的脂肪沉积。在畜牧业上主要用于动物生产性能的调控;在医学上主要用于肥胖综合症的研究。本文通过对西藏小型猪瘦素成熟肽及瘦素受体胞外域克隆和原核表达,为探讨用主动免疫方法建立西藏小型猪人类肥胖症、糖尿病、心血管系统疾病等疾病动物模型,研究疾病发病机制、预防与控制肥胖提供方法和材料。
4 结论
本研究主要通过提取西藏小型猪肝组织、脂肪组织总RNA,进行RT-套式PCR扩增,获得了瘦素成熟肽及瘦素受体基因编码区的基因片段,并进行T-A克隆、测序分析。在核酸水平上为进一步研究瘦素及瘦素受体基因表达提供了条件;成功构建原核表达载体pR-OB、pR-OBR-a,并成功诱导表达纯化西藏小型猪瘦素受体pR-OB、pR-OBR-a蛋白。
[1]Zhang YY,Proenca R,MaffeiM.et al.Positioanal coining of the mouse obese gene and its human homologue[J].Nature,1994,372:425-432.
[2]Ogawa Y,Masuzaki H,Isse N,et al.Molecular cloning of rat obese cDNA and augmented gene expression in genetically obese Zueker fatty(fa/fa)rats[J].J Clin Invest.1995,96:647 -1652.
[3]Brown JA,Chua SC,Liu SM,et al.Spontaneousmutation in the db gene results in obesity and diabetes in CD-1 outbred mice[J].Am JPhysiol.2000,278(2):R320.
[4]Tartaglia L A,Dembski M,Weng X,et al.Idenlification and expression cloning of a leptin receptor,OBR[J].Cell,1995,83(7):1263-1271.
[5]Pelleymounter MA,Cullen MJ,Baker MB,et al.Effects of the obese gene product on weight regulation in ob/ob mice[J].Science,1995,269:540-543.
[6]Halaas JL,Gajiwala KS,Maffei M,et al.Weight-reducing effects of the plasma protein encoded by the obese gene[J].Science,1995,269:543-546.
[7]Friedman JM.Obesity:Causes and control of excess body fat[J].Nature.2009,459:340-342
[8]赵乐.新型实验动物—西藏小型猪氟烷基因、瘦素基因研究[D].广州.南方医科大学,2007.
[9]Santra S,Rao AJ.Effect of active and passive immunization of male and female rats with a recombinantly expressed Bonnet monkey pituitary GnRH receptor fragment[J].Am J Endocri Immun.2002,48(2):117-125.
[10]Benham CD.Simple recipe for blocking ion channels[J].Nature Biotech.2005,23(10):1234-1235.
[11]李孝伟.主动免疫OBR片段对鸡脂肪生长的影响[D].广州:华南农业大学,2007.
[12]Davelene Israel,Streamson Chua Jr.Leptin receptor modulation of adiposity and fertility[J].Trends Endocrinol Metab.2009,21 (1):10-16.
[13]王世凯.广西巴马小型猪Myostatin和Leptin基因的克隆_表达及动物免疫实验[D].广西:广西大学,2008.
[14]胡晓湘,戴茹娟,李宁,等.猪leptin受体基因 OBR的表达检测与部分片段克隆分析.科学通报,2000,49(17):1845 -1852.
