高糖高脂致大鼠非酒精性脂肪肝合并高血糖动物模型的研究
2011-02-01韩德五李素红郭建红
周 鑫,韩德五,李素红,郭建红
(1.山西医科大学肝病研究所,太原 030001;2.山西省肿瘤医院,太原 030013)
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)的发病率近年来不断攀高且起病渐趋低龄化,并且已经成为发达国家和地区第一大肝病,在我国亦有望成为慢性肝病的首要病因,更为严峻的是,非酒精性脂肪性肝病除了与酒精性肝病一样可导致肝病相关残疾和死亡外,还与2型糖尿病、代谢综合征及相关心脑血管事件密切相关,并被认为是代谢综合征的肝内表现。我们的前期实验研究发现NAFLD在Ⅱ型糖尿病的发生上发挥着重要的作用。因此,建立与人NAFLD合并T2DM形成相似并具有相同的异常代谢特征的动物模型来进行进一步实验研究是十分必要的。国内外文献多用高脂饮食制备NAFLD模型,但是近年来,随着人们饮食习惯的改变,日常生活中人们在大量食用肉类食物(高脂)的同时也大量食入着加入蔗糖的食品(如饮料、快餐等),所以我们模拟现代人类的饮食习惯,采用高糖高脂饮食建立脂肪肝合并高血糖大鼠模型,为进一步研究NAFLD在相关的Ⅱ型糖尿病发生发展中的作用提供工具。
1 材料和方法
1.1 实验动物
Spraque-Dawley大鼠64只,雌雄各半,由山西医科大学实验动物中心提供[SCXK(晋)2009-0001]。
1.2 主要试剂和仪器
丙氨酸氨基转移酶(ALT)试剂盒、游离脂肪酸(FFA)试剂盒、甘油三酯(triglyceride,TG)试剂盒、总胆固醇(total cholesterol,Tch)试剂盒、内毒素(LPS)显色机制鲎试剂盒、肿瘤坏死因子(TNFα)放免试剂盒、胰岛素(FINS)放免试剂盒、血糖(FPG)试剂盒; 721分光光度计:上海第三分析仪器厂;SN-684型放免γ计数器:上海核所日环光电仪器有限公司。
1.3 动物分组及模型的建立
64只大鼠适应性饲养1周后,随机分为8组:3月正常对照组8只(3C),6月正常对照组8只(6C),9月正常对照组8只(9C),12月正常对照组8只(12C),以正常饮食喂养;3月高糖高脂组(3H) 8只,6月高糖高脂组(6H)8只,9月高糖高脂组(9H)8只,12月高糖高脂组(12H)8只,采用高糖高脂膳食(70%正常饲料+20%猪油+10%蔗糖+ 1%胆固醇 +0.25%胆酸)喂养。正常组总热量13.89 KJ/g,模型组总热量68.40 KJ/g。上述各组动物均在天黑前投食,自由饮水,每月称体重一次。分别于实验第3月末、第6月末、第9月末、第12月末处死相应阶段的正常组及高糖高脂组大鼠,采腹主动脉血,3500 r/min离心备用;取肝左叶、内脏脂肪组织和胰腺组织于10%中性福尔马林固定液中固定,石蜡包埋切片。肝组织、胰腺组织切片行苏木素-伊红(HE)和苏丹Ⅳ染色;脂肪组织行苏木素-伊红染色(HE)。
1.4 生化指标检测及腹腔糖耐量试验(IPGTT)
测定血浆 ALT、TG、Tch、LPS、TNFα、FPG、FINS (放免法测定),计算胰岛素抵抗指数(HOMA-IR): HOMA-IR=(FPG×FINS)/22.5和β细胞功能指数(HOMA-β):HOMA-β=(20×FPI)/(FPG-3.5)。腹腔注射葡萄糖耐量试验:于动物2个月时大鼠禁食12 h,称重后腹腔注射葡萄糖2 g/kg,在注射后0、30、60、90、120 min检测血糖。
1.5 病理学检查
10%中性福尔马林溶液固定肝脏、胰腺、附睾部位脂肪组织标本,石蜡包埋切片,进行HE染色(肝、胰、附睾脂肪)和苏丹Ⅳ染色(肝、胰),光镜下观察肝脏病理学改变,胰腺组织病理学改变情况以及观察脂肪组织细胞尺寸大小,每组取5张,每张取5个视野,运用IPP6.0软件分析脂肪细胞、胰岛细胞面积大小。
1.6 统计学分析
2 结果
2.1 大鼠体重及脏器重量的变化
经高糖高脂膳食喂养后,各阶段模型组大鼠与正常组大鼠相比,体重、内脏脂肪重量(用肾周和附睾或子宫周围脂肪组织代表内脏脂肪)明显增加(P<0.05),提示大鼠经过高糖高脂饮食喂养可诱发大鼠发生肥胖以及内脏脂肪的增加,见表1。
3 血脂及肝酶活性的变化
表2结果表明,经一年高糖高脂喂养模型组大鼠于实验第三月末已出现高甘油三酯血症、高胆固醇血症;肝酶ALT活性明显升高。

表1 大鼠体重、脏器重量及其所占百分比变化Tab.1 Data of rats body weight,organ weights and other physiological index

表2 血生化指标的变化Tab.2 Blood biochemicalmanifestation of rats in each group

表3 LPS和TNFα的变化Tab.3 LPS、TNFαin each group
3 LPS及TNFα的变化
表3结果显示,模型组大鼠血清 Lps、TNFα从实验第3个月开始持续增高至第十二月末,但各阶段之间未见明显差异。
4 FINS、FPG、HOM A-IR、HOM A-β的结果及IPGTT试验结果
表4结果表明,模型组各阶段大鼠与正常组相比,血浆 FINS、FPG明显升高且有统计意义(P <0.05),胰岛素抵抗指数与正常组相比均有显著差异(P<0.05),以六月份模型组大鼠胰岛素抵抗指数最高。HOMA-β反映胰岛β细胞功能,模型组大鼠HOMA-β以六月份出现代偿性增强后进行性衰退,提示β细胞数量减少和功能进行性下降。IPGTT试验结果见图1。
5 脂肪、肝脏和胰腺组织病理学观察
5.1 内脏脂肪组织
高糖高脂组脂肪细胞大小与正常对照组相比明显增大(图2),3~12月在逐渐增大,高糖高脂组自第6个月开始脂肪组织的结缔组织间已有炎性细胞浸润(彩插1图3-图4)。
5.2 肝脏
正常对照组大鼠肝脏组织结构正常(彩插1图5);3~12个月高糖高脂组肝细胞的脂肪变性、气球样变,以及肝小叶和汇管区炎细胞浸润程度逐渐加重;6~12个月高糖高脂组纤维组织增生逐渐加重,至第9个月出现假小叶,至第12个月纤维化进一步加重并且交织成网,假小叶使原肝脏组织改建,最终形成肝硬化(彩插1图6)。

表4 大鼠FBS、FINS、HOMA-IR、HOMA-β的变化Tab.4 Blood glucose,insulin,insulin resistance andβ-cell function of rats in each group
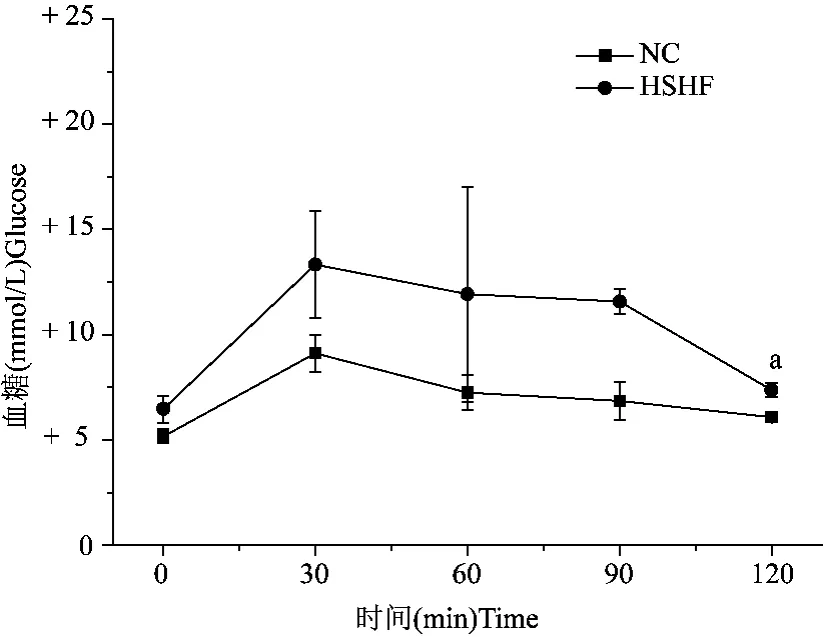
图1 血糖对IPGTT的影响Fig.1 FPGs impact on IPGTT
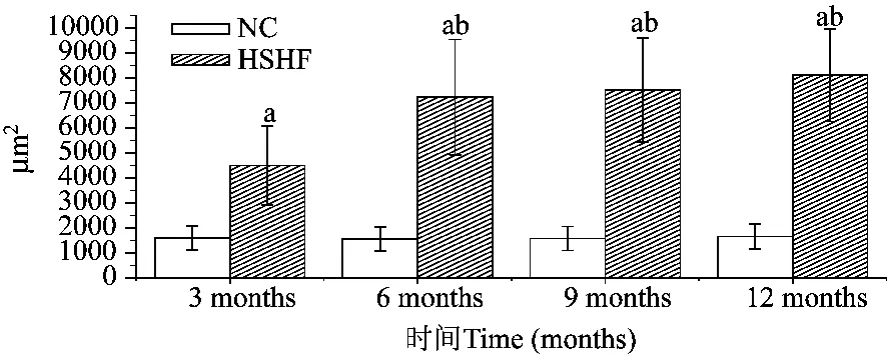
图2 脂肪细胞面积比较示意图Fig.2 Comparison of fat cell size diagram
通过苏丹Ⅳ染色可明显观察到各阶段肝脏TAG沉积情况(彩插1图7)。
5.3 胰腺
正常对照组大鼠胰腺组织结构正常(彩插1图8);3~6个月高糖高脂组胰岛体积逐渐增大,胰岛内血管充血乃至扩张;9~12个月胰岛周边炎细胞浸润逐渐显著,胰岛内脂肪沉积也较前加重,并且有一半胰岛体积明显缩小,发生萎缩(彩插1图9-图10)。
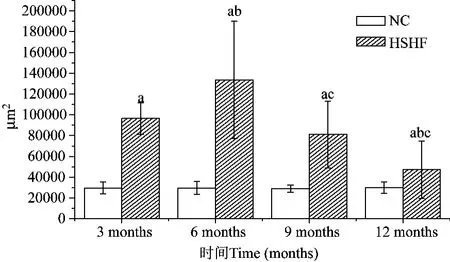
图10 胰岛面积比较示意图Fig.10 Comparison of islet area
苏丹Ⅳ染色显示第9月已有脂肪浸润。在第12月更加严重(彩插1图11)。
3 讨论
非酒精性脂肪性肝病与二型糖尿病都属于代谢综合征相关的疾病,二者之间有着千丝万缕的联系,但确切机制尚未阐明。因此,理想的动物模型对于研究人类MS相关疾病之间的关系至关重要。目前,用于非酒精性脂肪性肝病合并糖尿病研究的实验动物模型不多,国内外文献多用单纯高脂饮食或联合腹腔注射链尿佐菌素制备非酒精性脂肪性肝病及糖尿病动物模型[1,2],但是近年来,随着人们饮食习惯的改变,日常生活中人们在广泛食用肉类食物(高脂)的同时也大量食入着加入蔗糖的食品(如饮料、快餐等),所以采用高糖高脂膳食喂养大鼠,观察是否发生非酒精性脂肪性肝病及相关的二型糖尿病更符合人类的实际生活。
众所周知,肥胖是非酒精性脂肪性肝病及糖尿病重要的致病因素[3]。高糖高脂都可诱发动物肥胖。肥胖的个体脂肪细胞增大,肥大的脂肪细胞由于对脂质缓冲容量变小,使许多脂质(主要为FFA)随循环在非脂肪组织,如肝、胰等地蓄积。根据我们实验观察在实验第三个月开始已在肝内蓄积,使肝脏发生严重的脂变、脂肪肝进而发生肝炎、纤维化及肝硬化。到实验第9个月,由于肝脏对脂质(包括TAG、DAG、FFA等)已趋饱和,便随循环流向胰腺。脂质沉积在胰腺特别是胰岛β细胞可损害胰岛素的生物合成与分泌、以及凋亡的发生,促进T2DM的发生发展[4]。肥大的脂肪细胞还可使脂因子分泌异常,使TNFα、CRP等产生 IR的炎症因子产生过量,而抑制脂联素等使胰岛素敏感的细胞因子产生,进一步加重 IR[5]。另外,肥大的脂肪细胞由于血液灌注减少所以容易缺血坏死,坏死的脂肪细胞被巨噬细胞浸润,进一步引起脂因子分泌异常,从而加重IR。
据文献报道,NAFLD合并T2DM的患者,主要表现为糖耐量减低,空腹血糖升高,高胰岛素血症和高甘油三酯血症等特征。本实验中,在喂养高糖高脂饲料后,SD大鼠出现糖耐量减低、空腹高血糖高胰岛素血症高脂血症,与人类NAFLD合并T2DM具有相似的糖脂代谢紊乱,表明本研究诱发的NAFLD合并高血糖的模型是成功的。
非酒精性脂肪性肝病与二型糖尿病都属于MS相关的疾病,这一组疾病其本质是低度炎症性疾病[6,7],其共同的基本发病机制是胰岛素抵抗[8,9]。而糖脂毒在其中发挥着重要的作用。脂毒性(lipotoxicity)系指脂类(如TG、DAG、FFA、神经酰胺等)从脂肪组织经血液向肝细胞、骨骼肌、胰岛β细胞等非脂肪细胞内转移,而非脂肪细胞内沉积的脂类极易通过非氧化代谢途径,致使细胞功能发生障碍或凋亡、坏死,产生脂中毒;葡萄糖毒性主要是指高血糖本身可以通过多种途径加剧脂毒的作用,如长期高糖血症使线粒体代谢增强,活性氧产生增多而引起的氧化应激可影响胰岛素的分泌和β细胞凋亡。由于两者常常协同发挥作用,常称之为糖脂毒[10]。我们通过实验证实高糖高脂饮食喂养大鼠血浆LPS水平明显升高,炎性介质TNFα显著增高并且一直保持高水平,表明模型组大鼠存在慢性低度炎症反应。同时,本实验结果模型组大鼠在造模3个月时血糖、血胰岛素水平升高,胰岛素抵抗指数明显增加并且始终保持高水平,β细胞分泌指数在实验第六个月出现代偿性升高后进行性降低,提示大鼠在实验第三个月出现合并代谢改变的慢性低度炎症状态,预示早期糖尿病的发生,后期病理观察胰岛萎缩,胰岛细胞数量减少导致分泌功能进行性下降最终衰竭走向显性T2DM。
综上所述,用高糖高脂饲料喂养的NAFLD合并高血糖的动物模型,虽然耗时较长,但具有与人类疾病相似的发病过程、临床特点,为 NAFLD与T2DM相互关系的研究提供依据。
[1]潘勤,范建高.高脂饮食诱导非酒精性脂肪性肝病动物模型的研究进展[J].国际消化病杂志,2009,29(4):255-257.
[2]胡爱民,肖凤英,郑云.2型糖尿病并脂肪肝实验性大鼠模型的建立及评价[J].中国中西医结合消化杂志,2006,14(3): 156-159.
[3]Goossens GH.The role of adipose tissue dysfunction in the pathogenesis of obesity-related insulin resistance[J].Physiol Behav,2008,94(2):206-218.
[4]van Herden NA and Schrauwen-Hinderling VB.Lipid accumulation in non-adipose tissue and lipotoxicity.Physiology and Behavior[J].2008,94(2):231-241.
[5]DeFronzo RA.Dysfunctional fat cells,lipotoxicity and type 2 diabetes.Int JClin Pract Suppl[J],2004(143):9-21.
[6]Alison LH,Nancy FS,Steven JC,et al.Elevated endotoxin levels in non-alcoholic fattyliver disease.Journal of Inflammation[J].2010,7(15):1-10.
[7]Nehal NM,Fiona CM,Paul da.Experimental Endotoxemia Induces Adipose Inflammation and Insulin Resistance in Humans.Diabetes[J],2010,59(1):172-181.
[8]Reaven GM.Role of insulin resistance in human disease.Diabetes 1988,37(12):1595-1607.
[9]Gianfranco P,Giovanni P,Giovanni M,et al.Nonalcoholic steatohepatitis,insulin resistance,and metabolic syndrome:further evidence for an etiologic association.Hepatology[J].2002,35 (2):367-371.[10]Robertson RP,Harmon J,Tran PO,et al.Glucose toxicity in
beta cells:type 2 diabetes,good radicals gone bad,and the glutathione connection[J].Diabetes,2003,52(3):581-587.
