9种杀菌剂对芸薹生链格孢菌毒力的测定
2011-01-31杨冠美郑永利吴华新吴降星章初龙林福呈
杨冠美,郑永利,吴华新,吴降星,章初龙,林福呈
(1.浙江大学 生物技术研究所,浙江 杭州 310029;2.浙江省植物保护检疫局,浙江 杭州 310020;3.慈溪市农业监测中心,浙江 慈溪 315300;4.宁波市农业环境与农产品质量监督管理总站,浙江 宁波 315012)
9种杀菌剂对芸薹生链格孢菌毒力的测定
杨冠美1,郑永利2,吴华新3,吴降星4,章初龙1,林福呈1
(1.浙江大学 生物技术研究所,浙江 杭州 310029;2.浙江省植物保护检疫局,浙江 杭州 310020;3.慈溪市农业监测中心,浙江 慈溪 315300;4.宁波市农业环境与农产品质量监督管理总站,浙江 宁波 315012)
对从西兰花花球上分离的1株菌株进行电镜的初步观察,经过形态学和分子生物学的鉴定认为该菌株为芸薹生链格孢 (Alternaria brassicicola);采用菌丝生长速率法研究了9种杀菌剂对芸薹生链格孢菌丝生长的抑制作用,通过毒力方程计算出EC50依次为凯泽 (0.326 35 μg·mL-1) <氟菌唑 (0.548 36 μg·mL-1) <翠泽 (0.577 29 μg·mL-1) < 好力克 (1.183 43 μg·mL-1) < 凯润 (4.639 82 μg·mL-1) < 世高 (8.627 8 μg·mL-1) < 百泰 (18.372 88 μg·mL-1) < 达科宁 (794.480 6 μg·mL-1) < 翠贝 (872.017 4 μg·mL-1),其中凯泽毒力最强,氟菌唑和翠泽对芸薹生链格孢也有较强的抑制作用。
芸薹生链格孢;杀菌剂;毒力测定;EC50
由于链格孢 (特别是小孢子种)来自寄主和来自培养基上的分生孢子,形态具有较大差异,特别易受培养条件的影响,而且产孢表型存在一些中间类型,种间差异并不显著,用常规的方法很难进行种级分类鉴定,因此分子生物学的方法(RAPD、RFLP、AFLP、序列分析等)越来越多的应用到链格孢的系统研究中[1-3]。
链格孢属中芸薹链格孢 (Alternaria brassicae),芸薹生链格孢 (Alternariabrassicicola)和萝卜链格孢 (Alternaria japonica)是引起十字花科蔬菜黑斑病的常见种类,通过芸薹属和萝卜属蔬菜的种子及杂草和植株病残体等途径传播危害十字花科蔬菜[4]。西兰花为十字花科芸苔属甘蓝种的变种,是富含营养,人们喜食的蔬菜之一,被誉为“蔬菜皇冠”[5],本文从浙江省慈溪市天元镇西兰花花球上分离到一株链格孢属菌株,应用分子生物学(ITS)的鉴定方法,确定该菌株为芸薹生链格孢,并进行了室内药效测定,以期为该菌株可能导致西兰花病害的防治研究提供依据。
1 材料与方法
1.1 菌株的分离与保存
将采集的浙江省慈溪市天元镇西兰花花球标本,进行菌株的分离,具体分离方法参照文献进行[6],分离时取约 5 mm×3 mm组织块,先在70%乙醇中浸泡10 s,再置于0.5%次氯酸钠中浸泡1 min,无菌水漂洗3次后,种植在 PDA平板上,然后放在25℃恒温培养箱中培养,待分离组织长出菌丝后,取菌落边缘菌丝再转置PDA上培养,直至获得纯培养分离物,将纯菌种培养7 d后密封保存在石蜡中以备用。
1.2 菌株形态鉴定
对菌株的形态进行观察,包括菌丝、分生孢子、分生孢子梗及喙的形态,结合相关资料进行种的鉴定[7],在光学显微镜下拍照,记录菌株重要形态特征。
1.3 ITS序列扩增
待菌株长满培养皿后,刮取菌丝,用基因组小量提取试剂盒提取基因组DNA,总DNA直接用于PCR扩增,根据肖长坤等[8]对引起十字花科黑斑病的3个链格孢属真菌中芸薹生链格孢的特异性引物对分离的菌株进行 PCR扩增,特异性引物为:引物Abral(5'-ACCTCAGCAGCATCTGCTGTTG-3')和Abra2(5'-GGCTTTATGGATGCTGACCTTG-3'),PCR 反应 体系 (50 μL):10 × PCR Buffer 5 μL,dNTPs 0.4 μL,DNA 模 板 2 μL,引 物 0.5 μL,Taq 酶 1 μL,ddH2O 40.6 μL。
PCR反应循环参数为:预变性94℃,5 min;变性94℃,40 s;退火62℃,40 s;延伸72℃,60 s;35个反应循环;最后延伸72℃,10 min。PCR产物在1.0% 的琼脂糖上凝胶电泳,溴化乙锭染色,凝胶成像仪下拍照。用PCR产物纯化试剂盒 (axygen incorporation,China) 胶回收纯化后,以与PCR扩增相同的引物用ABI 3730测序仪(applied biosystems,USA)测序。
1.4 药剂室内筛选与毒力测定
1.4.1 供试药剂
9供试药剂种类及有效成分见表1。
1.4.2 毒力测定
采用平皿菌丝生长速率法测定供试药剂对菌丝生长的抑制活性,即在预试验的基础上,配置各药剂对菌株菌丝生长抑制率在10%~90%范围内的几个不同浓度[9](表2)。然后将不同浓度的药剂与PDA混合,倒入6 cm的培养皿中制成系列浓度的含药平板,实验用等量无菌水做空白对照,每个处理3次重复。
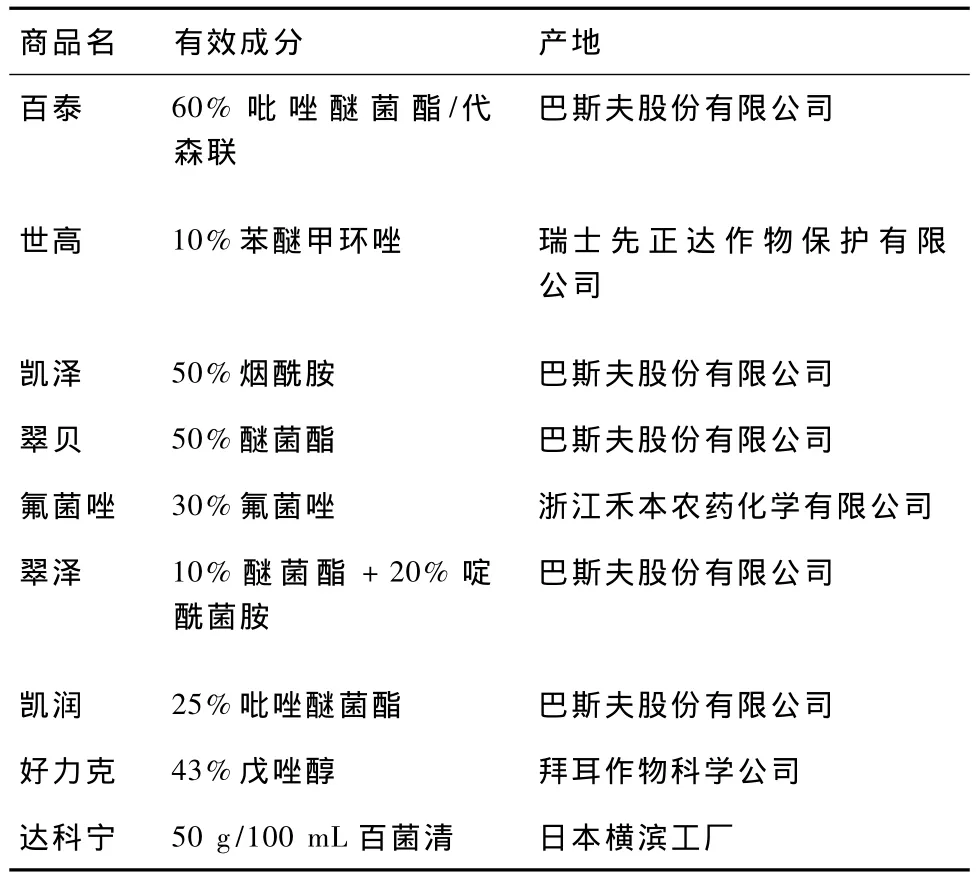
表1 供试药剂名称及有效成分
将在PDA上培养7 d的菌株,用5 cm无菌打孔器打取菌饼,菌丝面朝下接种到含药培养基平板中央,倒置放在25℃恒温培养箱中培养。7 d后,用十字交叉法测量各个培养皿内菌落直径,并求出3次重复的平均值。
采用生长速率抑制法,计算相对抑菌率[10]。计算公式如下:抑菌率 (%) = (对照菌落直径-处理菌落直径) ÷对照菌落直径×100%。应用DPS软件进行统计分析,求出各药剂的毒力回归方程及相关系数r和有效中浓度EC50。
2 结果与分析
2.1 菌株的鉴定
2.1.1 形态学特征
显微镜观察结果为:散落很多分生孢子,有横隔和纵隔,长链状。分离的菌株在PDA上培养形状为:菌落初期为灰白色,短绒状,边缘整齐,菌落圆形,后期逐渐转为褐色至灰黑色;分生孢子深褐色,广卵圆,卵形,近椭圆形或倒棍棒形,纵隔膜相对较少,0~4个,横隔处缢缩明显,3~7个横膈,无喙或形成短的假喙 (图1),初步鉴定该菌为芸薹生链格孢[7,11-12]。
2.1.2 ITS的PCR扩增序列分析
对分离的菌株用芸薹生链格孢的特异性引物扩增出了400~500 bp左右的目标条带 (图2),将测得的序列提交 GenBank进行 BLAST比对,GenBank登录号为 HM138205。结果表明,所测序列与芸薹生链格孢标准菌株 CBS125088(GQ496082)同源性达99%。因此形态学和分子 生物学方法都证明该菌为芸薹生链格孢。
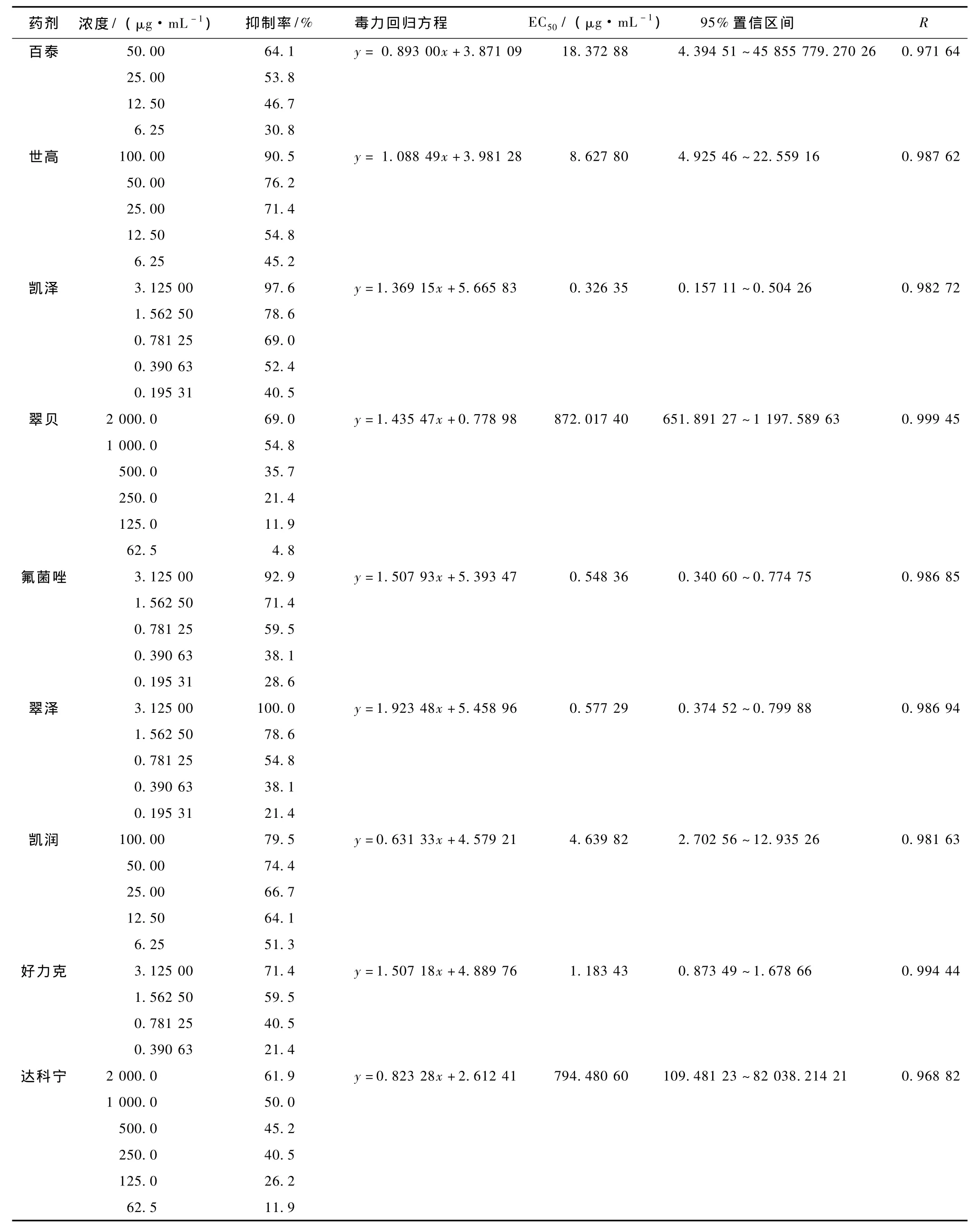
表2 9种杀菌剂对芸薹生链格孢的毒力
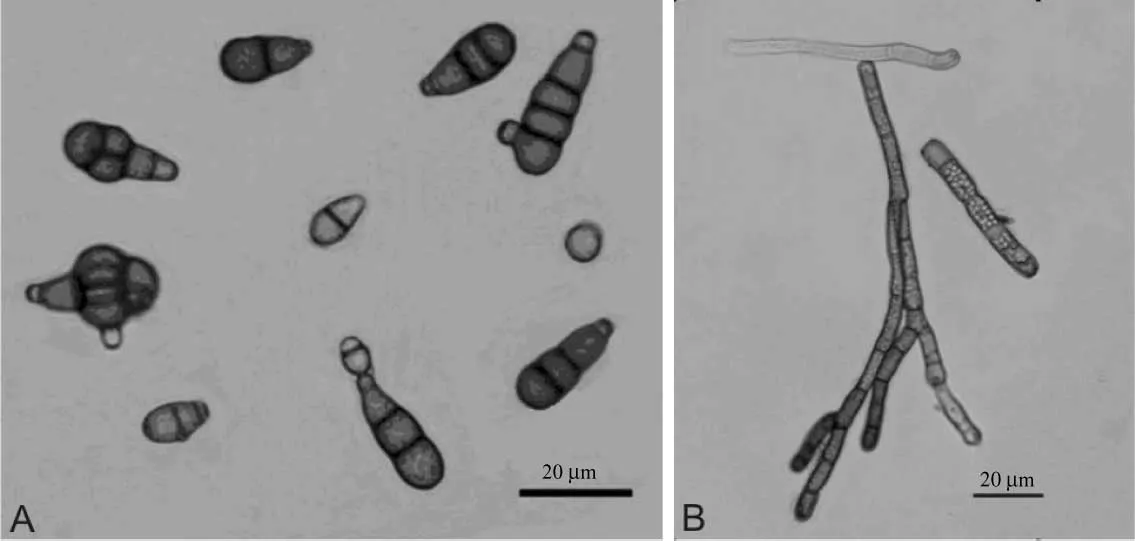
图1 菌株的分生孢子 (左)和菌丝 (右)
2.2 毒力测定分析
9种药剂对芸薹生链格孢的毒力测定结果见表2。
测定结果表明,9种药剂对芸薹生链格孢菌丝生长抑制作用有明显的差异,凯泽对所分离的芸薹生链格孢菌的毒力最高,抑制浓度在3.125 μg·mL-1时, 抑 制 率 达 97.6%,EC50仅 为0.326 35 μg·mL-1,其次为氟菌唑、翠泽、好力克,它们的EC50均极显著低于其他4种供试药剂,其中翠贝、达科宁抑制效果最差。
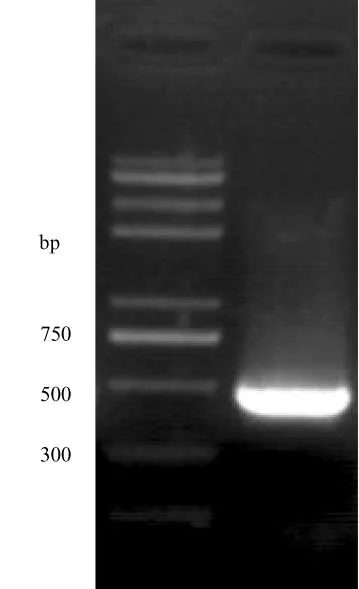
图2 PCR扩增结果
3 小结和讨论
本试验对采自浙江省慈溪市天元镇的西兰花花球分离的菌株进行了分离纯化和显微镜形态特征的观察,根据分生孢子的形态如有无横隔和纵隔、喙的形态,产孢梗的延伸方式,初步鉴定为芸薹生链格孢[7,11-12],根据肖长坤等人对引起十字花科黑斑病的的3个链格孢属真菌中芸薹生链格孢的特异性引物对分离的致病菌进行PCR扩增[4],ITS序列(GenBank登录号为 HM138205)BLAST比对结果与芸薹生链格孢CBS 125088(GQ496082)同源性达99%,进一步证明该菌为芸薹生链格孢。李明远曾报道引起南方十字花科蔬菜黑斑病的主要病原菌为芸薹链格孢,而引起北方十字花科蔬菜病原菌除了芸薹链格孢外还有芸薹生链格孢[13],本实验采集的西兰花在冬季12月份,雨水较多低温条件可能为芸薹生链格孢在南方引起黑斑病发生提供了条件,对于芸薹生链格孢的生长习性以后将做进一步的研究。本实验对9种杀菌药剂进行了毒力测定,含有效成分为50%烟酰胺的药剂凯泽对芸薹生链格孢菌的毒力最强,可作为防治该菌株引起病害病的首选药剂,其次氟菌唑、翠泽、好力克对其也有较好的药效,对这4种药剂在田间的防治效果将做进一步的研究。
[1] 王洪凯,张天字,张猛.应用5.8S rDNA及ITS区序列分析研究链格孢种级分类 [J].菌物系统,2001,20:168-173.
[2] Bock C H,Thrall P H,Burdon J J.Genetic structure of populations of Alternaria brassicicola suggests the occurrence of sexual recombination [J].Mycol Res,2005,109(2):227-236.
[3] Pryor B M, Gilbertson R L. Molecular phylogenetic relationships amongst Alternaria species and related fungi based upon analysis of nuclear ITS and mt SSU rDNA sequences [J].Mycological Research,2000,104(11):1312-1321.
[4] 肖长坤,李通,李健强.十字花科蔬菜种传黑斑病研究进展 [J].中国农业大学学报,2003,8(5):61-68.
[5] 王春明,金秀琳,何苏琴.花椰菜黑斑病病原鉴定及6种杀菌剂的室内药效测定 [J].甘肃农业科技,2009(1):17-19.
[6] 方中达.植病研究方法[M].3版.北京:农业出版社,1998:122-145.
[7] 张天宇.中国真菌志—链格孢属 [M].北京:科学出版社,2003:1-281.
[8] 肖长坤,李健强,师迎春,等.十字花科蔬菜黑斑病菌的PCR鉴定 [J].植物病理学报,2005,35(3):278-282.
[9] 严清平,袁善奎,王晓军,等.5种链格孢属植物病原真菌对10种杀菌剂的敏感性比较 [J].植物保护,2008,34(2):124-127.
[10] 孙广宇,宗兆锋.植物病理学实验技术 [M].北京:中国农业出版社,2002:94-106,139-146.
[11] 张敬泽,张天宇,王谨.链格孢属种间培养性状的分类研究 [J].浙江农业大学学报,1997,23(5):511-514.
[12] 孙霞.链格孢属真菌现代分类方法研究 [D].山东:山东农业大学,2006.
[13] 李明远.自病斑上直接挑取白菜黑斑病单孢菌系 [J].植物保护,1989,15(5):48.
S 489+.1
B
0528-9017(2011)03-0665-04
文献著录格式:杨冠美,郑永利,吴华新,等.9种杀菌剂对芸薹生链格孢菌毒力的测定 [J].浙江农业科学,2011(3):665-669.
2011-01-12
杨冠美 (1987-),女,江西上饶人,硕士研究生,从事内生真菌筛选与农药活性测定的研究工作。E-mail:yang87_20@yahoo.com.cn。
注:林福呈系通信作者,E-mail:fclin@zju.edu.cn。
(责任编辑:阮义理)
