板车消炎颗粒微生物限度检查法的验证
2011-01-29刘雅清
刘雅清
板车消炎颗粒微生物限度检查法的验证
刘雅清
目的 建立板车消炎颗粒的微生物限度检查法。方法 按《中国药典》2010年版的要求对细菌、霉菌及酵母菌计数方法和控制菌检查方法进行验证。结果 板车消炎颗粒可按常规法进行微生物限度检查。结论 药品的微生物限度检查法应进行验证,以保证结果的准确性。
微生物限度检查法;验证试验
板车消炎颗粒由板蓝根、车前草等中药制成,具有清热解毒功效,用于病毒性感冒、扁桃腺炎、流行性腮腺炎等。《中国药典》2010年版规定,建立药品的微生物限度检查法,应进行细菌、霉菌及酵母菌计数方法的验证和控制菌检查方法的验证,以确认所采用的方法适合于该药品的微生物限度检查。本文按《中国药典》2010年版的要求就板车消炎颗粒的微生物限度检查法进行验证试验。
1 仪器与试药
SW-CJ-1F净化工作台(苏州净化设备厂);电热恒温培养箱(上海跃进医疗器械厂);大肠埃希菌[CMCC(B)44102],金黄色葡萄球菌[CMCC(B)26003],枯草芽孢杆菌[CMCC(B)63501],白色念珠菌[CMCC(F)98001],黑曲霉[CMCC(F)98003](中国药品生物制品检定所);营养肉汤培养基,改良马丁培养基,改良马丁琼脂培养基,胆盐乳糖培养基,4-甲基伞形酮葡糖苷酸(MUG)培养基,营养琼脂培养基,玫瑰红钠琼脂培养基(北京三药科技开发公司);蛋白胨(广东光华化学厂有限公司);氯化钠(广东台山市新宁制药厂);磷酸氢二钠(广州化学试剂厂);磷酸二氢钾(广东台山粤侨试剂塑料有限公司);聚山梨酯 80(北京市海淀会友精细化工厂);板车消炎颗粒(本院制剂室,批号:20101018,规格:每袋 10 g)。
对细菌、霉菌及酵母菌计数用的培养基和控制菌检查用的培养基进行了适用性检查,均符合规定。
2 方法与结果
2.1 供试液制备 取本品 10g,加 pH7.0无菌氯化钠 -蛋白胨缓冲液至 100ml,振摇,制成 1:10供试液。
2.2 菌液制备 接种大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌的新鲜培养物至营养肉汤培养基中,30℃~35℃培养24h,用 0.9%无菌氯化钠溶液稀释成每 1ml含菌数为 50~100cfu的菌悬液。接种白色念珠菌的新鲜培养物至改良马丁培养基中,20℃~25℃培养 48h,用 0.9%无菌氯化钠溶液稀释成每 1ml含菌数为 50~100cfu的菌悬液。接种黑曲霉的新鲜培养物至改良马丁琼脂斜面培养基中,培养 7d,加入5ml含 0.05%聚山梨酯 80的0.9%无菌氯化钠溶液,将孢子洗脱,吸出孢子悬液至无菌试管内,用含 0.05%聚山梨酯 80的 0.9%无菌氯化钠溶液稀释成每 1ml含孢子数为 50~100 cfu的孢子悬液。
2.3 细菌、霉菌及酵母菌计数方法的验证
2.3.1 试验组 取供试液 1ml,加入到 1个平皿中,平行制备 10个平皿,分别加入已制备好的金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌、白色念珠菌、黑曲霉菌的菌悬液 1ml(含 50~100cfu),每种菌平行制备 2个平皿,含金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌的平皿倾注营养琼脂培养基,置 30℃~35℃培养 3d,计数;含白色念珠菌、黑曲霉的平皿倾注玫瑰红钠琼脂培养基,置 23℃~28℃培养 5d,计数。
2.3.2 菌液组 分别取已制备好的金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌、白色念珠菌、黑曲霉菌的菌悬液 1ml(含 50~100cfu),加入到 1个平皿中,各制备 2个平皿。培养基、培养时间、温度、计数同 2.3.1。
2.3.3 供试品对照组 取供试液 1ml,加入到平皿中,平行制备 4个平皿。2个平皿倾注营养琼脂培养基,另 2个平皿倾注玫瑰红钠琼脂培养基。培养时间、温度、计数同 2.3.1。
2.3.4 稀释剂对照组 取pH7.0无菌氯化钠-蛋白胨缓冲液1ml,加入到 1个平皿中,平行制备 10个平皿,分别加入已制备好金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌、白色念珠菌、黑曲霉菌的菌悬液 1ml(含 50~100cfu),每种菌平行制备 2个平皿。培养基、培养时间、温度、计数同 2.3.1。
各试验菌分别进行 3次独立的平行试验,计算每次试验的回收率。稀释剂对照组的菌回收率(稀释剂对照组的平均菌落数占菌液组的平均菌落数的百分数)和试验组的菌回收率(试验组的平均菌落数减去供试品对照组的平均菌落数的值占菌液组的平均菌落数的百分数)均应不低于 70%。结果见表 1。
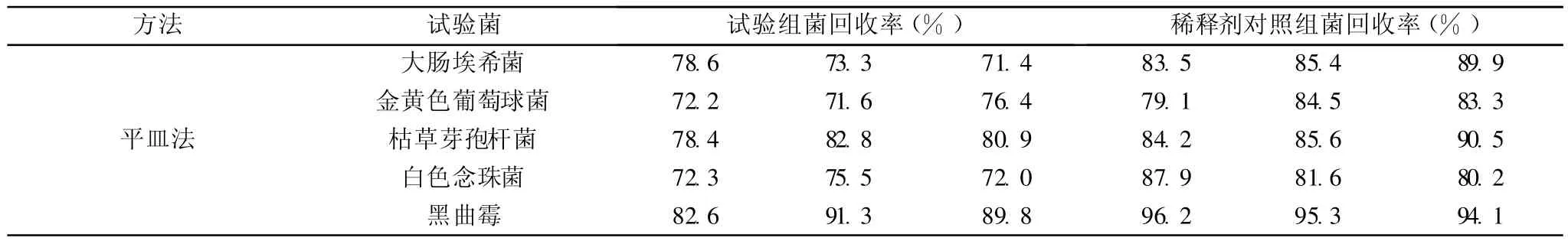
表 1 细菌、霉菌及酵母菌计数方法验证结果
表 1的结果显示 5株试验菌株的回收率都高于 70%,且3次试验回收率均可重现,因此细菌数、霉菌及酵母菌数检查可用常规法。
2.4 控制菌检查方法的验证 取供试液 10ml及 1ml已制备好的大肠埃希菌菌液(含 50~100cfu)加入 100ml胆盐乳糖培养基中,置于 30℃ ~35℃培养 18~24h,按大肠埃希菌微生物限度检查法进行检查[1]。共进行 3次独立的平行试验,结果见表 2。
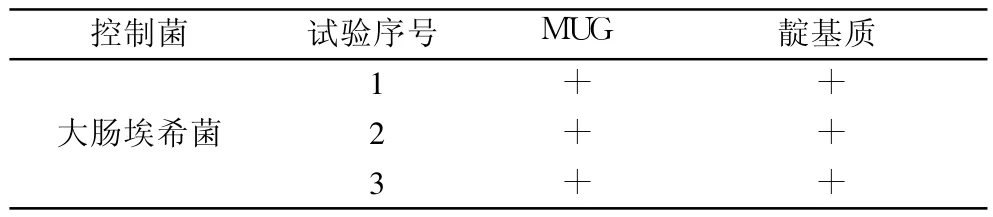
表 2 控制菌检查法验证结果
表 2的结果显示板车消炎颗粒对其控制菌大肠埃希菌没有抑制作用,可按常规方法进行大肠埃希菌的检查。
3 讨论
板车消炎颗粒微生物限度检查的验证试验显示其可按常规法进行检查。
《中国药典》从 2005年版起增加了微生物限度检查方法验证试验的要求,本文按《中国药典》2010年版的规定进行验证。微生物试验的结果易受试验条件的影响,在进行微生物限度检查时,应保证在检验条件下的药品浓度不足以抑制污染微生物的生长,因此任何药品的微生物限度检查法均需验证,确认所采用的方法适合于该药品的微生物限度检查[2]。
[1] 国家药典委员会.中国药典 2010年版一部,2010:83-84.
[2] 许华玉,杜芸,钱文静,等.药品微生物限度检查法中细菌和真菌计数方法的验证试验.中国中药杂志,2005,30(24):1918.
510180广州市第一人民医院
