盐酸巴尼地平β-环糊精包合物的制备
2011-01-29李艳
李艳
(华中科技大学同济医学院附属同济医院药学部,武汉 430030)
高血压用药的研制一直是新药开发的重点和热点,钙离子阻滞药是公认的重要一线抗高血压药,其中二氢吡啶类钙拮抗剂因其降压疗效和降压幅度相对较强,而疗效个体差异较小,近年来得到快速发展。盐酸巴尼地平(barnidipine hydrochloride,BN)是新型长效二氢吡啶类钙离子拮抗剂,由于该药水溶性差,脂溶性强,首关效应较明显,口服生物利用度低,从而大大影响了疗效[1]。目前市场上剂型比较单一,只有胶囊和片剂,因此开发新型药物给药系统是研究的关键。环糊精包合技术在药剂学中应用日益广泛,能增加难溶性药物的溶解度,笔者拟通过采用 β-环糊精(βcyclodextrin,β-CD)包合技术[2],对 BN-β-CD 包合物的制备工艺进行优化,确定最佳制备工艺条件,并对制得的包合物进行鉴定和溶出度测定。
1 仪器与试药
1.1 仪器 DF-101T型集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司),SHZ-E-14小型循环水式真空泵(巩义市予华仪器有限责任公司),UV-754型紫外可见分光光度计(上海分析仪器厂),Diamond DSC(美国 Perkin Elmer公司),VERTEX70傅立叶变换显微红外/拉曼光谱仪(德国Bruker公司),RC806型智能药物溶出仪(北京中西泰安技术服务有限公司)。
1.2 试药 盐酸巴尼地平原料药(含量99.86%,武汉福鑫化工有限公司,批号:20100806),β-CD(含量99.58%,武汉远河化工股份有限公司,批号:20100612),甲醇(色谱纯,天津市科密欧化学试剂有限公司),其他试剂均为分析纯。
2 方法与结果
2.1 包合物药物含量的测定
2.1.1 测定波长的选择 精密称取盐酸巴尼地平对照品适量,加入10%甲醇水溶液,配制成一定浓度的盐酸巴尼地平溶液,在200~400 nm波长范围进行扫描,结果表明盐酸巴尼地平在355 nm处有强吸收峰,辅料β-CD在此波长无吸收。因此确定355 nm为测定波长。
2.1.2 标准曲线的绘制 精密称取盐酸巴尼地平对照品5 mg,置于50 mL的棕色量瓶中,加入甲醇5 mL使之完全溶解后,纯化水定容,即得盐酸巴尼地平贮备液。分别精密吸取贮备液 0.2,1.0,2.0,3.0,4.0,5.0 mL,置于10 mL棕色量瓶中,加水定容至刻度,盐酸巴尼地平浓度分别为 2.0,10.0,20.0,30.0,40.0,50.0 μg·mL-1的 水溶液。以纯化水作空白对照,在波长355 nm处测其吸光度(A),以浓度(C)对A做线性回归,得标准曲线方程为 A=0.013 2C+0.015,r=0.999 9。表明盐酸巴尼地平在 2.0 ~ 50.0 μg·mL-1范围内线性关系良好。
2.1.3 回收率实验 分别称取处方量的盐酸巴尼地平和β-CD,溶解在混合溶剂(10%甲醇)中,得低、中、高 3 个浓度(2.00,25.00,48.00 μg·mL-1)的盐酸巴尼地平溶液,每个浓度平行3份,按“标准曲线的绘制”项下方法测定,求得浓度与实际浓度相比得到相对回收率。低、中、高浓度的回收率分别为99.3%,101.8% 和 100.5%,RSD 分别为 0.08%,0.12% 和0.15%(n=5)。
2.1.4 精密度实验 分别配制低、中、高三个浓度(2.00,25.00,48.00 μg·mL-1)的盐酸巴尼地平溶液,分别测定日内及日间精密度。测得日内精密度RSD分别为1.51%,0.96% 和 0.88%(n=5),日间精密度RSD 分别为 1.78%,1.02%和 0.81%(n=5)。
2.2 载药量和包合率的测定 精密称量制备的包合物冻干粉(约50 mg)置于25 mL的量瓶中,用纯化水溶解并稀释至刻度,摇匀。取上述溶液5 mL,0.22μm微孔滤膜过滤,精密吸取续滤液,用纯化水稀释一定倍数,作为供试品溶液。以含处方量的辅料溶液为空白,按“标准曲线的绘制”项下方法测定,代入标准曲线计算盐酸巴尼地平的含量(W包)。包合物的包合率和载药量按照下列公式计算:包合率(%)=W包/W投×100%,载药量(%)=W包/W总×100%,W总表示称量的包合物质量,W投表示盐酸巴尼地平的投入量。
2.3 包合物的制备 根据相关文献[3-7],采用饱和水溶液法制备BN-β-CD包合物。步骤如下:精密称取适量β-CD加纯化水置于烧杯中,加热溶解,制成饱和溶液。将盐酸巴尼地平缓慢加入饱和的β-CD溶液中,恒温搅拌一定时间后,取出,置冰箱中冷藏24 h,抽滤分离包合物,置真空干燥器中干燥24 h,即得BN-β-CD包合物。
2.4 正交实验设计 根据前期预实验结果,影响BN-β-CD包合物制备的主要因素有:盐酸巴尼地平与β-CD的投料摩尔比(A),搅拌速度(B)、包合温度(C)和包合时间(D)。按照L9(34)正交实验设计方案,对载药量和包合率加权综合评分,赋予包合物载药量的权重因子为0.7,包合率为0.3进行综合评分计算。将包合物载药量中最大值(18.31)设定为100,包合率中最大值(80.81)设定为100,计算公式为:Y=(Y1+100-18.02619)×0.7+(Y2+100-81.34055)×0.3。因素水平表结果见表1,正交实验结果见表2。
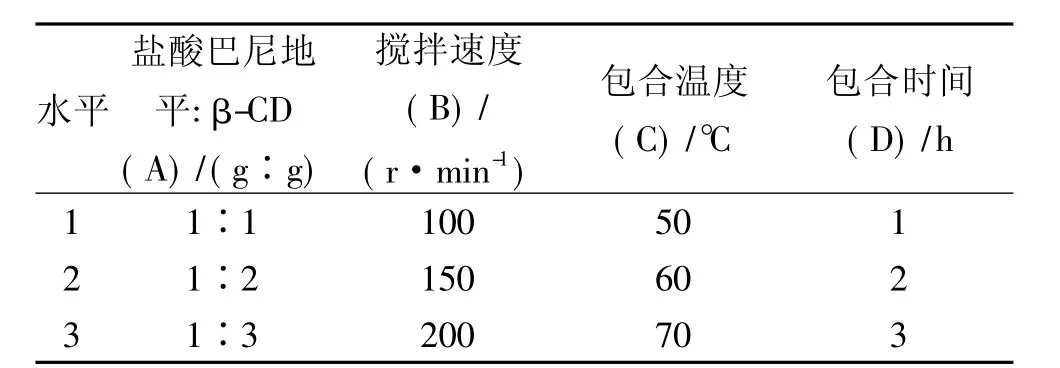
表1 正交实验因素水平表Tab.1 Factors and levels of orthogonal experiment

表2 正交实验结果Tab.2 Results of orthogonal experiment
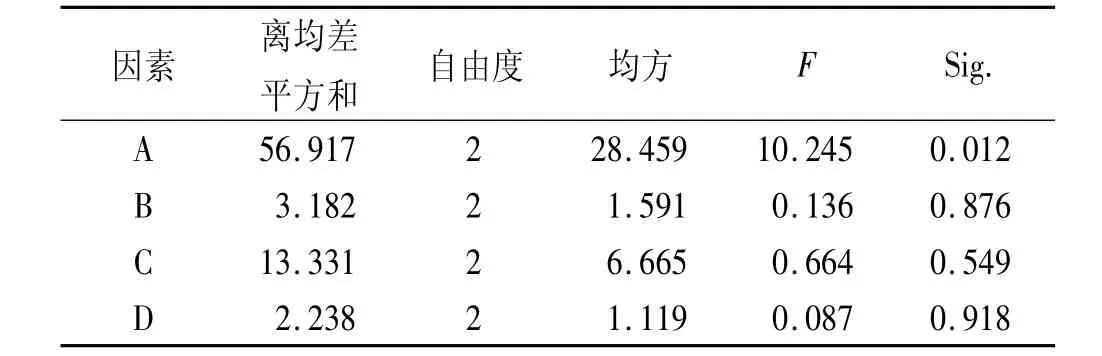
表3 方差分析结果Tab.3 Results of ANOVA
由正交实验表结果可知,A、C为主要影响因素,最佳制备工艺为A2B3C3D2,即盐酸巴尼地平与β-CD的投料摩尔比为1:2,搅拌速度为200 r·min-1,包合温度为70℃,包合时间为2 h。由方差分析结果可知,因素A(主客分子投料摩尔比)对包合物的载药量和包合率有显著性影响(P<0.05)。
2.4 验证性实验 根据最佳工艺处方,采用饱和水溶液法制备BN-β-CD包合物样品3批,依法测定包合物的包合率和载药量,考察制备工艺的重现性。3批样品的平均包合率80.57%,RSD=0.92%;平均载药量为17.66%,RSD=0.67%,结果表明该制备工艺重现性好,稳定可行。
2.5 包合物的确证
2.5.1 红外光谱测定 采用溴化钾压片法,对BN原料药、β-CD,BN-β-CD 包合物、BN 和 β-CD 的物理混合物分别进行红外光谱测定。由光谱图可知,BN物理混合物的图谱基本为BN与β-CD两组份图谱的叠加,在1 696 cm-1有强羰基吸收峰,而在BN-β-CD包合物的图谱中,1 696 cm-1处的羰基峰完全消失,说明BN分子已经被包埋于β-CD的空腔内,形成新的物相。
2.5.2 差示扫描量热法(differential scanning calorimetry,DSC) 将 β-CD、BN 原料药、BN-β-CD 包合物及物理混合物置于空铝坩埚样品池中进行扫描,结果BN约235出现一个尖锐的熔融峰,在物理混合物的DSC图谱中,该峰仍然存在,而在BN-β-CD包合物的DSC图谱中,该峰消失,与药物的图谱有明显的差异,说明β-CD已经包合药物。
2.5.3 溶出度的测定 精密称取一定量的BN以及相应含药量的物理混合物、BN-β-CD包合物各3份,根据《中华人民共和国药典》2010年版二部附录溶出度浆法测定溶出度,分别考察了水、0.1 ol·L-1盐酸和pH 6.8的磷酸盐缓冲液的 BN-β-CD包合物溶出情况,结果表明:BN-β-CD 包合物在水中和0.1 ol·L-1盐酸中溶出较好,溶出结果相似,笔者在本研究选择最常用的纯化水作为溶出介质。测定条件为:溶出介质为经脱气处理的纯化水 900mL,调节转速为100 r·min-1,水温恒定在(37.0±0.5)℃,于 5,10,15,20,30,45,60,90,120,180 min 取样 5 mL,经 0.22μm微孔滤膜过滤后,弃去初虑液,取续滤液做为供试品,在自取样至滤过均须在30 s内完成,同时立即补加同温等量的溶出介质5 mL。样液于分光光度计测定A值,代入标准曲线计算浓度,累积溶出百分率(%)=(已溶出的 BN的量/样品中药物的实际含量)×100%。实验结果表明,药物BN在180 min内仅溶出15.56%,BN与β-CD物理混合物在水中的溶出度为32.60%,该结果表明β-CD对药物BN具有一定的增溶作用。而包合物在15 min能溶出98.52%,溶出速率得到显著提高。
3 讨论
笔者在本研究利用正交实验设计,采用饱和水溶液法优化盐酸巴尼地平β-CD包合物的制备工艺,得出最佳工艺条件为:即盐酸巴尼地平与β-CD的投料摩尔比为1∶2,搅拌速度为200 r·min-1,包合温度为70℃,包合时间为2 h。同时对包合物物相进行了鉴定,红外光图谱证实在包合物的形成的过程中,β-CD与盐酸巴尼地平发生了作用,形成了新的物相。同时,示差扫描量热法也验证β-CD包合了药物盐酸巴尼地平。为了进一步考察盐酸巴尼地平经β-CD包合后,对盐酸巴尼地平溶出行为的影响。本研究平行测定原料药、包合物和物理混合物的溶出速率。结果表明,药物BN在180 min内仅溶出15.56%,物理混合物在水中的溶出度为32.60%,而包合物在15 min能溶出98.52%,结果表明β-CD对药物BN具有一定的增溶作用,而制备的包合物溶出速率显著提高。
目前,盐酸巴尼地平只有胶囊和片剂上市,剂型比较单一,国内有关盐酸巴尼地平新型给药系统开发报道也不多[8],笔者拟以提高盐酸巴尼地平的溶解度和溶出速率为目的,为盐酸巴尼地平新制剂的开发提供一定的思路和基础。
[1]LIAU C S.Barnidipine:a new calcium channel blocker for hypertension treatment[J].Expert Rev Cardiovasc Ther,2005,3(2):207-213.
[2]陆彬.药物新剂型与新技术[M].2版.北京:人民卫生出版社,1998:36-40.
[3]陈寅生,陈洪轩,马莉.吡罗昔康-β-环糊精包合物的制备研究[J].中国药业,2008,17(15):49-50.
[4]廖昌军,吴敏,尤思路,等.岩白菜素β-环糊精包合物的制备[J].医药导报,2010,29(10):1337-1339.
[5]管清香,林天慕,丁志英,等.尼群地平-β-环糊精包合物的制备[J].吉林大学学报:医学版,2005,31(5):811-813.
[6]李菲,郝吉福,王建筑,等.吲哚美辛-β-环糊精包合物制备工艺优化[J].医药导报,2010,29(3):350-352.
[7]张梨,谭群友,陈亮,等.溴吡斯的明-β-环糊精包合物的研制[J].中国医院药学杂志,2010,30(6):466-470.
[8]何艳,李高,吴笑春,等.星点设计-效应面法优化盐酸巴尼地平自微乳化释药系统[J].中国药师,2010,13(1):11-13.
