水稻蛋白OsOle对叶片表皮细胞形态的影响分析
2011-01-26姚清国段书德张文娜
姚清国,段书德,张文娜
(石家庄学院化工学院,河北 石家庄 050035)
在多细胞生物中,细胞与细胞之间的相互通讯是不可缺少的,细胞之间的相互识别对于细胞生长和分化起着决定的作用,其中植物胞外的信号分子在细胞之间的信息传递中扮演者重要的角色[1]。在植物学研究中,小分子激素如生长素、细胞分裂素、赤霉素、乙烯、ABA和油菜素类脂等一直是公认的信号分子,人们对其比较关注而且研究比较清楚。直到10年前,一篇评述性文章“Plants,like animals,may make use of peptide signals”在 Science上发表之后,人们才开始关注植物胞外蛋白作为细胞间信号分子的研究[2]。现在研究得比较清楚的胞外蛋白有 4 个,分别是系统素[3]、PSK[4]、CLV3[5]和SCR[6]。Olee 1是一种主要过敏原,该蛋白最早在橄榄树的花粉中发现并纯化,因此命名为Olee I[7]。Olee 1由145个氨基酸组成的,与已知的番茄花粉LAT52蛋白和玉米中的Zm13蛋白十分相似。Olee I的结构域中含有6个保守的半胱氨酸,一个保守的花粉表达的序列E/Q/T/-G-X-V-Y-C-D-T/N/P-C-R。在植物中存在一个与Olee 1同源的蛋白家族,称为Olee 1蛋白家族,有些Ole家族的蛋白还富含脯氨酸,蛋白分子量从8 kD到50 kD,具有可溶性和稳定性,会引起IgE调节的过敏反应[8]。水稻基因组中有45个Olee 1家族的蛋白[9],但它们的表达模式各不相同,推测可能参与不同的生物学过程,发挥不同的功能。笔者在水稻中找到一个与Olee 1同源并在授粉后RNA水平表达量明显上调的基因,并对其生物学功能进行了初步的研究。
1 材料与方法
1.1 材料
供试水稻品种为日本晴[Oryza sativa(japonica cultivar-group)];细菌菌株 DH5α、农杆菌 EHA105均为本实验室保存;载体 pTCK303、pCAMBIA 1300、pYFP、pGEX-2T 为本室保存。
1.2 方法
1.2.1 载体构建 载体构建所用的引物由生工公司或赛百盛公司合成,通过RT-PCR扩增出Os-Ole1连到pCAMBIA 1300上,构建成后面融合GUS的超表达载体并进行了测序;通过RT-PCR扩增出OsOle1连到pYFP上。forward primer(Pogf):5′-CC A AG CTT ATG GCC TCT CTC CGC ACC-3′,reverse primer(Pogr):5′-CGG GAT CCC CTC GTT ATC ATC ATC AGC CAG GAT-3′,构建成后面融合YFP的超表达载体。
1.2.2 水稻遗传转化和GUS染色 水稻遗传转化采用农杆菌介导水稻愈伤转化的方法,收集转基因水稻不同发育时期的组织,按照Jefferson的方法进行 GUS染色[10]。
1.2.3 激光共聚焦显微镜(LSCM)观察 将上述打过基因枪的洋葱表皮(仍在上述MS固体培养基的滤纸之上)放于22℃,连续光照条件下培养16 h,然后将洋葱表皮置于MS缓冲液(pH 7.0)中。在Bio-Rad MR(A2)型激光扫描共聚焦显微镜上进行观察。观察条件:以488 nm为激发光,强度为30%。同时打开软件对镜中的目标细胞扫图。再用质壁分离液(MS,0.15 mol/L的蔗糖,0.45 mol/L甘露醇)处理洋葱表皮细胞,直至发生质壁分离,同时进行观察拍照。
1.2.4 扫描电镜观察水稻叶片表皮细胞 扫描电镜采用日立S-570型,分辨率3.5 nm,放大倍数20~200 000倍,取水稻的叶片,用二蒸水冲洗干净,放入戊二醛(2.5%)中固定,采用梯度的方法进行脱水,依次放入30%、50%、70%、80%、90%、100%乙醇中,每次30 min。之后放入新的100%的乙醇过夜,第二天放入醋酸异戊脂30 min,放入预冷的干燥仪样品室,注入液态的CO2进行置换,保持室温20℃,压力 50~70 Kg/cm2,20 min,温度升到 40℃,压力 80~100 Kg/cm2,保持 5min,放气(速度在 100~500 mL)/min,当压力低于30 Kg/cm2时切断加热器,取出样品,真空喷金,然后放入扫描电镜中观察拍照。
2 结果与分析
2.1 OsOle1的生物信息学分析
橄榄树花粉中发现的过敏原蛋白Olee 1在植物中属于一个大的家族,在NCBI的水稻蛋白质数据库中以橄榄树Olee 1的氨基酸序列进行搜索,得到一个同源的蛋白(CAE05158.2),序列同一性为35%(45/128),相似性为 52%(67/128),蛋白对应的cDNA序列号为AL731591,该基因有一个内含子,因此命名为OsOle1,OsOle1共有165个氨基酸残基,N端1-24位氨基酸为预测的信号肽序列,肽链断裂位点在24位的Ala和25位Thr之间。
将OsOle1蛋白序列在NCBI的蛋白数据库中进行比对,得到75个相似度比较高(e<0.01)的蛋白序列。运用MEGA3.0对这些蛋白序列进行进化树分析(图1),发现OsOle1和水稻,百合和玉米中的同源蛋白蛋白分布在一个大的BII分支中分支中,该分支只有12个成员,全部为单子叶植物。拟南芥,番茄和橄榄树中与OsOle1同源的蛋白分布在另外的几个分支中,A,BI及CI、CII分支全部都是双子叶植物,共有64个蛋白。由此可见,Ole家族的蛋白在单子叶和双子叶植物进化中有明显的区别。
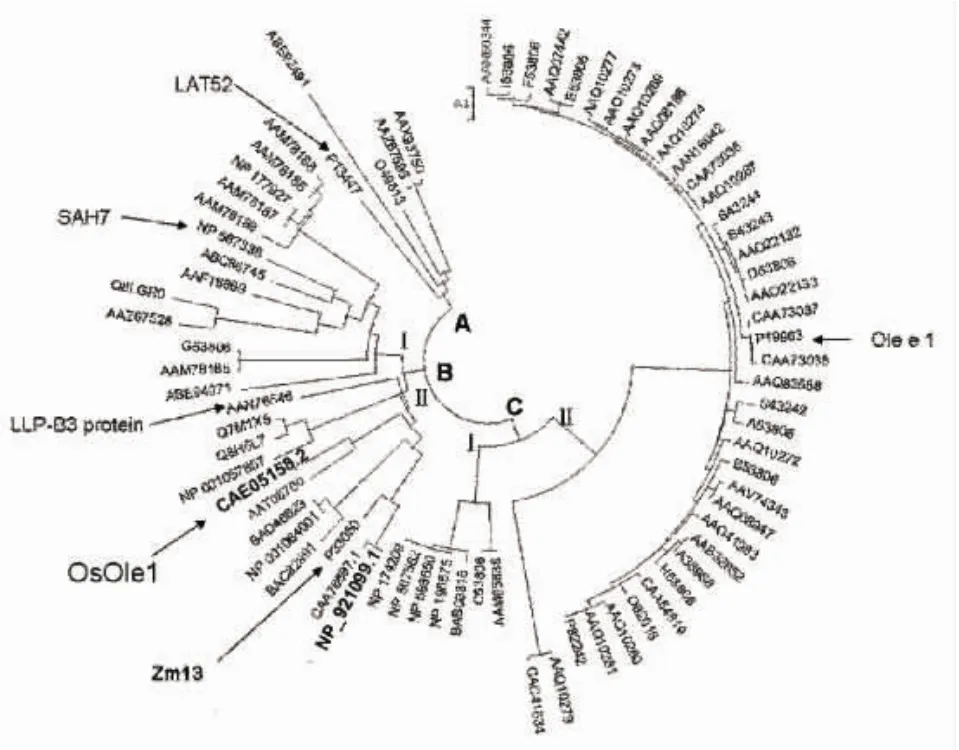
图1 Ole家族的进化树构建
该进化树中有功能注释的5个蛋白分别是:橄榄树中的Olee 1(P19963),拟南芥中的SAH7(NP567338),玉米中的Zm13(P33050),百合中LLP-B3(ANN76546),番茄中的 LAT52(P13347)。选取这五个蛋白与水稻中的OsOle1进行氨基酸序列比对分析,结果发现这些蛋白与花粉特异的Ole_e_I家族保守序列 [EQT]-G-x-V-Y-C-D-[TNP]-C R在相同的位置上都具有6个保守的半胱氨酸(图2)。进一步分析OsOle1的氨基酸序列发现该蛋白有推测的豆蔻酰化位点G-{EDRKHPFYW}-X(2)-[STAGCN]-{P},位于 N 端第 128 位,因此该蛋白容易被豆蔻酰化修饰锚定于质膜上。OsOle1在N端第33位具有花粉中特异表达的保守序列[EQT]-G-x-V-Y-C-D-[TNP]-C R。

图2 部分Ole e 1家族蛋白的保守序列比对分析
2.2 转基因水稻的表型观察
2.2.1 扫描电镜观察OsOle1超表达株系叶片在营养生长阶段,对OVY3的T0代的小苗叶片进行观察,和野生型叶片比较起来,OVY3株系叶片暗绿,推测叶片的表皮细胞可能发生改变,进一步对三叶期的OVY3的叶片作了扫描电镜的观察,结果如图3所示。对野生型和OVY3叶片的近轴面观察发现,野生型的叶片表皮细胞的细胞细长,细胞的边界比较平滑,形状规则。与野生型的相比,OVY3叶片近轴面表皮长细胞长度变短(图3中箭头所示),且形状发生改变,表皮细胞周围边界变的不规则。表皮的短细胞变化不大。推测可能是由于OsOle1的超表达影响叶片进轴面的长细胞发育。

对野生型和OVY3叶片远轴面观察发现,野生型远轴面表皮细胞的角质层突起比较平滑,细胞形状比较细长。与野生型相比,OVY3叶片表皮细胞的形状变的不规则,角质层突起比较粗燥(箭头表示),每个角质层突起边缘有许多小的突起(图4下排),这种角质突起主要有蜡质来组成。可能是Os-Ole1的超表达影响了叶片远轴面腊质层的形成。

3 讨 论
3.1 OsOle1与Olee 1在进化上的关系
在水稻基因组中有45个编码Olee 1家族蛋白的基因,其中只有一小部分在花粉中特异的表达,而大部分在其它营养组织也有表达,推测水稻中这些基因可能发挥与Olee 1不同的生物学功能。
OsOle1主要在花器官中表达,在进化上与玉米的Zm13和百合的LLP-B3蛋白等单子叶植物聚在BII分支中,而与双子叶的Olee 1家族的蛋白相距较远。在双子叶家族A亚家族中有一个番茄花粉中表达的LAT52蛋白,反义表达的LAT52影响花粉的水合和萌发。由于物种的不同,OsOle1、LAT52和Olee I在不同的进化分支中,三者之间有一定的距离,表明在双子叶和单子叶在进化上出现分支后,该家族的蛋白为适应不同类型花粉的信号转导方式而进化成不同的形式,在不同物种中可能发挥着不同的功能。结构分析发现,这些蛋白大都有保守的6个半胱氨酸的,两半胱氨酸之间可以形成二硫键,二硫键的形成有助于蛋白维持一定的空间构象,对其功能的发挥起重要作用。
3.2 OsOle1与叶表皮细胞发育的关系
在OsOle1的过表达植株中观察到野生型的颜色为浅绿色,而超表达的叶片暗绿色,近轴面和远轴面表皮细胞形状也变得不规则,而且远轴面表皮细胞的乳状突起的蜡质突起变得不规则,可能是OsOle1影响了表皮细胞的分化。蜡质层是在细胞内合成再分泌的胞外装配而成的,OsOle1很可能影响了蜡质层在胞外的装配过程。除此之外OsOle1的超表达还影响到花粉的萌发和植株的高度,后续的研究正在进行中。
[1]Julie E G,Stuart C,Lee H.Intercellular Peptide Signals Regulate Plant Meristematic Cell Fate Decisions[J].Science Signaling,2008,49(1):53-55.
[2]Marx J.Plants,like animals,may make use of peptide signals[J].Science ,1996,237(6):1338-1339.
[3]Beatrice B,Ian T B.Silencing the Hydroxyproline-Rich Glycopeptide Systemin Precursor in Two Accessions of Nicotiana attenuata Alters Flower Morphology and Rates of Self-Pollination[J].Plant Physiology,2009,149(4):1690-1700.
[4]Yang H P,Matsubayashi Y,Nakamura K.Oryza sativa PSK gene encodes a precursor of phytosulfokine-α,a sulfated peptide growth factor found in plants[J].Proc.Natl.Acad.Sci.USA,1999,96:13560-13565.
[5]Mari O,Hidefumi S,Youji S,et al.Arabidopsis CLV3 Peptide Directly Binds CLV1 Ectodomain[J].Science ,2008,319:294-295.
[6]Takayama S,Shimosato H,Shiba H,et al,Direct ligand-receptor complex interaction controls Brassica self-incompatibility[J].Nature ,2001,413:534-538.
[7]Kristina E,Bjorn W,Alf C.Molecular Population Genetics of the SRK and SCR Self-Incompatibility Genes in the Wild Plant Species Brassica cretica(Brassicaceae)[J].Genetics,2009,181:985-995.
[8]Villalba M.,Batanero E.,Lopez O C,et al.The amino acid sequence of Ole e I,the major allergen from olive tree (Olea europaea)pollen[J].Eur.J.Biochem.,1993 ,216;863-869.
[9]Shu Y J,Phua X ,Hua J,Yeo Y T ,et al.Genome-wide Identification and Molecular Characterization of Ole e I,Allerg 1 and Allerg 2 Domain-containing Pollen-Allergen-like Genesin Oryza sativa[J].DNA Research ,2 005,12:167-179.
[10]Jefferson R A,Kavanagh T A,Bevan M W.GUS fusions:betaglucuronidase as a sensitive and versatile gene fusion marker in higher plants[J].EMBO J,1987 ,6:3901-3907.
