甘薯叶片基因组DNA提取方法
2011-01-26黄艳岚张超凡
黄艳岚,张超凡
(湖南省作物研究所,湖南 长沙 410125)
许多植物组织中含多糖、多酚、单宁、色素及其他次生代谢物质,从这些组织中分离出的DNA由于多酚被氧化成棕色,多糖、单宁等物质与DNA结合形成粘稠的胶状物,影响了DNA质量和纯度,对随后的酶切、PCR反应等有很强的抑制作用,因此在提取富含这类物质的基因组DNA时,应考虑去除多糖和酚类等物质。在提取甘薯叶片基因组DNA时也是如此,特别是在分子标记辅助育种、图谱构建、基因定位、遗传多样性分析等领域,获得高质量的DNA至关重要。目前已发表的用CTAB法和SDS法提取甘薯基因组DNA的方法[1-3]所提取的甘薯DNA质量不高,容易对后续的分子生物学实验产生抑制作用。笔者针对甘薯叶片富含多糖、酚类等物质的特点,采用CTAB方法并加以改进,提取甘薯叶片基因组DNA,旨在为甘薯AFLP、Southern杂交等后续分子生物学研究工作提供高质量基因组DNA。
1 材料与方法
1.1 材料
1.1.1 供试材料 供试的32份甘薯品种来源于国家产业体系长沙甘薯试验站实验基地,具体名称如表1所示。取1~32号甘薯顶部新鲜展开叶片3~4片,置已编号的保鲜袋中,冰上保存,随后立即提取DNA。
1.1.2 试 剂 CTAB、Tris、EDTA、PVP、TEMED 购自北京鼎国公司;Taq酶购自天根生化公司;EcoRI、MseI和 T4 DNA连接酶购自 NEB公司;EcoRI和MseI连接接头及引物均由北京奥科公司合成,其余试剂为国产分析纯。
1.2 方法
1.2.1 DNA提取方法 对照采用吴列洪[3]DNA提取方法(称为方法A)和改进的方法(称为方法B)。方法B为:取1 g新鲜叶片,加液氮研磨,转入2 mL离心管,加入1 mL预热的2×CTAB和150 mL无水乙醇,混匀,65℃水浴30~60 min,期间上下颠倒 2~3 次;加 0.6 倍体积氯仿:异戊醇(24∶1),混匀,12 000 rpm离心5 min;上清转入新2 mL离心管,加0.6倍体积异丙醇,12 000 rpm离心5 min;沉淀用0.8 mL高盐缓冲液(10 mM Tris-HCl pH 8.0,1 mM EDTA pH 8.0,1 M NaCl) 充分融解,12 000 rpm离心5 min;上清加0.6倍体积异丙醇,12 000 rpm离心5 min;沉淀用400 μL超纯水充分融解,加2.5倍体积无水乙醇,混匀,-20℃静置30 min,12 000 rpm离心5 min;沉淀吹干,溶于200 μL超纯水中。在2×CTAB提取缓冲液中加入一定量的无水乙醇和第一次异丙醇沉淀后用高盐缓冲液充分融解沉淀,这是本方法的改进之处。

表1 研究所用的甘薯品种名称
1.2.2 DNA样品检测 从32份甘薯DNA样品中各取2 μL,进行0.8%的琼脂糖凝胶电泳,检测DNA的完整性。取4 μL DNA溶液用超纯水稀释至200 μL,用紫外分光光度计测定其在 230、260、280 nm处的紫外吸收光谱。将每个DNA样品浓度稀释成 50 μg/mL。
1.2.3 AFLP分析 参照张超凡[4]等方法进行。
2 结果与分析
2.1 甘薯叶片基因组DNA提取分析
提取32份甘薯叶片总DNA并进行电泳,由于各样品用同一方法提取的DNA电泳效果无明显差别。本文以4份样品(处理1至处理4)的电泳图为例,如图1所示,其中A为用对照方法提取的甘薯DNA结果,B为用本方法提取的DNA结果。所有DNA样品经紫外分光光度计测定浓度、OD230、OD260、OD280,电泳图中4份DNA样品OD值结果如表2所示,方法B提取的DNA样品OD260/OD230值>2.0,OD260/OD280值在 1.8~2.0 之间,DNA 样品均为无色透明溶液。0.8%琼脂糖凝胶电泳检测的结果显示,方法B提取的甘薯总DNA为一条清晰完整的带,条带没有拖尾,说明本实验提取的DNA纯度高、质量好、相对分子量大,多糖和酚类等杂质去除得较充分。
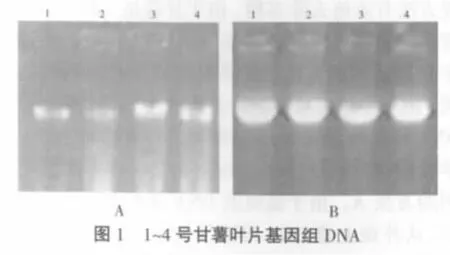

表2 甘薯基因组DNA溶液的OD值
2.2 AFLP分析
经过定量稀释,32份甘薯叶片基因组DNA样品浓度约为 50 μg/mL。取 100 ng样品 DNA,经EcoRI和MseI内切酶进行酶切,T4-DNA连接酶连接,预扩后用E-ACA和M-CTG引物组合进行选择性扩增。用对照方法提取的甘薯DNA经酶切连接,预扩增产物电泳时没有弥散的条带,选择性扩增就无法进行。图2为用本方法提取的32份甘薯DNA-AFLP分析结果,如图2所示,32份样品DNA-AFLP条带清晰,多态性好,说明本试验采用的CTAB法提取的DNA质量好,可以满足AFLP分析的要求。

3 讨 论
提取植物DNA的方法很多,但每种方法中最为关键的有三部分。首先将DNA充分释放到缓冲液中,其次是消除蛋白质、多糖、酚和色素等杂质的干扰,最后防止DNA的降解。其中,较难解决的是多糖类物质的去除。由于多糖的许多理化性质与核酸相似,因此不能用酚-氯仿抽提、选择性沉淀等常规方法有效地去除多糖。由于甘薯是一种含多糖非常多的植物,因此甘薯基因组DNA提取的关键在于采用适当的方法去除多糖等次生代谢物质的干扰。由于多糖可以抑制许多酶活性[5],有多糖污染的DNA样品纯度较低,无法顺利进行后续的分子生物学分析,如AFLP和Southern杂交。在本实验中采用的方法A,由于提取的DNA含有大量多糖类物质,从外观上看DNA溶液呈棕色,呈黏稠状,用这样的DNA样品无法获得AFLP的扩增结果。而利用方法B提取的甘薯DNA,充分考虑了在提取过程去除多糖,其中包括在CTAB提取液中加入一定量的无水乙醇和利用高盐溶液溶解沉淀,这两种改进都能降低DNA溶液中的多糖。Su等[6]在提取褐藻RNA时,单独使用醋酸钾去除多糖时无效,只有结合乙醇使用效果才明显。Lopez-Gomez等[7]在提取芒果中果皮的RNA时,在匀浆液中加入0.25倍体积无水乙醇和0.11倍体积的5 mol/L醋酸钾溶液,以去除多糖杂质。谭孟君等在提取水稻基因组DNA时利用高盐溶液溶解沉淀能够获得高质量的DNA用于SSR分子标记[8]。本文采用的方法与其他提取甘薯基因组的方法相比不需要用到β-巯基乙醇,能减少实验过程中对实验者的伤害,能稳定高效获得高质量的基因组DNA。
[1]李 强,揭 琴,刘庆昌,等.甘薯基因组DNA高效快速提取方法[J].分子植物育种,2007,5(5):743-746.
[2]张换样,李 静,南芝润,等.甘薯DNA的小量快速提取[J].山西农业科学,2009,37(1):12-14.
[3]吴列洪,谢德平,张燕春,等.微量法快速提取甘薯叶DNA条件的优化[J].安徽农业科学,2009,37(31):15157-15159.
[4]张超凡,黄艳岚,周 虹,等.湖南甘薯品种AFLP标记的遗传差异分析[J].江苏农业学报,2010,26(4):706-710.
[5]Fang G,Hammar S,Grumet R.A quick and inexpensive method for removing polysaccharides from plant genomic DNA[J].Biofeedback,1992,13(1):52-54.
[6]Su X,Gibor A.A method for RNA isolation from marine macroalgae[J].Anal Biochem,1988,174:650-657.
[7]Lopez G R,Gomez LM A.A method for extracting intact RNA from fruits rich in polysaccharides using ripe mango mesocarp[J].HortScience,1992,27:440-442.
[8]谭孟君,肖层林,詹庆才.利用SSR分子标记鉴定杂交稻种子金优 299 纯度研究[J].作物研究,2008,(2):73-75.
