粤蓝链霉菌中紫罗兰蓝色素成分的分离与鉴定*
2011-01-24邓名荣朱春华郭俊朱红惠
邓名荣 朱春华 郭俊 朱红惠†
(1.华南理工大学生物科学与工程学院,广东广州510006;2.广东省微生物研究所广东省菌种保藏与应用重点实验室,广东广州510070)
食用色素作为着色剂在加工食品中广泛应用.食用色素可分为合成色素和天然色素两大类.随着合成色素使用量的增长,由合成色素引起的一些安全问题也不断出现,如国内的“孔雀石绿”、“苏丹红”等事件引起人们对色素安全问题的广泛关注.与合成色素相比,天然色素具有安全性相对较高,同时色调自然等优点,许多天然色素还具有增强人体营养、保健等功能[1],因此,近年来天然色素日趋受到消费者的青睐.然而,与之相悖的是,在实际生产中天然色素使用并不广泛,目前我国批准使用的天然色素有60余种,但真正产业化的仅有10余种,如辣椒红、姜黄色素等[2].主要原因是:①天然色素绝大部分来源于植物,含量低,提取困难,生产成本较高,且受植物生长周期的限制;②天然色素色系单调,以红、黄为主,而蓝色色系罕见.
微生物能产生丰富的色素,其生长周期短,易于人工控制和大规模生产,不受原材料和季节的限制,并可通过诱变提高产量.因此,通过微生物发酵生产天然色素成为研究的热点[1,3-4],特别是从微生物中寻找蓝色等稀有天然色素更受关注.张和春等[5-7]对一株天蓝色链霉菌(Streptomyces ceolicolor)所产蓝色素的色素性质、发酵动力学以及结构和毒性进行了研究,认为该蓝色素具有开发的潜力.近年Zhu等[8]从热带原始森林土壤中分离获得一株链霉菌新种——粤蓝链霉菌(S.vietnamensis),该菌能在多种培养基中产生水溶性紫罗兰蓝色素,色调优美,非常值得进一步研究开发.笔者已对该菌次级代谢产物的生物活性进行了研究,发现其具有抗菌和抗肿瘤的活性[9].本研究对该菌的产色发酵条件进行了优化,并综合采用多种手段,分离鉴定了其中主要的呈色物质.
1 试验
1.1 菌株、试剂和仪器
粤蓝链霉菌GIMV4.0001T,由广东省微生物菌种保藏中心提供.乙酸乙酯等化学试剂均为国产分析纯.柱层析硅胶(200-300目)、薄层层析(TLC)硅胶GF254(10~20μm)均购自青岛海洋化工厂.葡聚糖凝胶Sephadex LH-20为法玛西亚产品.高效液相色谱(HPLC)在岛津LC-20A色谱仪上进行.色谱柱为 Hypersil ODS-2 柱(5 μm,250.0 mm ×4.6 mm,分析用)和Discovery C18柱(5μm,250mm×10mm,半制备用).核磁共振(NMR)氢谱(1H)、碳谱(13C)在Brüker Avance(600 MHz)核磁共振波谱仪上测定;四甲基硅烷(TMS)作为内标,氘代溶剂为氘代氯仿(CDCl3)、氘代丙酮(ACETONE-d6)、氘代二甲基亚砜(DMSO-d6).质谱(MS)在LCQ Deca质谱仪上完成.
1.2 试验方法
1.2.1 产色培养基的选择及发酵条件的正交优化
色素是链霉菌产生的次级代谢产物,不同营养成分对链霉菌次级代谢产物的种类和产量有非常重要的影响.首先测试粤蓝链霉菌培养基在4种培养基中产蓝色素的能力,即YEME培养基(酵母提取物3g,蛋白胨5g,麦芽提取物3g,葡萄糖10g,补水至1L,pH=7.2,灭菌后加入2.5mol/L MgCl22mL),高氏合成一号培养基(可溶性淀粉 20.00 g,KNO31.00 g,K2HPO40.50 g,MgO4·7H2O 0.50 g,NaCl 0.50g,FeSO40.01g,补水至 1 L,pH=7.2),YMS 培养基(酵母提取物4g,可溶性淀粉4 g,麦芽提取物10g,CoCl2·6H2O 5mg,补水至 1 L,pH=7.2),YD培养基(酵母提取物4.0g,麦芽提取物10.0 g,葡萄糖4.0g,MgCl22.0 g,CaCl21.5 g,补水至 1 L,pH=7.2).然后采用选取的适宜培养基对接种量、培养温度、摇床转速、发酵时间等参数进行正交优化,正交试验按4因素3水平L9(34)进行设计(见表1),每个处理重复3次.产色素能力的评价采用比色法:培养3天后,离心,取50μL上清用三羟甲基氨基甲烷-乙二胺四乙酸二钠缓冲液(pH=8.0)定容至1mL,测定580nm波长处的吸光值.
1.2.2 发酵产物的提取、分离和鉴定
发酵液经离心(6000g、20min),过滤,使菌液分离.过滤液用等体积乙酸乙酯萃取3次,50℃真空旋转浓缩,获得粗提物.分离纯化时,将粗提物用最小体积的甲醇重新溶解,溶液置于-20℃过夜以去除蜡质,重新蒸干后,硅胶柱层析,用氯仿/甲醇系统依次洗脱,粗分各部位反复用Sephadex LH-20凝胶柱、半制备TLC及HPLC进行用分离纯化,具体流程见图1.NMR测定时,根据样品的溶解性能来选择氘代溶剂.MS测定时,根据样品的电离难易程度选择大气压化学电离(APCI)、电喷雾电离(ESI)等不同电离方式.化合物的化学结构主要根据1H谱、13C谱和MS等数据及相关文献[10-12]进行解析.

图1 紫罗兰蓝色素分离纯化流程图Fig.1 Flow chart of isolation and purification the violet-blue pigment
2 结果与讨论
2.1 产色适宜的发酵条件及色素提取
粤蓝链霉菌在YEME、YD、YMS、高氏合成一号4种培养基中的色素产量差异较大,发酵上清液吸光值 D(580)均值分别为 4.76、6.78、3.61、10.52,可见高氏合成一号培养基是适宜的产色培养基,因此选用该培养基开展后续研究.由于高氏合成一号培养基主要成分是淀粉和无机盐,原材料价格低廉,因此也可作为工业化生产的基础培养基.进一步对接种量、培养温度、摇床转速、发酵时间等参数进行正交优化,结果见表1.方差分析(见表2)表明,4个因素对色素量均有显著影响(P<0.01),影响力依次为摇床转速、培养温度、发酵时间和接种量.极差分析表明(见表1),接种量、培养温度、摇床转速、发酵时间的最大均值分别出现在水平2、水平2、水平3、水平3,即优化的培养参数组合为:接种量5%(体积分数,余同),培养温度30℃,180r/min振动培养7d.利用该培养参数,色素D(580)可达12.36.批量发酵共40L,乙酸乙酯提取后共获得粗提物38.6g.
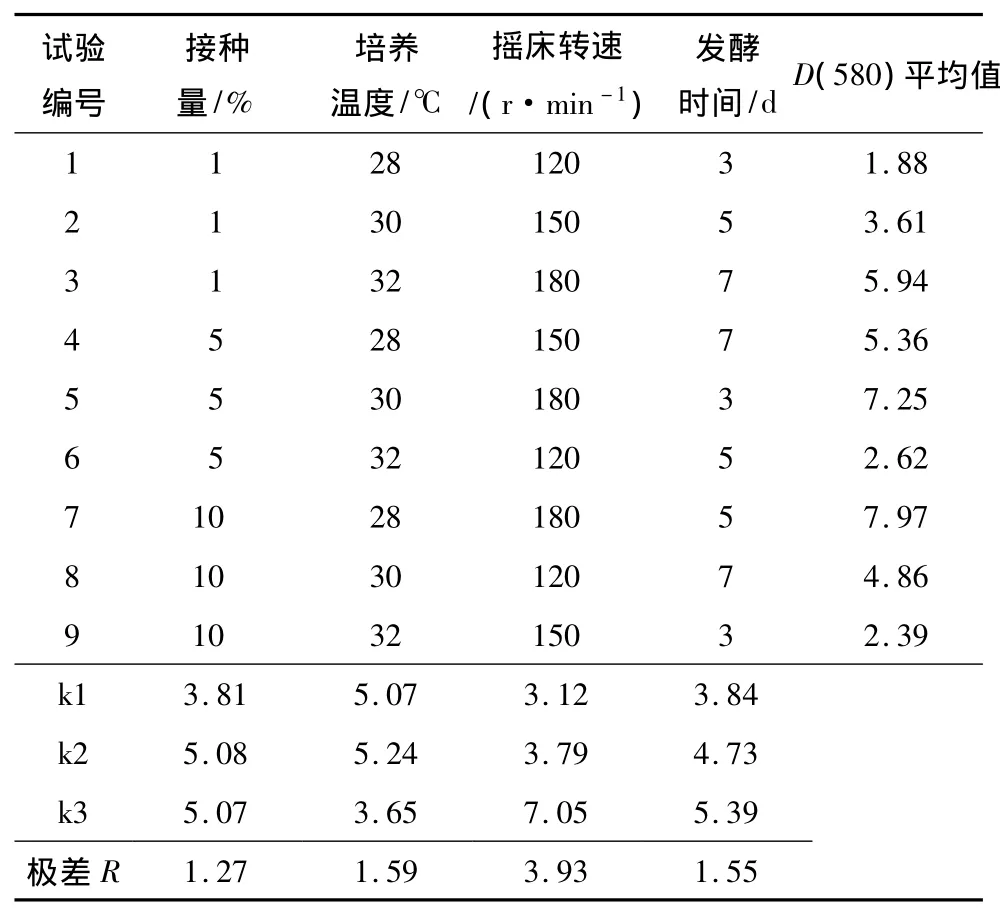
表1 粤蓝链霉菌产色发酵优化正交试验设计及结果Table 1 Orthogonal design and results of pigment fermentation optimization of S.vietnamensis
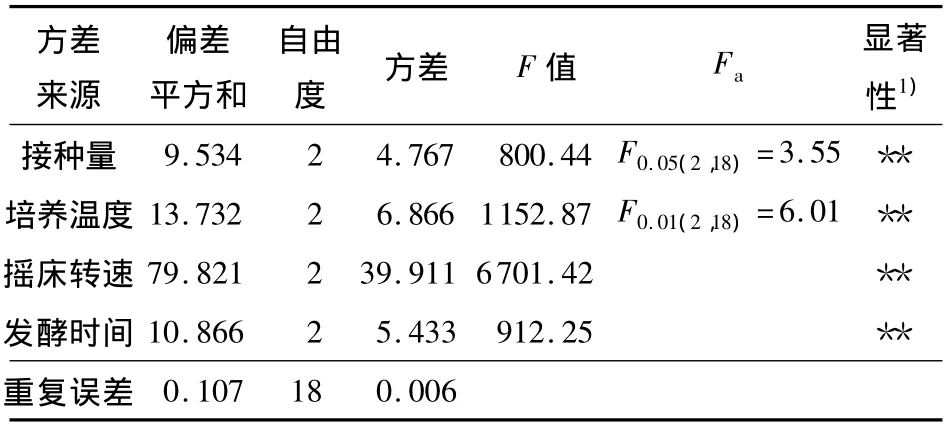
表2 粤蓝链霉菌产色发酵优化试验结果方差分析Table 2 Variance analysis of the results of pigment fermentation optimization of S.vietnamensis
2.2 紫罗兰蓝色素成分的纯化及其结构
从乙酸乙酯粗提物中分离纯化获得7个单体化合物,其中化合物4、7为新化合物,各化合物的分离流程见图1.TLC分析表明化合物1、7是紫罗兰蓝色素的两个主要呈色物质.结构解析的具体结果如下.
化合物1 深红色针晶,碱性水溶液中呈蓝色,酸性水溶液中呈红色,APCI-MS:m/z 445[M+H]+,m/z 443[M -H]-,表明其相对分子质量为444.1H NMR(600MHz,CDCl3)图谱主要化学位移:12.89(1H,s,11-OH),12.79(1H,s,8-OH),6.35(1H,s,20-OH),5.33(1H,d,J=2.4 Hz,4-H),5.22(1H,q,J=6.0Hz,15-H),5.20(1H,dd,J=3.6,1.8Hz,17-H),4.74(1H,dd,J=14.9,3.0 Hz,3-H),4.02(1H,dd,J=8.4,1.8 Hz,19-H),3.80(1H,q,J=6.0Hz,21-H),2.99(1H,dd,J=13.2,4.8 Hz,2a-H),2.72(2H,d,J=18.0 Hz,2b-H,18a-H),2.62(1H,s,19-OH),1.59(3H,d,J=6.0Hz,16-H),1.56(2H,dd,J=14.4,1.8 Hz,18b-H),1.03(3H,q,J=6.0Hz,22-H).13C NMR(150MHz,CDCl3)图谱主要化学位移:171.7(C-1),36.9(C-2),66.9(C-3),72.8(C-4),138.3(C-5),174.0(C-6),110.3(C-7),165.1(C-8),145.3(C-9),130.9(C-10),166.8(C-11),111.6(C-12),178.5(C-13),145.3(C-14),70.9(C-15),18.2(C-16),68.8(C-17),35.5(C-18),66.2(C-19),80.6(C-20),61.7(C-21),16.56(C-22).其理化性质和波谱学数据与文献[10]报道的一致,鉴定为榴菌素(见图2(a)).
化合物2 棕黄色针晶,ESI-MS:m/z 433[M+Na]+,m/z 843[2M+Na]+,表明其相对分子质量为410.1H NMR(600 MHz,CDCl3)图谱主要化学位移:13.40(1H,s,6-OH),13.25(1H,s,13-OH),8.39(1H,dd,J=7.8,1.2 Hz,17-H),8.26(1H,dd,J=7.8,1.2Hz,19-H),7.86(1H,t,J=7.8Hz,18-H),5.99(1H,q,J=6.3Hz,21-H),5.44(1H,d,J=3.0 Hz,4-H),5.31(1H,q,J=6.9 Hz,15-H),4.79(1H,dd,J=4.8,3.0 Hz,3-H),3.01(1H,dd,J=17.7,5.1 Hz,2a-H),2.75(1H,br d,J=17.4 Hz,2b-H),1.61(3H,d,J=6.3Hz,22-H),1.60(3H,d,J=6.9Hz,16-H).13C NMR(150 MHz,CDCl3)图谱主要化学位移:172.7(C-1),36.8(C-2),64.3(C-3),72.5(C-4),134.4(C-5),156.3(C-6),111.8(C-7),186.3(C-8),133.7(C-9),132.7(C-10),189.8(C-11),110.5(C-12),153.7(C-13),139.8(C-14),67.8(C-15),19.3(C-16),125.5(C-17),132.7(C-18),128.2(C-19),149.6(C-20),63.8(C-21),26.9(C-22).其理化性质和波谱学数据与醌茜兰类色素Zg一致[11],鉴定为色素 Zg(见图2(b)).
化合物3 橙色针晶,ESI-MS:m/z 431[M+Na]+,m/z 839 [2M+Na]+,表明其相对分子质量为408.1H NMR(600 MHz,CDCl3)图谱主要化学位移:13.34(1H,s,6-OH),12.73(1H,s,13-OH),8.45(1H,dd,J=7.5,1.2 Hz,17-H),7.92(1H,t,J=7.5Hz,18-H),7.58(1H,dd,J=7.5,1.2 Hz,19-H),5.44(1H,d,J=3.0 Hz,4-H),5.32(1H,q,J=6.6Hz,15-H),4.79(1H,dd,J=4.8,3.0 Hz,3-H),3.01(1H,dd,J=17.4,5.4 Hz,2a-H),2.72(1H,br d,J=18.0Hz,2b-H),2.60(3H,s,22-H),1.58(3H,d,J=6.6 Hz,16-H).13C NMR(150 MHz,CDCl3)图谱主要化学位移:173.1(C-1),36.2(C-2),64.6(C-3),73.3(C-4),134.1(C-5),156.1(C-6),110.9(C-7),183.5(C-8),135.7(C-9),133.7(C-10),190.3(C-11),110.5(C-12),153.7(C-13),139.7(C-14),68.1(C-15),19.3(C-16),131.3(C-17),132.4(C-18),128.8(C-19),142.6(C-20),201.8(C-21),29.6(C-22).其理化性质和波谱学数据与醌茜兰类色素 Zgg[11]相符,鉴定为色素 Zgg(见图2(b)).

图2 粤蓝链霉菌紫罗兰蓝色素化学结构Fig.2 Chemical structures of the violet-blue pigment of S.vietnamensis
化合物4 棕黄色针晶,ESI-MS:m/z 413[M+H]+,m/z 411[2M -H]-,表明其相对分子质量为412.1H NMR(600MHz,DMSO-d6)图谱主要化学位移:13.48(1H,s,6-OH),13.23(1H,s,13-OH),8.34(1H,d,J=7.7 Hz,17-H),8.23(1H,d,J=6.8 Hz,19-H),7.94(1H,t,J=7.7 Hz,18-H),5.98(1H,q,J=6.1Hz,21-H),5.21(1H,br s,1-OH),5.06(1H,q,J=6.6 Hz,15-H),4.32(1H,m,3-H),2.92(1H,dd,J=18.1,3.2Hz,2a-H),2.68(1H,d,J=4.3 Hz,4a-H),2.49(1H,被 δ 2.68 屏蔽,4b-H),2.48(1H,被 δ 2.68 屏蔽,2b-H),1.53(3H,d,J=6.6 Hz,16-H),1.37(3H,d,J=6.1Hz,22-H).13C NMR(150MHz,DMSO-d6)图谱主要化学位移:181.8(C-1),41.0(C-2),64.8(C-3),38.9(C-4),133.7(C-5,C-9),154.3(C-6),110.7(C-7),186.5(C-8),134.4(C-10),190.0(C-11),109.7(C-12),153.2(C-13),139.5(C-14),67.2(C-15),18.5(C-16),125.7(C-17),133.0(C-18),128.3(C-19),152.8(C-20),62.8(C-21),27.5(C-22).该化合物氢谱、碳谱数据与化合物2相似,二者的差别主要在 C-1、C-4.δ181.8(C-1)提示该碳原子为羧酸基团的羰基碳,氢谱中化学位移5.21(1H,br s,1-OH)也说明该碳原子上连有一个羟基,δ38.9(C-4)提示该碳原子为仲碳,其上连有两个化学位移分别为2.68、2.49的氢原子,说明羧酸基团未在C-4上形成内酯环.质谱显示该化合物的相对分子质量比化合物2大2,因此该化合物是化合物2的二氢形式,即二氢Zg(见图2(c)).
化合物5 深红色针晶,碱性水溶液中呈蓝色,酸性水溶液中呈红色;APCI-MS:m/z 581[M+Na]+,m/z 557[M -H]-,表明其相对分子质量为558.1H NMR(600 MHz,ACETONE-d6)图谱主要化学位移:13.01(1H,s,8-OH),12.86(1H,s,11-OH),5.45(1H,d,J=2.4Hz,4-H),5.16(1H,q,J=6.6Hz,5-H),5.16(1H,d,J=3.0 Hz,17-H),4.94(1H,dd,J=5.4,3.0Hz,3-H),4.83(1H,d,J=3.0Hz,1'-H),4.11(1H,q,J=6.6 Hz,5'-H),4.07(1H,dd,J=7.8,1.2 Hz,19-H),3.81(1H,q,J=6.0 Hz,21-H),3.48(1H,br s,4'-H),3.21(1H,dd,J=17.4,5.4 Hz,2a-H),2.69(1H,d,J=14.5,7.8,3.0Hz,18a-H),2.52(1H,d,J=17.4 Hz,2b-H),1.96(1H,m,3'a-H),1.81(1H,m,3'b-H),1.61(3H,d,J=6.6Hz,16-H),1.56(1H,d,被 δ1.50 屏蔽,18b-H),1.50(1H,m,2'a-H),1.20(1H,m,2'b-H),1.17(3H,d,J=6.6 Hz,6'-H),0.96(3H,d,J=6.0 Hz,22-H).13C NMR(150 MHz,ACETONE-d6)图谱主要化学位移:173.8(C-1),37.4(C-2),66.8(C-3),68.2(C-4),141.2(C-5),176.6(C-6),112.2(C-7),168.5(C-8),147.2(C-9),139.7(C-10),169.8(C-11),110.9(C-12),173.1(C-13),133.3(C-14),62.5(C-15),18.3(C-16),67.3(C-17),35.8(C-18),69.6(C-19),79.4(C-20),73.3(C-21),17.1(C-22),96.8(C-1'),26.3(C-2'),24.3(C-3'),67.6(C-4'),77.3(C-5'),17.7(C-6').其理化性质和波谱学数据与文献[10]报道的数据吻合,鉴定为榴菌素B(见图2(a)).
化合物6 橙色针晶,APCI-MS:m/z 575[MH]-,表明其相对分子质量为576.1H NMR(600MHz,ACETONE-d6)图谱主要化学位移:5.13(1H,dd,J=3.0,1.8Hz,17-H),5.00(1H,q,J=6.6 Hz,15-H),4.82(1H,br s,1'-H),4.37(1H,m,3-H),4.14(1H,q,J=6.6 Hz,5'-H),4.05(1H,dd,J=7.8,1.2 Hz,19-H),3.81(1H,q,J=6.0 Hz,21-H),3.48(1H,br s,4'-H),2.83(1H,dd,J=19.6Hz,2a-H),2.77(1H,ddd,J=14.1,4.3,1.9Hz,4a-H),2.73(1H,dd,J=19.6Hz,2b-H),2.68(1H,ddd,J=14.4,7.8,3.0Hz,18a-H),2.11(1H,dd,J=18.6,5.1 Hz,4b-H),1.96(1H,m,3'a-H),1.81(1H,m,3'b-H),1.56(3H,d,J=6.6Hz,16-H),1.52(1H,被 δ 1.50 屏蔽,18b-H),1.50(1H,m,2'a-H),1.20(1H,m,2'b-H),1.17(3H,d,J=6.6 Hz,6'-H),0.94(3H,d,J=6.0Hz,22-H).13C NMR(150MHz,ACETONE-d6)图谱主要化学位移:167.9(C-1),35.6(C-2),66.8(C-3),25.2(C-4),83.4(C-5),192.8(C-6),111.8(C-7),150.1(C-8,C-11),137.6(C-9),134.7(C-10),111.9(C-12),199.1(C-13),75.1(C-14),67.5(C-15),15.8(C-16),62.3(C-17),35.8(C-18),65.8(C-19),78.4(C-20),73.3(C-21),16.3(C-22),96.7(C-1'),25.9(C-2'),24.3(C-3'),65.6(C-4'),76.8(C-5'),17.3(C-6').其波谱学数据与化合 物 MM44785 基 本 相 同[12],因 此 鉴 定 为MM44785(见图2(d)).
化合物7 橙色针晶,APCI-MS:m/z 461[MH]-,m/z 443[M -H2O]-,表明其相对分子质量为462.1H NMR(600 MHz,ACETONE-d6)图谱主要化学位移:5.13(1H,dd,J=3.6,1.8 Hz,17-H),5.01(1H,q,J=6.6 Hz,15-H),4.37(1H,m,3-H),3.97(1H,dd,J=7.8,1.8 Hz,19-H),3.74(1H,q,J=6.0Hz,21-H),2.83(1H,dd,J=19.6 Hz,2a-H),2.77(1H,ddd,J=14.6,4.3,1.9Hz,4a-H),2.73(1H,dd,J=19.6 Hz,2b-H),2.68(1H,ddd,J=14.4,7.8,3.6 Hz,18a-H),2.11(1H,dd,J=19.6,5.1Hz,4b-H),1.56(3H,d,J=6.6 Hz,16-H),1.46(1H,dt,J=14.4,1.8 Hz,18b-H),0.95(3H,d,J=6.0Hz,22-H).13C NMR(150 MHz,ACETONE-d6)图谱主要化学位移:167.3(C-1),35.7(C-2),67.2(C-3),24.7(C-4),83.8(C-5),193.0(C-6),111.6(C-7),153.8(C-8),137.7(C-9),135.1(C-10),159.7(C-11),112.5(C-12),199.5(C-13),75.3(C-14),67.3(C-15),15.9(C-16),62.5(C-17),35.7(C-18),65.5(C-19),78.6(C-20),73.6(C-21),16.5(C-22).其相对分子质量比化合物6少114,刚好是一个鼠李糖基的大小,其波谱学数据除缺失鼠李糖基相关信号外,其余几乎与化合物6完全一致.因此,该化合物是化合物6的去鼠李糖基形式,即去鼠李糖基MM44785(见图2(d)).
3 结论
粤蓝链霉菌产蓝色素的适合培养基是高氏合成一号培养基,该培养基也可作为工业化生产的基础培养基,优化的培养条件为:接种量5%,培养温度30℃,180r/min振动培养7 d.从粤蓝链霉菌发酵产物中分离并鉴定出紫罗兰蓝色素的7个主要成分,分别为榴菌素,榴菌素B,醌茜兰类色素Zg、Zgg,二氢Zg,MM44785和去鼠李糖基MM44785,其中二氢Zg和去鼠李糖基MM44785是两个新的榴菌素相关化合物.
[1] Dufosse L.Microbial production of food grade pigments[J].Food Technology and Biotechnology,2006,44(3):313-323.
[2] 阎炳宗.我国天然色素的现状及发展方针[J].中国食品添加剂,1999(2):8-9.Yan Bing-zong.Status of natural pigments and development policies in China [J].China Food Additives,1999(2):8-9.
[3] Chattopadhyay P,Chatterjee S,Sen S K.Biotechnological potential of natural food grade biocolorants[J].African Journal of Biotechnology,2008,7(17):2972-2985.
[4] Mapari S A S,Thrane U,Meyer A S.Fungal polyketide azaphilone pigments as future natural food colorants[J].Trends in Biotechnology,2010,28(6):300-307.
[5] 张和春,陈亮,季文明,等.产蓝色素放线菌的初步鉴定和蓝色素性质研究[J].无锡轻工大学学报,1999,18(3):23-26.Zhang He-chun,Chen Liang,Ji Wen-ming,et al.Identification of a blue pigment producing and the properties of blue pigment[J].Journal of Wuxi University of Light Industry,1999,18(3):23-26.
[6] 张和春,范卫民,张元兴.天蓝色链霉菌产蓝色素的分批发酵动力学分析[J].过程工程学报,2002,2(3):241-245.Zhang He-chun,Fan Wei-min,Zhang Yuan-xing.Kinetic analysis of batch fermentation of Streptomyces coelicolor[J].The Chinese Journal of Process Engineering,2002,2(3):241-245.
[7] Zhang H C,Zhan J X,Su K M,et al.A kind of potential food additive produced by Streptomyces coelicolor:characteristics of blue pigment and identification of a novel compound,λ-actinorhodin [J].Food Chemistry,2006,95(2):186-192.
[8] Zhu H H,Guo J,Yao Q,et al.Streptomyces vietnamensis sp.nov.,a streptomycete with violet blue diffusible pigment isolated from soil in Vietnam [J].International Journal of Systematic and Evolutionary Microbiology,2007,57(8):1770-1774.
[9] 邓名荣,郭俊,朱红惠.粤蓝链霉菌代谢产物的抗菌抗肿瘤活性及相关基因的初步研究[J].天然产物研究与开发,2010,22(3):367-372.Deng Ming-rong,Guo Jun,Zhu Hong-hui.Primary study on antibiotic and anticancer secondary metabolites and their potentially related genes from Streptomyces vietnamensis[J].Natural Product Research and Development,2010,22(3):367-372.
[10] Keller-Schierlein W,Brufani M,Barcza S.Products of metabolism of microorganisms.66.structure of granaticin and granaticin B.1.spectroscopic properties and chemical degradation [J].Helvetica Chimica Acta,1968,51(6):1257-1268.
[11] Pyrek J S,Achmatowicz O,Zamojski A.Naphto-and anthraquinones of Streptomyces thermoviolaceus WR-141:structures and model syntheses[J].Tetrahedron,1977,33(6):673-680.
[12] Gilpin M L,Box S J,Elson A L.New quinone antibiotics of the granaticin type,isolated from Streptomyces lateritius.2.structure determination [J].Journal of Antibiotics,1988,41(4):512-518.
