响应面法优化蕤核叶片总黄酮提取工艺
2011-01-24张秀秀魏学智徐建国邰源临
张秀秀,魏学智,张 强,徐建国,邰源临
(1.山西师范大学生命科学学院,山西临汾 041000;2.山西师范大学工程学院,山西临汾 041000;3.水利部水土保持植物开发管理中心,北京 100083)
蕤核 (Prinsepia unifloraBatal.)是蔷薇科扁核木属 (Prinsepia Royle)植物,生长于 800~1 000 m的向阳山坡,分布于山西,陕西,内蒙古,甘肃等地[1],是黄土高原地区的乡土植物。蕤核具有耐旱、耐寒、耐贫瘠和保持水土的作用,是我国水土保护造林的良好树种。另外,蕤仁还具有疏风散热、养肝明目的药用价值[2]。长期以来,对扁核木属的研究主要集中于引种栽培[3-5]、光合特性[6]和蕤仁的药用研究等方面。近期研究发现,蔷薇科扁核木属植物叶片中含有含有熊果酸、齐墩果酸等生物活性物质,这些化合物对淋巴细胞变异有显著的抑制作用[7-8]。黄酮类物质作为一种生物活性物质,对人类的肿瘤、衰老、心血管等疾病的预防和治疗具有重要意义[9-11],因此对蕤核叶片中黄酮类物质提取工艺的研究具有重要价值。
本实验首次对蕤核叶片中的黄酮类物质进行提取,就影响蕤核叶片总黄酮提取率的几个重要因素作了系统研究。选取超声提取时间、乙醇浓度,液固比和提取温度做为影响因素,以总黄酮得率为响应值,根据 Box-Benhnken中心组合设计实验[12]。运用响应面法对提取工艺进行了优化,建立了超声波辅助提取工艺的优化数学模型,并对该优化模型的拟合效果进行了检验和验证,确定了蕤核叶片总黄酮提取的最佳条件。
1 材料与方法
1.1 实验材料和仪器
蕤核叶片采自山西省临汾市龙祠村。烘干,粉碎过 60目筛后备用。芦丁标准品 (国药集团化学试剂有限公司),其余所用试剂均为分析纯。
RE-52A型旋转蒸发仪,上海青浦沪西仪器厂;SHB-Ⅲ型循环水式多用真空泵,郑州长城科工贸有限公司;721型可见分光光度计,上海天普分析仪器有限公司;101-3BS型电热鼓风干燥箱,金坛市荣华仪器有限公司;KQ-500E超声波清洗器,昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 总黄酮含量的测定
参照总黄酮[13]的测定方法。以吸光度值 A为纵坐标,浓度 C(mg·L-1)为横坐标绘制标准曲线,进行线性回归,求得其回归方程为:A=0.0113C+0.0005(R2=0.9998)。
1.2.2 实验设计
(1)单因素实验
准确称取 1.0 g蕤核叶片粉末,放入 150 mL锥形瓶中,在其他条件相同的情况下,采用不同超声提取时间、乙醇浓度、液固比、提取温度进行提取、过滤、定容,计算总黄酮得率,逐个考察各提取条件对提取效果的影响。
(2)Box-Benhnken中心组合设计实验
根据单因素实验结果,以影响蕤核叶片总黄酮得率的主要因素为输入变量,以总黄酮得率为指标,进行 Box-Benhnken中心组合设计实验。
2 结果与分析
2.1 蕤核叶片总黄酮超声波提取单因素实验
2.1.1 超声时间对蕤核叶片总黄酮得率的影响
在乙醇浓度 60%、液料比为 20∶1、提取温度为70℃的条件下,不同超声时间对蕤核叶片总黄酮得率的影响结果见图1。
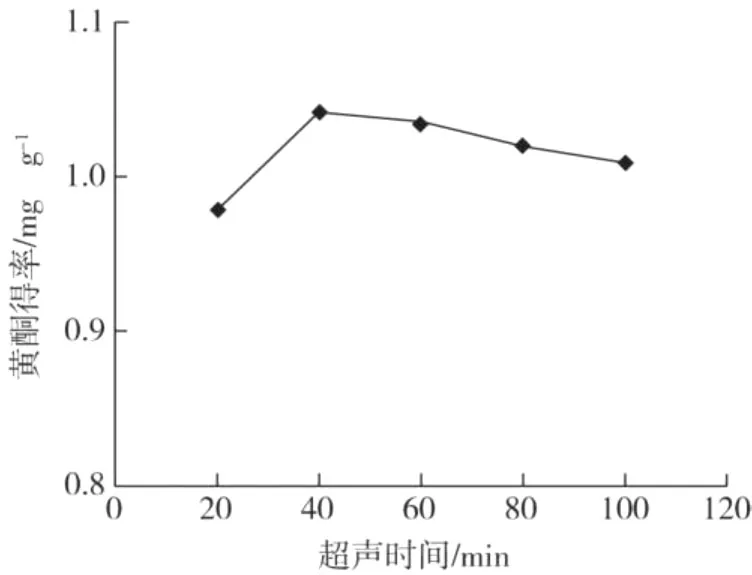
图1 超声时间对总黄酮得率的影响
由图1可知,超声 20~40 min内总黄酮得率随着时间的增加呈上升趋势,这是因为随着时间的延长,反应进行的比较完全,蕤核叶片中的黄酮成分不断地溶出,使得得率上升。但继续延长提取时间,黄酮成分已基本溶出,使得总黄酮得率不升反降,表明过长时间的提取无法增加总黄酮的得率,并且延长提取时间还会增加能耗。
2.1.2 乙醇浓度对蕤核叶片总黄酮得率的影响
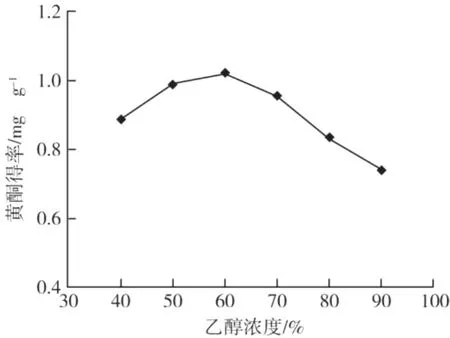
图2 不同乙醇浓度对总黄酮得率的影响
在液料比为 20∶1、超声时间 40 min、提取温度为 70℃的条件下,不同乙醇浓度对蕤核叶片总黄酮得率的影响结果见图2。
由图2可知,随着乙醇浓度的提高,蕤核叶片总黄酮得率呈上升趋势,当乙醇浓度达到 60%时总黄酮得率最大,之后随着浓度的增加,得率反而降低。乙醇浓度过高时,一些醇溶性杂质、亲脂性强的成分溶出量增加,这些成分与蕤核黄酮竞争乙醇 -水分子结合,使溶液黏度变大,增大了传递过程中溶剂的阻力,减缓了黄酮向主体溶剂的扩散,减少了粉末表面与溶剂之间黄酮的浓度差,从而导致黄酮提取得率的减少。
2.1.3 液料比对蕤核叶片总黄酮得率的影响
在乙醇浓度 60%、超声时间 40 min、提取温度为 70℃的条件下,不同液料比对蕤核叶片总黄酮得率的影响结果见图3。
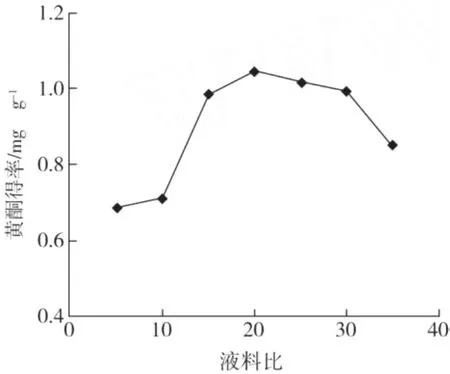
图3 液料比对总黄酮提取率的影响
由图3可知,当液料比小于 20∶1时,随着液料比的增加,总黄酮的得率随之增加,在液料比为 20∶1时达到峰值,这是因为随着溶剂倍数的增大,溶剂与蕤核叶片粉末之间的接触面变大,从而有利于促进蕤核叶片中黄酮成分的溶出,但过高的液料比反而使总黄酮得率降低。
2.1.4 提取温度对蕤核叶片总黄酮得率的影响
在乙醇浓度 60%、超声时间 40 min、液料比为20∶1的条件下,不同提取温度对蕤核叶片总黄酮得率的影响结果见图4。
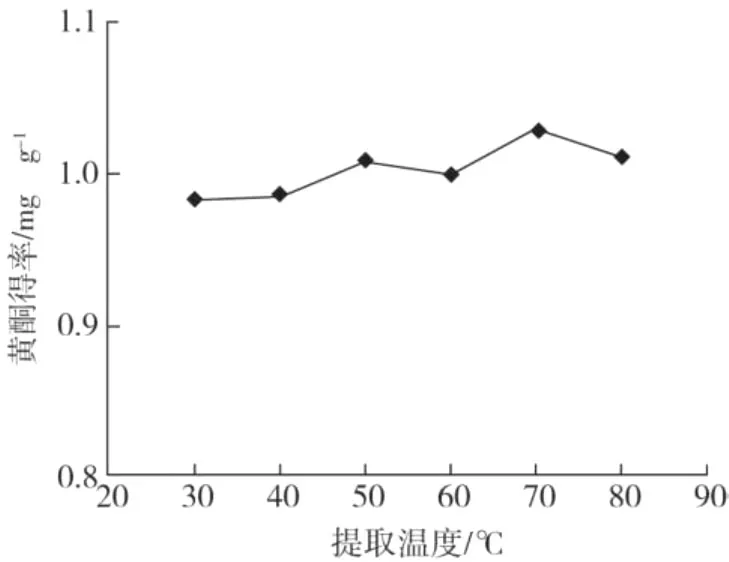
图4 提取温度对总黄酮得率的影响
从图4可以看出,随着温度的升高,溶剂的粘度减小,分子运动速度加快,提取液的扩散系数增加,促使提取速度加快。总黄酮的提取率随温度的升高而增加,当温度达到 70℃时,温度再增加,提取率增加较小,考虑到温度高于乙醇沸点易挥发,因此提取温度范围选择 60℃~80℃之间为宜。
2.2 超声波辅助提取工艺优化模型的建立

表1 实验因素和水平编码值
在单因素实验的基础上,根据 Box-Behnken中心组合原理设计了 4因素 3水平的响应面法实验,实验因素及水平编码见表1。
由Design Expert 7.1.6的试验设计功能可知,Box-Behnken中心组合实验包括 29个试验点,分为两类:其一是因析点,自变量取值在 A、B、C、D、所构成的三维定点,共有 24个因析点;其二是零点,为区域中心点,零点试验重复 5次用来估计实验误差。
由方差分析可知:回归的失拟性检验 P>0.05,差异不显著,可以认为所选用的二次回归模型是适当的;回归方程的显著性检验 P<0.001,极显著,说明模型的预测值与实际值非常吻合,模型成立。对回归系数显著性检验,在α=0.05显著水平剔除不显著项,得到的优化后的方程为:Y=0.130+0.051A+0.027B+0.030C-0.033AB+0.033AC+0.034AD-0.078BD-0.078A2-0.106B2-0.048C2-0.038D2。
各因素的 F值可以反映出各个因素对实验指标的重要性,F值越大,表明对实验指标的影响越大,即重要性越大。实验可得,影响蕤核叶片总黄酮得率顺序为:A(超声波提取时间)>C(液料比)>B(乙醇浓度)>D(提取温度)。
由方差分析可知,AB,AC,AD和 BD之间存在交互作用,因此剔除不显著项后的回归方程中,固定两个因素在零水平上,研究另两个因素间的交互作用。分析结果见图5~7。
由图5~7可知,随着超声时间 A和乙醇浓度B的增加,蕤核叶片中总黄酮的提取率呈上升趋势,达到一定程度时,总黄酮的提取率最大;但当超声时间和乙醇浓度继续增加时,提取率开始下降。因此只有它们取值适中时,才能获得最高的总黄酮提取率。超声时间 A与液料比 C具有正相关的协同作用,交互作用可以获得更高的总黄酮提取率,但二者增大到一定值时,提取率增加的不明显。超声时间 A与提取温度 D的交互作用表明,提取温度和提取时间在零水平以下时,提取率随着水平的增加而明显增加;当二者在零水平以上时,提取率随水平的增加而下降,原因是高温长时间对提取率并没有太大的促进,反而会影响提取效果。因此,只有当提取时间、乙醇浓度、料液比、提取温度合理搭配时才能获得更好的提取效果。
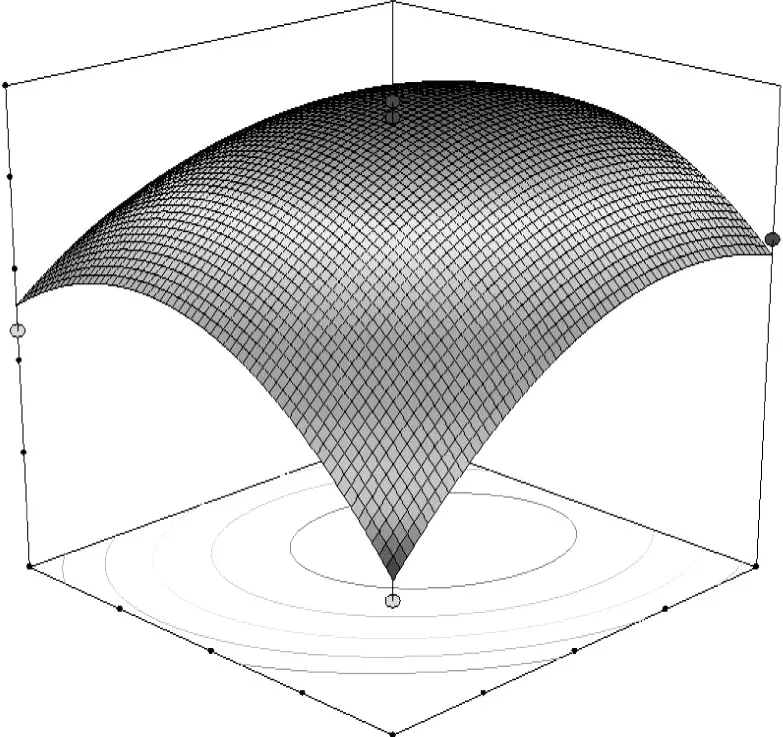
图5 超声时间和乙醇浓度对总黄酮提取率的交互作用分析
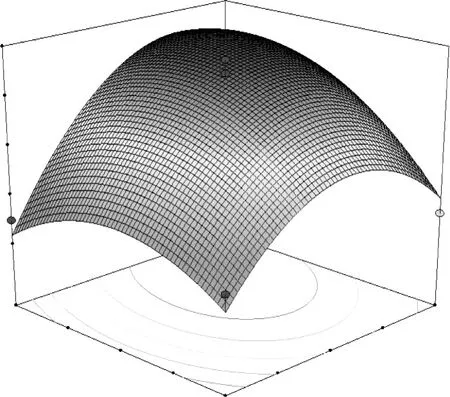
图6 超声时间和液料比对总黄酮提取率的交互作用分析
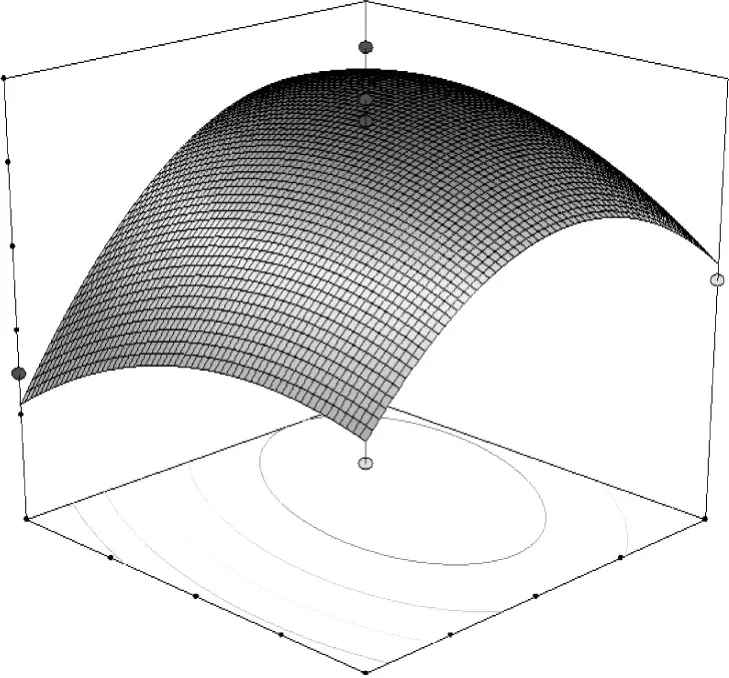
图7 超声时间和提取温度对总黄酮提取率的交互作用分析
通过回归模型预测,可以得到蕤核叶片总黄酮提取的最佳工艺条件为,超声时间 50.1 min,乙醇浓度59.5%,液料比 24.9∶1和提取温度 72.8℃。在此条件下,模型预测总黄酮得率可以达到 1.149 mg·g-1。
取 2.000 g蕤核叶片样品,在以上最佳条件下提取,重复 3次取平均值,测得蕤核叶片总黄酮得率为 Y=0.151 mg·g-1,与理论值 (1.149 mg·g-1)非常接近,其相对误差为 0.17%,进一步验证了数学回归模型的适合性 (表2)。

表2 最佳工艺条件验证结果
3 结 论
本文在单因素实验的基础上,将响应面法应用于优化超声波提取蕤核叶片中的总黄酮。建立的蕤核叶片总黄酮提取条件优化模型为:Y=0.130+0.051A+0.027B+0.030C-0.033AB+0.033AC+0.034AD-0.078BD-0.078A2-0.106B2-0.048C2-0.038D2。采用此模型在本实验范围内能较准确地预测蕤核叶片中总黄酮得率。
通过实验结果的方差分析可知,在本实验范围内,各因素对蕤核叶片中的总黄酮得率的影响作用大小顺序为超声时间 >液料比 >乙醇浓度 >提取温度。
超声波提取蕤核叶片中总黄酮的最优工艺条件为:超声时间 50.1 min,乙醇浓度 59.5%,液料比24.9∶1和提取温度 72.8℃。在此条件下,总黄酮得率可以达到 1.151 mg·g-1,其总黄酮含量仅次于香椿:1.725 mg·g-1,而比菠菜 (0.102 mg·g-1)、韭菜 (0.062 mg·g-1)和黄花菜 (0.527 mg·g-1)含量都高。实验结果与理论得率极为接近,本实验建立的优化模型对蕤核叶片总黄酮的开发利用具有指导意义。
[1] 中科院中国植物志编委会.中国植物志:第 38卷[M].北京:科学出版社,1986.
[2] 国家药典委员会.中华人民共和国药典:2010版第一部[S].北京:中国医药科技出版社,2010:349.
[3] 李鸿杰.蕤核的繁殖及利用[J].林业实用技术,2002(4):26-27.
[4] 杨福红,赵晓明,张旺军,等.蕤核的研究进展[J].山西农业科学,2008.36(9):94-96.
[5] 朱元龙.优良乡土野生灌木蕤核种子的催芽试验[J].种子,2010,29(1):96-98.
[6] 杨晓盆,张 超,王文梅,等.扁核木光合特性的研究[J].中国生态农业学报,2008,16(4):909-913.
[7] Hu Jun-Yi,QiaoWei,Takaishi Yoshihisa,et al.A New Hemiterpene Derivative from Prinsepia utilis[J].Chinese Chemical Letters,2004,17(2):198-200.
[8] Xu Ying-Qian,Yao Zhi,Hu Jun-Yi,et al.I mmunosuppressive terpenes from Prinsepia utilis[J].Journal of Asian Natural Products Research,2007,9(7):637-642.
[9] Duthie S J,Dobson V L.Dietary flavonoidsprotect human colonocyte DNA from oxidative attack in vitro[J].European Journal of Nutrition,1999,38(1):28-34.
[10] Senderowicz A M.Novel direct and indirect cyclin-dependent kinase modulators for the prevention and treatment of human neoplas ms[J].Cancer Chemother Phar macol,2003,52(Supp1):S61-S73.
[11] Martensa Stefan,MithöferAxel.2005.Flavones and flavone synthases[J].Phytochemistry,2006,66(20):2399-2407.
[12] Santosa Wagna Piler Carvalho,Castro Jacira Teixeira,Bezerra Marcos Almeida,et al.Application of multivariate optimization in the development of an ultrasound-assisted extraction procedure for multiele mental determination in bean seeds samples using ICP OES[J].Microchemical Journal,2008,91(2):153-158.
[13] 梁晓华,徐成东,王陆琴.云南 13种蕨类植物中总黄酮的测定[J].安徽农业科学,2008,36(19):7965-7966.
