多重荧光定量PCR甄别3种霍乱弧菌相关毒素基因*
2011-01-24金大智叶菊莲程苏云
金大智,张 政,罗 芸,叶菊莲,程苏云,吴 方,金 郁
多重荧光定量PCR甄别3种霍乱弧菌相关毒素基因*
金大智1,张 政1,罗 芸1,叶菊莲1,程苏云1,吴 方2,金 郁3
目的 为了判定霍乱弧菌是否携带相关毒力因子,研发一种快速、准确、特异检测霍乱弧菌3种毒素基因的多重荧光定量PCR方法。方法针对霍乱弧菌ctx A、ace、zot基因设计引物和探针,建立PCR体系,对70株霍乱弧菌分离株进行鉴定,采用直接测序方法对鉴定结果进行验证。结果建立的多重实时荧光定量PCR方法可同时准确、特异地鉴定霍乱弧菌菌体携带的3种毒素基因,不携带毒素基因的菌株均未出现阳性检测结果。菌体检测的最低检出限度ctx A基因:102CFU/m L,ace基因和zot基因:10 CFU/m L。构建了3种毒素相关基因阳性质粒,ace基因和zot基因的最低检出限度为10 copies/μL,ctx A基因的最低检出限度为102copies/μL,定量检测批间和批内的变异系数均小于5%;对70株霍乱弧菌分离株进行评价,结果显示其中40株(57.2%)携带ctx A毒素基因、31株(44.3%)携带ace毒素基因、46株(65.7%)携带zot毒素基因,通过测序方法验证,符合率达到100%。结论本文建立的多重实时荧光定量PCR方法操作简便、特异性好、灵敏度高,为霍乱弧菌的现场流行病学调查和疫情监测提供了快速、可靠的鉴定工具。
多重实时荧光定量PCR;霍乱弧菌;毒素
霍乱是由霍乱弧菌引起的急性肠道传染病,是《中华人民共和国传染病防治法》规定的甲类传染病之一,具有发病急、传播快、波及范围广等特点,曾在世界上引起多次大规模流行。主要表现为呕吐、失水、腹泻等症状[1-2]。目前认为只有 O1和 O139血清群霍乱弧菌引起霍乱疫情,主要的致病因素取决于菌体本身携带的生物学特征,霍乱弧菌的毒力因子包括霍乱毒素(Cholera toxin,CT)、小带联结毒素(Zonula occludens toxin,ZOT)、辅助霍乱肠毒素(Accessory cholera enterotoxin,ACE)等[3-4]。在疫情防制过程中,分离的霍乱弧菌是否携带毒素是判定疫情极为重要的参考指标,不携带毒力因子的霍乱弧菌通常致病力不强,仅引起腹泻等轻微临床症状,不会导致大规模流行。因此,对霍乱弧菌菌体携带的毒力因子进行检测、对产毒株与否的鉴定是及时、有效地判断疫情暴发机率和评价疫情严重性的前提和基础,为进一步采取防制措施提供可靠的依据。
目前,霍乱弧菌常规检测以传统培养方法为主,不仅操作繁琐,耗时长,无法判定菌体内是否含有毒力因子。针对霍乱弧菌毒素分子鉴定主要依靠动物实验模型和细胞方法、免疫学实验方法[5-7],实验周期长,动物个体差异较大,可比性不强,操作步骤繁多,而且每次实验只能对一种目标毒素进行检测,无法同时鉴定多种毒素因子,无法达到疫情控制的需要。分子生物学技术能够在很大程度上提高检测效率,目前已经广泛应用于病原菌的检测和毒素基因鉴定领域[8-9]。但是由于菌体携带毒力因子的状况比较复杂,依靠多重荧光定量PCR技术能够通过一次实验操作得到较为完整的菌体携带毒素因子信息。本实验选取霍乱弧菌ctx A(霍乱毒素A亚单位基因)、ace(辅助霍乱肠毒素基因)、zot(小带联结毒素基因)作为检测靶基因,设计引物和标记不同荧光波长基团的Taq Man探针,建立多重实时荧光定量PCR检测霍乱弧菌3种毒素相关基因的方法。
1 材料与方法
1.1 实验菌株 本实验使用的菌株如下:O1群霍乱弧菌小川型、O1群霍乱弧菌稻叶型、O139群霍乱弧菌标准株M045和地方株、非O1、非O139群霍乱弧菌(分离株)及其他传染病相关病原菌如肠产毒性大肠杆菌、肠致病性大肠杆菌、肠侵袭性大肠杆菌、肠出血性大肠杆菌O157∶H7、肠炎沙门菌、伤寒沙门菌、甲型副伤寒沙门菌、乙型副伤寒沙门菌、丙型副伤寒沙门菌、福氏志贺菌、宋内志贺菌、副溶血弧菌、金黄色葡萄球菌、肺炎克雷伯氏菌、小肠结肠炎耶尔森氏菌、空肠弯曲菌、枸橼酸杆菌、金黄色葡萄球菌、河弧菌、产气荚膜梭菌、肠球菌等65株标准菌株或分离株,均由浙江省疾病预防控制中心菌种室提供。
1.2 仪器和试剂 本实验采用MX3000P实时定量PCR仪(Stratagene公司);icycler PCR仪(Bio-Rad公司);比浊仪(法国酶里埃公司);Taq酶、d NTPs等实时荧光定量PCR相关试剂购自上海辉睿生物科技有限公司、大肠杆菌感受态细胞JM109、DNA凝胶回收试剂盒(DV805A)购自宝生物工程(大连)有限公司,p GEM-T试剂(A3600)和质粒提取试剂盒(A7100)购自Promage公司。常规培养试剂等购自法国酶里埃公司。
1.3 模板制备 标准菌株基因组DNA提取:将200μL含有纯细菌的培养液以10 000 r/min离心5 min,弃上清,加入25μL纯水重悬后,煮沸10 min,10 000 r/min离心2min,取上清液作为模板-20℃备用。为了进行灵敏度评价,采用平板稀释法制备系列10倍梯度稀释的标准品。分离株模板制备:采集的样本按照常规方法(卫生行业标准:WS289-2008)进行前增菌,6~8 h后,煮沸裂解10 min,12 000 r/min离心2 min,取上清液作为模板,待用。
1.4 引物和探针设计与合成 针对霍乱弧菌的霍乱毒素A亚单位基因(ctx A)(EF158842)、辅助霍乱肠毒素基因(ace)(AF416590)、小带联结毒素基因(zot)(AF516349),采用 Primer Express 3.0 软件设计引物和探针,PCR产物长度分别为171 bp、150 bp和79 bp。ctx A 基因上游引物F1:5′-AAC GTT AAT GAT GTA TTA GGG GCA T-3′;下游引物R1:5′-GTT ACT GTA ATA TCT ATC TCT GTA G -3′;探 针 P1:5′(HEX)-ATA CTC CCA AAT ATA TGG ATG GT-(BHQ1)-3′;ace基因上游引物 F2:5′-GGA GAT GTC CCA GAA AGT GAT TG -3′;下 游 引 物 R2:5′-CGG GTC ATC AAA GCC TGA AG-3′;探针 P2:5′-(FAM)-TGC TGC CTC CTC AAT ACA GCG GCT-(BHQ1)-3′;zot基因上游引物 F3:5′-CAC CAC GGC TGG GAT ATC TG-3′;下游引物R3:5′-CTA TCT CCG CCG CCT CTC T-3′;探针 P3:5′-(610)-CAC GCC TAA CAT TGC CAA AGT GCA-(BHQ2)-3′,引物和探针均由上海辉睿生物科技有限公司合成并纯化。
1.5 标准质粒构建 参照《分子克隆实验指南》实验方法[10],分别将ctx A、ace和zot基因的PCR片段切胶回收后连接至p GEM-T载体,PCR反应体系和条件如下:PCR反应体系为50μL,包括1(PCR buffer,0.2 mmol/L d NTPs,1.5 mmol/LMgCl2,上游引物:0.5μmol/L,下游引物:0.5
μmol/L,模板DNA 2μL(40~100 ng),Taq酶0.25 U,用dd H2O补足至50μL。PCR反应条件为95℃ 预变性5 min;95℃20 s,55℃20 s,72℃20 s,共40个循环,72℃5min,4℃ ∞。然后将连接PCR片段的载体转化到大肠杆菌感受态细胞JM109中。通过对重组质粒的筛选确定连接3种不同基因PCR片段的阳性转化细菌,菌种采用甘油-80℃保存,质粒提取参照试剂盒说明书。
1.6 多重实时荧光定量PCR扩增 采用矩阵法优化PCR反应体系中的引物、探针浓度和MgCl2浓度等因素,得到合适的浓度比例。荧光定量PCR扩增体系和反应条件:PCR反应体系为25μL,包括1×PCR buffer,0.2 mmol/L d NTPs,5.0 mmol/L MgCl2,F1:0.60μmol/L,R1:0.40μmol/L,F2:0.32μmol/L,R2:0.48μmol/L,F3:0.48μmol/L,R3:0.32μmol/L,P1:0.36μmol/L,P2:0.2μmol/L,P3:0.2μmol/L,模板 DNA 4.0μL(50~200 ng),Taq酶0.25 U,用dd H2O 补足至25μL。PCR反应条件为95℃ 预变性5 min;95℃15 s,60℃45 s,共40个循环,荧光采集在每个循环的退火温度时进行。
1.7 灵敏度和重复性评价 参照《分子克隆实验指南》计算提取的质粒DNA浓度[10],然后10倍梯度稀释成一系列的质粒标准品;将霍乱弧菌标准株采用比浊法参照比浊仪说明书计算公式进行平板计数得到初始浓度(CFU/m L),再制成系列10倍梯度稀释的标准品。选取质粒标准品中高浓度和低浓度的模板,每个模板做3次重复试验,计算不同浓度模板各重复反应CT值之间的变异系数。
1.8 样本分离株检测 本实验共收集70份霍乱弧菌分离株,分别进行实时荧光定量PCR检测和测序鉴定,比较2种方法的结果,进一步评价本文建立方法的可靠性,实验方法同上。
2 结 果
2.1 特异性实验结果 霍乱弧菌携带的霍乱毒素A亚单位基因(ctx A)、辅助霍乱肠毒素基因(ace)、小带联结毒素基因(zot)是判断霍乱弧菌是否为产毒株的重要指标。从BLAST结果可以看出3种毒素相关基因的特异性较高,与其他致病菌携带的毒素基因无同源性。试验中共选取65株标准菌株和分离株对该方法进行特异性评价,结果显示含有3种毒素基因的霍乱弧菌均有特异性荧光信号产生,其中部分菌株只含有1种或者2种靶毒素基因;而其他不携带3种毒素基因的菌株均无阳性荧光信号产生(图1)。上述检测阳性结果通过测序进行验证,测序结果与多重实时荧光定量PCR结果完全一致。实验结果说明本实验筛选的3对引物和探针特异性高,完全符合检测的需要,能够特异性地扩增3种毒素基因,有效地鉴定菌体携带3种毒素基因情况。
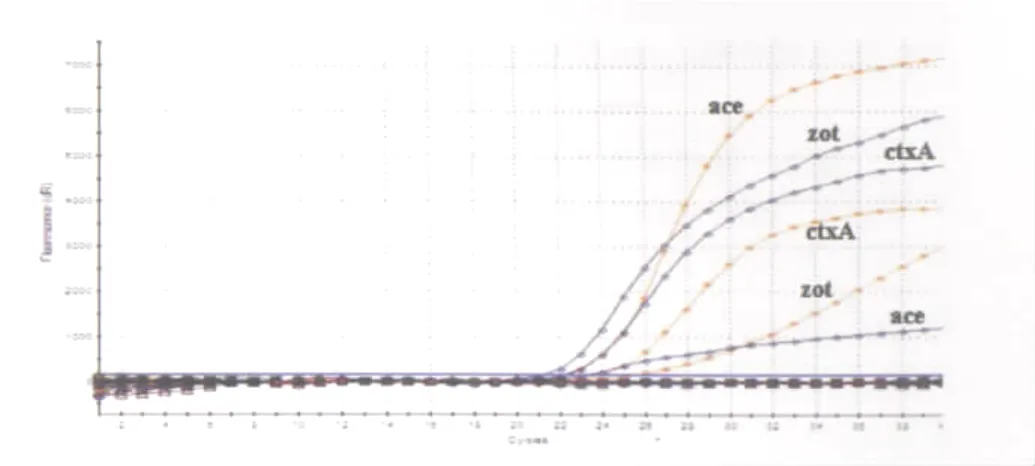
图1 特异性扩增结果Fig.1 Specificity of Vibrio Cholerae
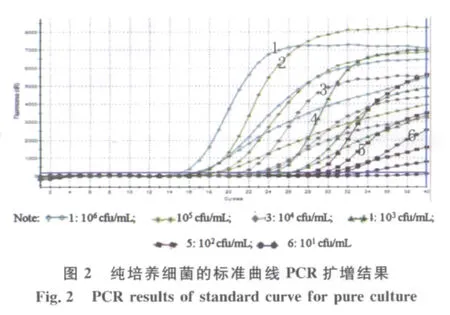
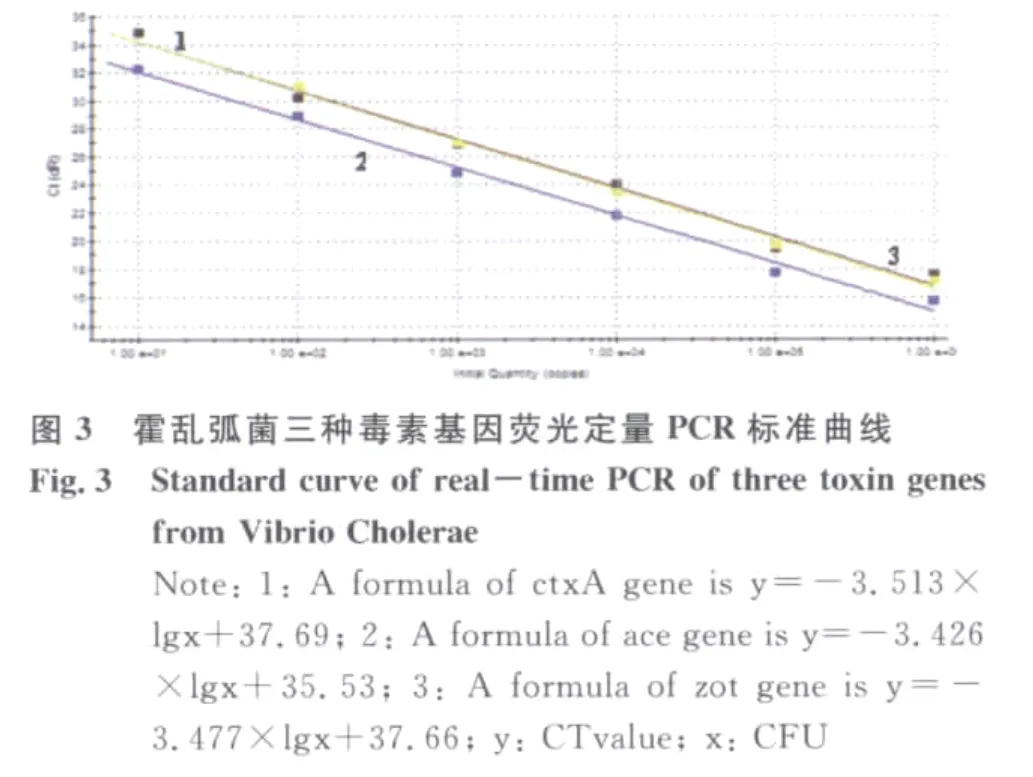
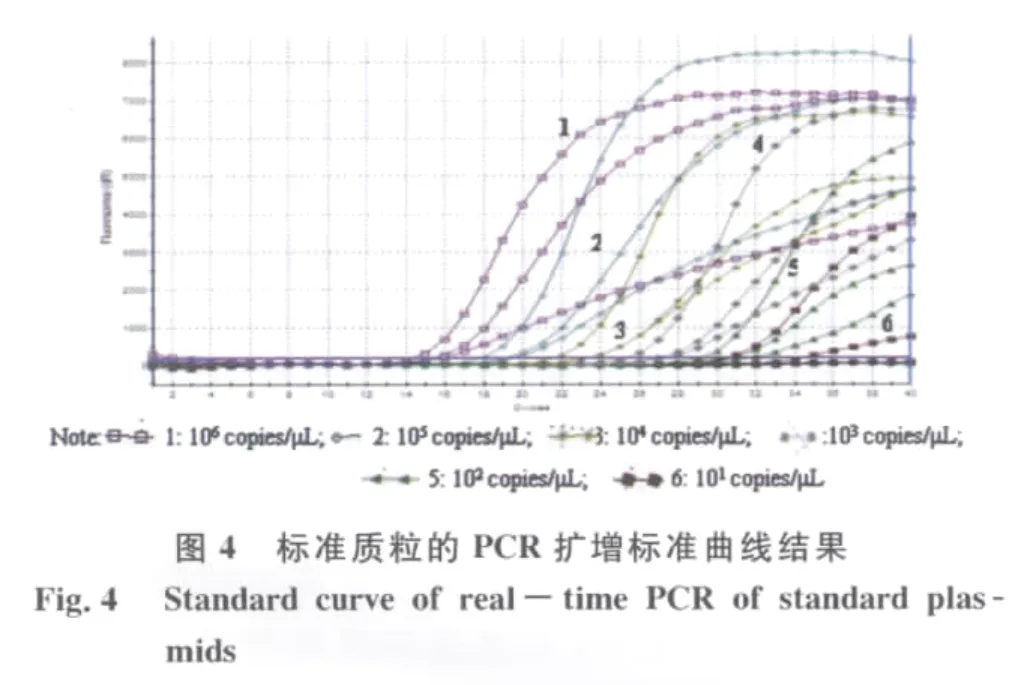
2.2 多重实时荧光PCR检测的灵敏度 按照上述的比浊法进行平板计数的初始浓度,制成系列10倍梯度稀释的标准品,稀释的线性范围为101~106cfu/m L,基因组DNA提取后进行多重实时荧光PCR检测,按照出现明显扩增曲线判定为阳性结果。霍乱弧菌3种毒素(ctx A、ace、zot)基因检测的灵敏度评价结果见图2,结果显示除了ctx A基因检测10 CFU/m L未出现阳性信号外,纯培养霍乱弧菌检测另外2个基因对应的6个梯度其余均出现阳性扩增信号,因此说明本方法检测ctx A的最低限度为102CFU/m L,ace和zot基因的最低检测限度为10 CFU/m L。同时,为了定量分析待检模板的初始浓度,根据每个反应管测定的Ct值与管中所含模板浓度之间的对应关系,绘制成标准曲线,R2分别为0.990、0.993、0.994(图3),从结果可以看出标准曲线的线性关系良好,可以准确的计算出模板浓度。本实验还对质粒DNA标准品的灵敏度进行评价,将10倍梯度稀释的质粒DNA(101~106copies/μL)进行多重实时荧光定量PCR扩增。结果显示浓度为10 copies/μL的ace基因和zot基因阳性质粒均能得到阳性扩增信号,而10 copies/μL的ctx A基因阳性质粒无扩增信号产生。因此,ace基因和zot基因的最低检出限度为10 copies/μL,ctx A基因的最低检出限度为102copies/μL,3个目的基因PCR扩增的R2分别为0.989、0.999和0.999,检测结果见图4,标准曲线结果见图5。从上述实验结果可以看出不管是采用阳性质粒还是采用霍乱弧菌标准株评价灵敏度均获得了较好的线性关系,可以准确地判断PCR反应体系中初始模板的数量。
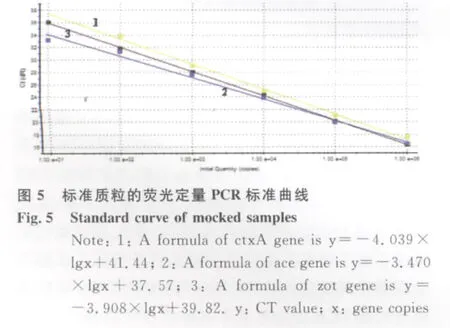
2.3 多重实时荧光定量PCR的重复性 对上述灵敏度评价实验中的10倍系列稀释的霍乱弧菌ctx A阳性质粒、ace阳性质粒和zot阳性质粒分别选取3个不同浓度的模板(106copies/μL、103copies/μL、10 copies/μL),每个浓度做3次重复试验,通过计算Ct值的差异(变异系数,CV)评价多重实时荧光定量PCR方法的重复性和稳定性。计算出不同浓度模板各重复反应Ct值之间的变异系数分别为ctx A基因:0.274%、0.191%、0.235%;ace基因:0.738%、0.692%、0.671%;zot基 因:0.891%、0.938%、0.959%。上述实验结果显示针对3种毒素基因检测反应的CV值均小于5%,说明该实验所建立的方法具有较高的重复性,稳定性好,实验结果可靠。
2.4 霍乱弧菌毒素基因的检测结果 本实验共收集70株霍乱弧菌实际样本分离株,其中包括15株O139群霍乱弧菌、43株O1群霍乱弧菌和12株非O1群/非O139群霍乱弧菌,分别来自外环境和临床病人。采用多重实时荧光定量PCR对收集的70株霍乱弧菌分离株携带3种毒素基因(ctx A、ace、zot)进行鉴定,同时用直接测序的方法验证多重实时荧光PCR检测结果的正确性。结果显示70株霍乱弧菌中,40株(57.2%)携带ctx A毒素基因、31株(44.3%)携带ace毒素基因、46株(65.7%)携带zot毒素基因。31株(44.3%)含有全部的3种毒素基因,其中包括6株O139群霍乱弧菌和25株O1群霍乱弧菌;9株(12.9%)同时携带ctx A毒素基因和zot基因,其中8株O139群霍乱弧菌和1株O1群霍乱弧菌;6株(8.6%)只携带zot基因,其中包括1株O139群霍乱弧菌和5株O1群霍乱弧菌;24株(34.3%)均不携带上述3种毒素基因,其中包括12株非O1群/非O139群霍乱弧菌和12株O1群霍乱弧菌。上述结果通过测序方法验证,符合率达到100%,结果见表1,部分菌株荧光定量PCR扩增结果见图6。
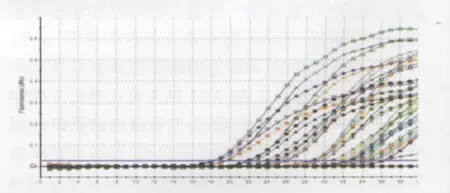
图6 多重荧光定量PCR检测部分样本分离株的结果Fig.6 Results of part of Vibrio Cholerae detected by using multiplex real time PCR
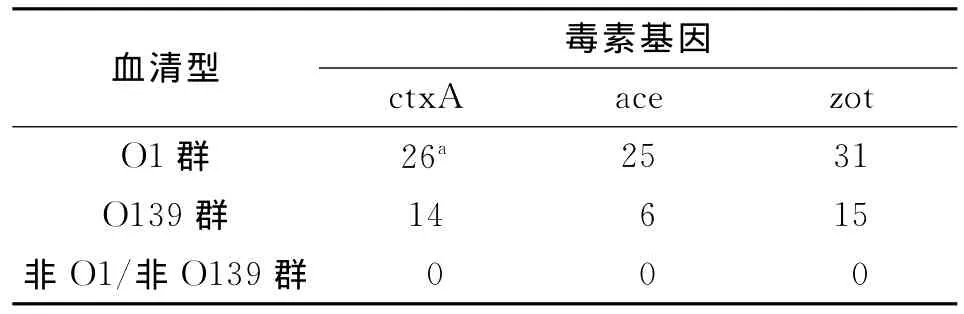
表1 70株霍乱弧菌分离株携带3种毒素基因的检测结果Tab.1 Results of detecting three toxin genes of 70 Vibrio Cholerae isolated from samples
3 讨 论
霍乱弧菌是引起感染者严重腹泻的病原菌,是国家卫生部重点监测的病原体之一,据报道霍乱弧菌已被划分为200多个血清群,但是只有O1群和O139群霍乱弧菌引起疾病大流行[11-12]。菌体是否携带霍乱毒素是判定霍乱弧菌为流行株还是非流行株的重要分子标记,非流行株不能导致疾病大规模流行,只会引起散发性病例。目前,实际工作中霍乱弧菌的诊断和血清学鉴定仍然停留在常规的培养和特异性抗体凝集实验,实验周期长,步骤繁琐,而且只采用普通PCR鉴定霍乱弧菌是否携带霍乱毒素,并没有对其他霍乱弧菌毒素进行检测,使得检测的结果信息不完整,不详细。霍乱弧菌携带的霍乱毒素是最早被确定导致人体腹泻的因子,但是最近的研究发现不携带霍乱毒素的菌体也可以致病,其原因主要是由于菌体产生ZOT、ACE等其他致病相关毒素[13]。因此对霍乱弧菌菌体内携带的多种毒素基因进行鉴定对于流行病学监测来说具有重要意义。
近些年,随着分子生物学技术的快速发展,多项技术(脂质体法、比色生物学检测法和胶体物理和膜生化法等)已经应用到了霍乱弧菌携带相关毒素的鉴定领域[14-17]。在基因诊断方面,主要使用的分子生物学技术有普通PCR、多重PCR、实时荧光定量PCR、Pit-stop半巢式PCR、生物传感器、LAMP技术等,扩增的靶基因分别为ctx A、ctx A2-B、rtx A、eps M、msh A、tcp A、omp W、O1和 O139 rfb、zot和tcp B等[7,18]。随着荧光定量PCR仪器检测通道和标记不同波长的荧光分子种类的不断增多,同时在同一个反应体系中检测的靶基因种类也越来越多,而且目前荧光基团标记的成本较低,使得多重实时荧光定量PCR技术被广泛应用到分子诊断领域。
本实验选取霍乱弧菌ctx A基因、ace基因、zot基因作为检测靶点,设计引物和Taq Man探针,通过BLAST比对和多种标准菌株验证,从图1的结果中可以看出,本实验能够特异性地检测霍乱弧菌的ctx A基因、ace基因、zot基因,其他不携带3种靶基因的菌株均无阳性信号出现,说明本文所建立的方法特异性好,结果准确、可靠。本实验采用矩阵法针对荧光定量PCR反应体系中的引物浓度、探针浓度、MgCl2浓度、退火温度和退火时间等因素进行系统地优化,最终获得合适的反应体系和反应条件。采用标准菌株和重组阳性质粒标准品分别对多重实时荧光定量PCR检测灵敏度进行评价,图2和图3的结果显示针对纯培养霍乱弧菌的检测,ctx A基因检测的灵敏度达到102CFU/m L,ace和zot基因检测的灵敏度达到10 CFU/m L。同时评价重组阳性质粒标准品的灵敏度结果可以看出ctx A基因检测的灵敏度达到102copies/μL,ace和zot基因检测的灵敏度达到10 copies/μL。上述结果表明多重荧光定量PCR体系中,不同的引物和探针之间存在一定的干扰,探针标记的不同荧光基团之间也存在相互的影响,无论是对纯培养细菌还是对重组阳性质粒进行评价,ctx A基因均低于ace和zot基因检测的最低限度。将3对引物和探针分别进行单管扩增时,结果显示检测的灵敏度均可达到10 CFU/m L,说明影响多重PCR反应的因素很多,3对引物和探针存在同一体系中时扩增效率不一致,荧光基团之间相互抑制。在进一步的工作中如在反应体系中再增加引物和探针的数量,需要更系统地对体系中多个因素进行优化,同时需要考虑荧光基团发射荧光的波长,尽量选择波长相差较大的基团,这样会避免荧光的相互干扰。
本实验对70株霍乱弧菌实际样本分离株进行检测,从表1中的结果可以看出40株(57.2%)携带ctx A基因,其中大部分是来源于人源性标本,而且临床腹泻、呕吐等症状比较明显,部分外环境分离的菌株也携带ctx A毒素基因。31株霍乱弧菌携带全部的3种靶毒素基因,9株霍乱弧菌同时携带ctx A毒素基因和zot基因,结果说明菌体携带3种毒素基因的机率较高,无论是从人体标本还是外环境中分离的霍乱弧菌均具有较强的致病性和传播流行能力。结果中还显示6株不携带ctx A毒素基因的菌株携带zot基因,而且样本全部来源于人源,说明在霍乱弧菌携带毒素鉴定的工作中,仅仅检测霍乱毒素是不能满足判定流行趋势的要求[19]。表1中还显示了24株分离株不携带3种毒素基因,其中包括12株非O1群/非O139群霍乱弧菌,这也验证了非O1群/非O139群霍乱弧菌不具备较强的致病能力,但是这并不能说明这类霍乱弧菌对人体无致病力,这些菌株可能携带其他毒素基因。上述结果与直接测序的结果进行比较,符合率达到100%,进一步说明了本实验所建立的鉴定方法准确、可靠、稳定性好。目前,本实验室采用荧光定量PCR等分子生物学技术手段对非O1群/非O139群霍乱弧菌携带毒素基因情况进行调查,寻找这类霍乱弧菌主要导致人体致病的毒素因子。
本实验选取取霍乱弧菌ctx A(霍乱毒素A亚单位基因)、ace(辅助霍乱肠毒素基因)、zot(小带联结毒素基因)作为检测靶基因,建立多重实时荧光定量PCR检测霍乱弧菌3种毒素基因的方法。ctx A基因的最低检出限度为102CFU/m L和102copies/μL,ace基因和zot基因最低检出限度为10 CFU/m L和10 copies/μL,重复性好;对70株霍乱弧菌分离株进行评价,结果显示本方法快速、准确,结果可靠,为流行病学预警和流行趋势判定提供了可靠分析工具,为研究霍乱弧菌菌体携带毒素基因状况分析提供了简便的实验工具。
[1]Chatterjee S,Ghosh K,Raychoudhuri A,et al.Phenotypic and genotypic traits and epidemiological implication of Vibrio cholerae O1 and O139 strains in India during 2003[J].J Med Microbiol,2007,56(Pt 6):824-832.
[2]高守一.霍乱与霍乱弧菌 [J].中华微生物学和免疫学杂志,1994,14 (6):361-364.
[3]Eggy AC,Victor JD.Bacterial virulence gene regulation:an evolutionary perspective[J].Annu Rev Microbial,2000,54:519-565.
[4]Rivera IN,Chun J,Huq A,et al.Genotypes associated with virulence in environmental isolates of Vibrio cholerae [J].Appl Environ Microbiol,2001,67(6):2421-2429.
[5]Gao SY.Prevention and Cure of Cholera[M].fifth Edition.Beijing:Disease Control Bureau of Ministry of Public Health,1999:59-64.
[6]Brenda DS.Structure and Function of Cholera Toxin and the Related Escherichia coli Heat-Labile Enterotoxin[J].Microbiological Reviews,1992,56(4):622-647.
[7]唐宋,阚飙.霍乱毒素检测方法的研究 [J].疾病监测,2008,23(7):447-451.
[8]Lyon WJ.Taq Man PCR for Detection of Vibrio cholerae O1,O139,Non-O1,and Non-O139 in Pure Cultures,Raw Oysters,and Synthetic Seawater[J].Appl Environ Microbiol,2001,67(10):4685-4693.
[9]G mez-Duarte OG,Bai J,Newell E.Detection of Escherichia coli,Salmonella spp.,Shigella spp.,Yersinia enterocolitica,Vibrio cholerae,and Campylobacter spp.enteropathogens by 3-reaction multiplex polymerase chain reaction[J].Diagn Microbiol Infect Dis,2009,63(1):1-9.
[10]Sambrook J,Russell DW.Molecular Cloning.黄培堂,王恒樑,周晓巍,等,译.分子克隆实验指南(精编版)[M].北京:化学工业出版社,2008:29-56.
[11]Matson JS,Withey JH,DiRita VJ.Regulatory networks controlling Vibrio cholerae virulence gene expression [J].Infect Immun,2007,75(12):5542-5549.
[12]Chakraborty S,Mukhopadhyay AK,Bhadra RK,et al.Virulence genes in environmental strains of Vibrio cholerae [J].App Environ Microbiol,2000,66(9):4022-4028.
[13]Trucksis M,Galen JE,Michalski J,et al.Accessory cholera enterotoxin(Ace),the third toxin of a Vibrio cholerae virulence cassette[J].Proc Natl Acad Sci USA,1993,90(11):5267-5271.
[14]Lou H,Liu J,Deng G.The present situation of applications and development prospect of the biosensor in medical sciences[J].Information of Medical Equipment,2006,21(11):41-44.
[15]Edwards KA,March JC.GM(1)-functionalized liposomes in a microtiter plate assay for cholera toxin in Vibrio cholerae culture samples[J].Anal Biochem,2007,368(1):39-48.
[16]Schofield CL,Field RA,Russell DA.Glyconanoparticles for the colorimetric detection of cholera toxin [J].Anal Chem,2007,79(4):1356-1361.
[17]Baksh MM,Jaros M,Groves JT.Detection of molecular interactions at membrane surfaces through colloid phase transitions[J].Nature,2004,427(6970):139-141.
[18]Ewalt KL,Haigis RW,Rooney R,et al.Detection of biological toxins on an active electronic microchip [J].Anal Biochem,2001,289(2):162-172.
[19]曲梅,黄芳,严寒秋,等.Taq Man荧光PCR技术在霍乱弧菌毒力基因检测中的应用 [J].中国预防医学杂志,2008,9:546-549.
Discrimination on three related toxin genes of Vibrio Cholerae using by multiplex real time PCR
JIN Da-zhi,ZHANG Zheng,LUO Yun,YE Ju-lian,CHENG Su-yun,WU Fang,JIN Yu
(Zhejiang Provincial Center for Disease Control and Prevention,Hangzhou 310051,China)
In order to assess Vibrio Cholerae which containing related toxin genes,a rapid,sensitive and specific assay based on multiplex real time PCR was developed in this study.The cholera toxin sub-unit A gene(ctx A),accessory cholera enterotoxin gene(ace),and zonula occludens toxin gene(zot)of Vibrio Cholerae was chosen as targets,and then the primers and Taq Man probe were designed.Furthermore,multiplex real time PCR was applied to detect 70 Vibrio Cholerae isolated from samples,and PCR products were sequenced in order to affirm the results of multiplex real time PCR.The results showed that ctx A,ace and zot gene of Vibrio Cholerae were detected by using multiplex real time PCR accurately and quickly.When other bacteria containing no all three target toxin genes were detected,no positive results appeared.The sensitivity was 102cfu/m L for ctx A gene and 10cfu/mL for ace and zot gene in pure culture.The standard plasmids according to each toxin gene were constructed,and consequently the detection limit of ace gene and zot gene was 10copies/μL and the detection limit of ctx A gene was 102copies/μL.The coefficient of variation of intra-assay and inter-assay was less than 5.0%.When this assay was applied directly to identify 70 Vibrio Cholerae,the results showed that 40 strains(57.2%)were positive to ctx A gene,31 strains(44.3%)were positive to ace gene,and 46 strains(65.7%)were positive to zot gene.The results above were the same to the results obtained from the sequencing assays.The coincidence was 100%.It is demonstrated that multiplex real time PCR is a simple,accurate and feasible assay for discriminating three related toxin genes of Vibrio Cholerae.The assay described here provided a reliable tool for epidemiologic survey and epidemic monitoring.
multiplex real time PCR;Vibrio Cholerae;toxin
1.浙江省疾病预防控制中心,杭州 310051;2.海宁市疾病预防控制中心,海宁 314400;3.辽宁师范大学实验中心,大连 116029
R378.3
A
1002-2694(2011)12-1065-06
*“艾滋病和病毒性肝炎等重大传染病防治科技重大专项”“传染病检测技术研究-传染病病原体诊断和组合检测技术”课题(2008ZX10004-002)和“霍乱弧菌核酸快速甄别方法研究及分子分型数据库的建立”课题 (2010KYB110)联合资助
金大智,Email:dzjin@cdc.zj.cn
2011-06-17;
2011-10-21
