小儿导赤片质量控制方法改进研究
2011-01-24黄云先
黄云先
(云南省丽江市药品检验所,云南 丽江 674100)
小儿导赤片质量控制方法改进研究
黄云先
(云南省丽江市药品检验所,云南 丽江 674100)
目的建立小儿导赤片中大黄、栀子含量测定的高效液相色谱(HPLC)法及栀子的薄层色谱(TLC)鉴别方法。方法用TLC法和HPLC法对小儿导赤片中大黄及栀子进行定性、定量分析。结果TLC色谱中,栀子苷和栀子对照药材斑点清晰。大黄素质量浓度的线性范围为8.096~104.48 μg/mL(r=0.999 9),平均回收率为 98.01%(RSD为 1.25%);大黄酚质量浓度的线性范围为 10.83 ~112.23 μg/mL,r=0.999 9;芦荟大黄素的线性范围为 8.12 ~89.90 μg/mL,r=0.999 8;大黄酸的线性范围为 9.96 ~89.48 μg/mL,r=0.999 8;大黄素甲醚的线性范围为 8.896 ~ 54.44 μg/mL,r=0.999 7;栀子苷的线性范围为 6.771 ~ 141.48 μg/mL(r=1.000 0),平均回收率为 99.04%(RSD为 1.20)。结论定性鉴别方法专属、斑点清晰;含量测定方法可靠,重现性好。
大黄素;大黄酚;芦荟大黄素;大黄酸;大黄素甲醚;高效液相色谱法;栀子;栀子苷;薄层色谱法
小儿导赤片由大黄、栀子、地黄、甘草、茯苓、木通、滑石7味药组方,具有清热利便功效,适用于胃肠积热、口舌生疮、咽喉肿痛、牙根出血、腮颊肿痛、暴发火眼、大便不利、小便赤黄,为治疗小儿实热积滞的常用药。其药品标准中仅有大黄药材的鉴别[1],没有其他药材鉴别和含量测定要求,不能有效地控制药品质量。本试验增加了栀子的薄层色谱(TLC)鉴别,并用高效液相色谱(HPLC)法测定大黄的大黄素、大黄酚、芦荟大黄素、大黄酸、大黄素甲醚含量及栀子的栀子苷含量,结果令人满意。
1 仪器与试药
Dionex summit高效液相色谱仪;Dionex U-3000型紫外检测器;Benchtop Cleaners HS6150D型超声仪;BT 224S型电子天平,BP211D型电子分析天平(德国赛多利斯)。栀子苷对照品(批号为110749-200512)、大黄酚对照品(批号为0796-200208)、大黄素对照品(批号为110756-200110)、芦荟大黄素对照品(批号为110795-200605)、大黄酸对照品(批号为 110757-200206)、大黄素甲醚对照品(批号为110758-200610),均购自中国药品生物制品检定所;甲醇为色谱纯,购自Fisher Scientific公司,水为UP水,其余试剂均为分析纯;薄层板为预制板。小儿导赤片(云南白药集团丽江药业有限公司)。
2 方法与结果
2.1 栀子的TLC鉴别[2]173
取本品10片,研细,加甲醇20 mL,超声处理15 min,滤过,滤液蒸干,加甲醇1 mL使溶解,作为供试品溶液;另取栀子对照药材1 g,加甲醇同法制成对照药材溶液;再取栀子苷对照品,加甲醇制成4 g/L的对照品溶液。照TLC法试验[2]附录31,吸取供试品溶液和对照品液溶各2 μL,分别点于同一硅胶G薄层板上,以醋酸乙酯-丙酮-甲酸 -水(5∶5∶1∶1)为展开剂展开,取出,晾干。供试品溶液色谱中,在与对照药材及对照品溶液色谱相应位置上显相同黄色斑点;再喷以10%硫酸乙醇溶液,在与对照药材溶液及对照品溶液色谱相应位置上显相同颜色的斑点(图1)。
2.2 大黄的含量测定
2.2.1 溶液制备

图1 栀子薄层色谱图
分别精密称取干燥至恒重的大黄素对照品8.32 mg、大黄酚对照品 8.54 mg、芦荟大黄素对照品9.72 mg、大黄酸对照品 8.64 mg 及大黄素甲醚对照品4.29 mg,分别置100 mL量瓶中,用适量甲醇溶解并稀释至刻度,摇匀,得质量浓度分别为 83.2,85.4,97.2,86.4及 42.9 μg/mL的对照品贮备液[3]17;再分别精密量取上述对照品贮备液各2 mL,混匀,即得对照品混合溶液。取本品20片,研细,取细粉约0.3 g,精密称定,置具塞锥形瓶中,精密加入甲醇25 mL,密塞,称定质量,加热回流1 h,放冷,密塞,再称定质量,用甲醇补足减失的重量,摇匀,滤过,精密量取续滤液5 mL,置烧瓶中,挥去甲醇,加8%盐酸溶液10 mL,超声处理5 min,再加氯仿10 mL,加热回流1 h,冷却,移至分液漏斗中,用少量氯仿洗涤容器,洗液并入分液漏斗中,分取氯仿液,酸液用氯仿振摇提取3次,每次10 mL,合并氯仿液,减压回收溶剂至干,残渣用甲醇溶解,转移至10 mL量瓶中,加甲醇至刻度,摇匀,滤过后取续滤液,即得供试品溶液。
2.2.2 色谱条件与系统适用性试验
色谱柱:Shim-pack CLC-ODS色谱柱(250 mm×6.0 mm,5 μm);柱温:30 ℃;流动相:甲醇 -0.1% 磷酸溶液(85 ∶15)[2]17;流速:1 mL/min;进样量:20 μL;检测波长:254 nm。在此条件下,大黄酸、芦荟大黄素、大黄素、大黄酚、大黄素甲醚理论板数分别为3 953,4 148,4 984,5 314,4 945,分离度均大于 1.5,色谱图见图 2。
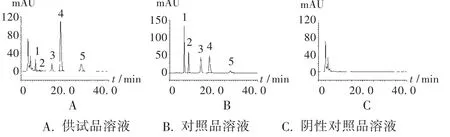
图2 大黄含量测定高效液相色谱图
2.2.3 方法学考察
阴性干扰试验[2]附录31:按处方量制备缺大黄药材的阴性样品,照供试品溶液制备方法制备阴性对照品溶液,依法进样。结果阴性对照品溶液色谱图中,在大黄素、大黄酚、芦荟大黄素、大黄酸、大黄素甲醚色谱峰相应的保留时间无干扰峰出现(图2 C)。
线性关系考察:分别精密吸取大黄素、大黄酚等5种对照品贮备液 2,4,6,8,10 mL,分别置 25 mL 量瓶中,用甲醇稀释至刻度,摇匀,精密量取上述溶液各20 μL,注入液相色谱仪,记录色谱图,测定峰面积。以质量浓度(X)对峰面积(Y)进行线性回归。结果见表1。

表1 大黄含量测定线性关系考察结果(n=5)
精密度试验:取2.2.1项下对照品混合溶液,重复进样5次,记录色谱图,测定峰面积。结果大黄素的RSD为0.12%,大黄酚的RSD为0.20%,大黄酸的RSD为0.40%,芦荟大黄素的RSD为0.37%,大黄素甲醚的RSD为0.56%。
稳定性试验:取同一供试品溶液(批号为011307002),室温下放置,分别于 0,2,4,6,8 h 时进样,分别测定峰面积。结果大黄素的RSD为0.15%,大黄酚的RSD为0.32%,大黄素甲醚的RSD为0.55%,大黄酸的RSD为0.60%,芦荟大黄素的RSD为0.23%。
重复性试验:取同一批(批号为011307002)样品5份,依法测定含量。结果平均含量大黄素为1.104 mg/g(RSD=0.64%),大黄酚 为 1.420 mg/g(RSD=0.22%),大 黄 素 甲 醚 为 0.624 mg/g(RSD=0.78%),大黄酸为 1.717 mg/g(RSD=0.47%),芦荟大黄素为0.019 mg/g(RSD=1.11%),表明方法重现性良好。
加样回收试验:取已知含量的样品(批号为01307002)约0.3 g,精密称定,共5份,精密加入大黄素、大黄酚、大黄素甲醚、大黄酸、芦荟大黄素对照品,测定含量,计算回收率,结果见表2。

表2 大黄素、大黄酚、大黄素甲醚、大黄酸、芦荟大黄素加样回收试验结果(n=5)
2.2.4 样品含量测定
分别吸取对照品混合溶液与供试品溶液各20 μL,注入液相色谱仪,测定峰面积,用外标法计算含量。结果样品中大黄各组分总含量见表3。
2.3 栀子的含量测定
2.3.1 溶液制备
分别精密称取干燥至恒重的栀子苷对照品6.13 mg,置100 mL量瓶中,用适量甲醇溶解并稀释至刻度,摇匀,得质量浓度为0.061 3 g/L的对照品贮备液,精密量取5 mL,置10 mL量瓶中,加甲醇至刻度,摇匀即得对照品溶液。取本品20片,研细,取细粉约0.3 g,精密称定,置具塞锥形瓶中,精密加入甲醇25 mL,密塞,称定质量,超声处理20 min,放冷,密塞,再称定质量,用甲醇补足减失的质量,摇匀,滤过,精密量取续滤液10 mL,置25 mL量瓶中,加甲醇至刻度,摇匀,即得供试品溶液。

表3 样品含量测定结果(n=4)
2.3.2 色谱条件与系统适用性试验[3]173
色谱柱:Shim-pack CLC-ODS色谱柱(150 mm×6.0 mm,5 μm);柱温:30 ℃;流动相:乙腈 - 水(15 ∶85);流速:1 mL/min;进样量:20 μL;检测波长:238 nm。在此条件下,栀子苷理论板数为8 117,分离度大于 1.5,色谱图见图 3。
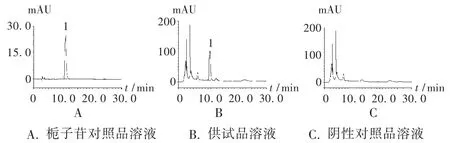
图3 栀子含量测定高效液相色谱图
2.3.3 方法学考察
阴性干扰试验:按处方制备缺栀子药材的阴性对照品溶液,进样测定。结果阴性对照品溶液色谱中,在栀子苷色谱峰相应的保留时间无干扰峰出现(图3 C)。
线性关系考察:分别精密吸取栀子苷对照品溶液2,4,6,8,10 mL,分别置25 mL量瓶中,用甲醇稀释至刻度,摇匀,精密量取上述溶液各20 μL,注入液相色谱仪,记录色谱图,测定峰面积。以质量浓度(X)对峰面积(Y)进行线性回归,回归方程为Y=90 057X-3 625,r=0.999 9(n=5)。结果表明栀子苷质量浓度在 0.490 4 ~24.52 μg/mL范围内与峰面积线性关系良好。
精密度试验:取同一栀子苷对照品溶液,重复进样5次,记录色谱图。结果峰面积的RSD为0.88%(n=5)。
稳定性试验:取同一供试品溶液(批号为011307002),室温下放置,分别于 0,2,4,6,8 h时进样,测定峰面积。结果的RSD为0.86%(n=5)。
重复性试验:取同一批(批号为011307002)的样品5份,依法测定含量。结果平均含量为 1.491 1 mg/g,RSD为 1.54%(n=5),表明方法重现性良好。
加样回收试验:取已知含量的样品(批号为011307002)约0.3 g,精密称定,共5份,置具塞锥形瓶中,分别精密加入栀子苷对照品,按供试品溶液制备方法操作及样品测定项下方法测定含量,计算回收率。结果见表4。

表4 栀子苷加样回收试验结果(n=5)
2.3.4 样品含量测定
分别吸取2.3.1项下的对照品混合溶液与供试品溶液各20 μL,注入液相色谱仪,测定峰面积,用外标法计算含量。结果见表5。
3 讨论
用TLC法鉴别小儿导赤片中栀子,斑点清晰,专属性强,且操作简便。
通常大黄蒽醌类成分的检测波长为254 nm,选用该波长时,其他组分及辅料无干扰。
样品用甲醇超声处理后直接进样所得色谱基线波动较大,分离度差,且提取不完全,测得的含量低[3-5]。本试验先后用甲醇、氯仿作溶剂,并采用超声、加热回流、酸水解后提取的方法,大黄中的蒽醌类成分已基本提取完全,测得的含量高。
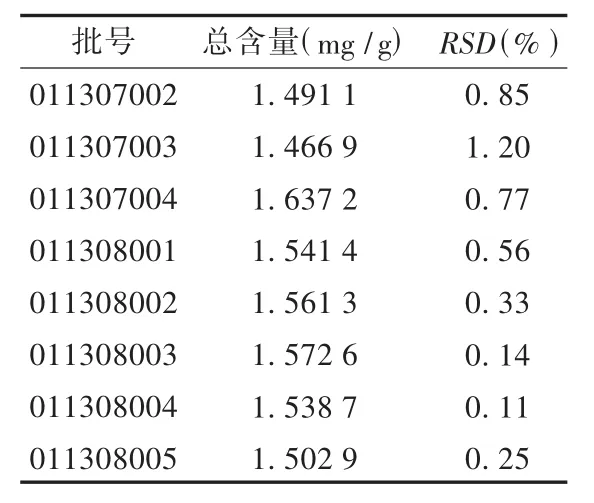
表5 样品含量测定结果(n=4)
方法学考察结果表明,用HPLC法测定该复方制剂的大黄中大黄素、大黄酚、大黄素甲醚、大黄酸、芦荟大黄素总含量,方法及栀子的栀子苷含量,方法简便可靠,分离度好,结果稳定。
[1]WS3-B-3537-98,卫生部药品标准·中药成方制剂(第十九册)·小儿导赤片[S].
[2]国家药典委员会.中华人民共和国药典(一部)[M].北京:化学工业出版社,2005.
[3]肖培根.新编中药志(第一卷)[M].北京:化学工业出版社,2002.
[4]方 彬,吕风莲,刘传玲,等.高效液相色谱法测定虎杖中大黄素的含量[J].中国药师,2005,19(2):106 -107.
[5]张玉臣,刘学东,王永平,等.HPLC测定大黄颗粒中大黄素和大黄酚的含量[J].中国药师,2005,19(3):158 -159.
Study on Determination of Rhubarb and Gardenia in Child Daochi Tablets by HPLC and Identification of Gardenia by TLC
Huang Yunxian
(Lijiang Institute for Drug Control,Lijiang,Yunnan,China674100)
ObjectiveTo establish a HPLC determination method for rhubarb and gardenia in the Child Daochi Tablets and a TLC identification method for gardenia.Methods The TLC and HPLC methods were adopted to perform the qualitative and quantitative analysis on rhubarb and gardenia in Child Daochi Tablets.Results The spots of the comparison medicinal material for gardenoside and gardenia were fairly clear by TLC identification.In HPLC quantitative analysis,the linear range of emodin was 8.096 -104.48 μg/mL(r=0.999 9),the average recovery rate was 98.01%(RSD=1.25%);the linear range of chrysophanol was 10.83 - 112.23 μg/mL(r=0.999 9);the linear range of aloe - emodin was 8.12 -89.90 μg/mL(r=0.999 8);the linear range of rhein was 9.96 -89.48 μg/mL(r=0.999 8);the linear range of physcion was 8.896 - 54.44 μg/mL(r=0.999 7);the linear range of geniposide was 6.771 - 141.48 μg/mL(r=1.000 0),the average recovery rate was 99.04% (RSD=1.20).Conclusion The qualitative identification method is exclusive with clear spots;the content determination method is reliable with good reproducibility,which provides the basis for the quality control and evaluation of Child Daochi Tablets.
emodin;chrysophanol;aloe-emodin;rhein;physcion;HPLC;gardenia;geniposide;TLC
R284.1;R286.0
A
1006-4931(2011)02-0036-03
2009-06-29;
2010-05-24)
