拟南芥多效性基因CPR5转化水稻中花11的研究*
2011-01-24王亚琴陈兴瑶阳成伟
王亚琴,陈兴瑶,阳成伟
(1.华南理工大学生物科学与工程学院,广东 广州 510006;2.华南师范大学生命科学学院//广东省植物发育生物工程重点实验室,广东 广州 510631)
拟南芥CPR5基因 (AtCPR5)是一个多 效性基因,在拟南芥抗病性、细胞增殖、细胞衰老、细胞死亡、蔗糖的感受、茉莉酸途径、脱落酸途径、膜蛋白的编辑、细胞壁形成等方面发挥重要的作用[1-5]。此外AtCPR5基因还影响拟南芥细胞壁的形成及表皮毛的发生[5]。最近的研究发现AtCPR5与拟南芥的耐热性密切相关,过量表达AtCPR5能提高拟南芥的耐热性,而且初步阐明其调节机制可能是通过上调热激蛋白hsp17.6的表达而间接提高了拟南芥的耐热性[6]。
水稻Oryza sativa是世界上分布最广、最重要的的粮食作物之一,其遗传转化育种在抗虫、抗病、抗除草剂、抗旱、耐盐、改善品质、提高产量等方面都有应用[7],但在水稻耐高温等方面研究较少。水稻生长的最适温度为25~31℃[8],在生长和发育的各个时期均对高温胁迫敏感[9-10]。目前,伴随全球工业化进程的加速,温室效应的加剧,21世纪全球温度预计会升高1.5~4.5℃,高于20世纪3~9倍[11]。而日平均气温每升高1℃,水稻产量至少下降10%[12],极端高温出现频率大幅度提高会给水稻等农作物的安全生产带来极大的隐患[13]。尤其近几年我国南方和西南大部分地区高温干旱导致水稻产量骤减。因此,开展水稻耐热性研究以培育水稻耐高温品种已成为当前水稻遗传育种的重要课题,这对稳定水稻产量具有重大意义。本文利用近年来水稻遗传转化中常用品种中花11(Oryza sativa L.subsp.japonica)为材料,利用根癌农杆菌介导法将pHQSN1-AtCPR5转化水稻愈伤组织,获得转基因植株,为水稻耐高温品种的选育作一基础性研究。
1 材料和方法
1.1 材料
1.1.1 植物材料 中花11(Oryza sativa L.subsp.japonica)成熟胚,由中国科学院华南植物园提供。野生型 (Columbia生态型)拟南芥Arabidopsis thaliana购于美国拟南芥生物资源中心 (Arabidopsis Biological Resource Center,USA),经繁殖后用于实验。
1.1.2 质粒和菌种 pMD20-T vector:TaKaRa,Guangzhou,China.pHQSN1质粒、E.coli DH5α 大肠杆菌、EHA105根癌农杆菌:由华南师范大学提供。
1.1.3 培养基 大肠杆菌和农杆菌活化培养分别采用LB和YEP固体培养基[14-15];农杆菌工程菌液的制备采用 AAI液体培养基[15],附加200 μmol/L AS。愈伤组织诱导和继代培养基 (NBB):N6大量元素+B5微量元素+B5有机成份+2 mg/L 2,4-D+0.3 g/L水解酪蛋白+0.5 g/L脯氨酸+30 g/L蔗糖+3.5 g/L植物凝胶,PH 5.8。
共培养基:NBB+0.3 g/L水解酪蛋白+0.5 g/L 脯氨酸+2 mg/L 2,4-D+200 μmol/L AS+10 g/L葡萄糖+30 g/L蔗糖+3.5 g/L植物凝胶,pH 5.5。
选择培养基:NBB+1 g/L水解酪蛋白+1 g/L脯氨酸+2 mg/L 2,4-D+30 g/L蔗糖+50 mg/L Hyg(潮霉素)+500 mg/L Cef(头孢霉素)+3.5 g/L植物凝胶,pH 5.8。
预分化培养基:MS培养基+1 g/L水解酪蛋白+2 mg/L 2,4-D+50 mg/L Hyg+20 g/L蔗糖+3.5 g/L植物凝胶,pH 5.8。
分化培养基:N6大量元素+MS微量元素+B5有机成分+5 mg/L 6-BA+1 mg/L NAA+50 mg/L Hyg+15 g/L蔗糖+3.5 g/L植物凝胶,pH 5.8。
生根培养基:1/2 MS培养基+30 g/L蔗糖+1 mg/LIBA+3.5 g/L植物凝胶,pH 5.8。
1.2 方法
1.2.1 AtCPR5基因的扩增和植物双元表达载体的构建 提取野生型拟南芥叶片RNA,设计带有BamH I酶切位点的两个引物 (CPR5-F:5'-GG ATCCCATGGAAGCCCTCCTCCT-3';CPR5-R:5'-GGATCCTCAAGCATAGTCAGACCCACC AT-3'),进行AtCPR5基因 (1 695 bp)的扩增。将AtCPR5目的片段与pHQSN1表达载体 (图1)连接,形成重组质粒pHQSN1-AtCPR5。
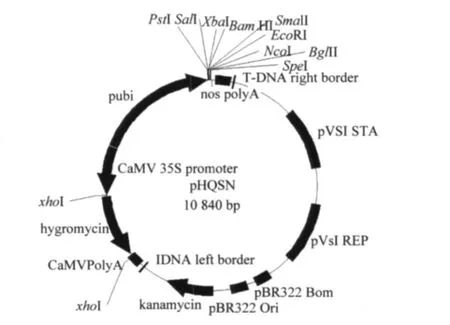
图1 植物双元表达载体pHQSN1示意图Fig.1 The plant expression binary vector of pHQSN1
1.2.2 水稻再生体系的建立 选取籽粒饱满、大小一致的中花11成熟种子,37℃烘12 h,去壳,表面消毒后接种于诱导培养基上,每平板接种约30个成熟胚。
为探索愈伤组织诱导和再生适宜的温度和光照条件,设计27℃、暗,27℃、光 (光强为80 μmol·M-2·s-1),32 ℃、暗,32℃、光4个对照实验,每个处理做15个重复。诱导7 d后,随机各取10个平板统计愈伤组织诱导率。同时剥下由成熟胚盾片处长出的颗粒状胚性愈伤组织,分别置于4种条件下继代培养。7 d继代一次,继代两次。将上述4种条件下继代两次的愈伤组织分别接入预分化培养基,27℃、暗培养5~6 d后,27℃、16 h光/8 h暗培养7~8 d。然后接入分化培养基,27℃,16 h光/8 h暗培养7~10 d后即可成苗。待苗长至3 cm左右时移至生根培养基,当幼苗长出较多的新根后炼苗,移栽大田种植。
此外还以6-BA和NAA的不同浓度组合筛选了最适的分化培养基。
1.2.3 根癌农杆菌介导的水稻遗传转化 根癌农杆菌培养、转化参照李美茹等[15]方法,并稍作改进。浸染时根癌农杆菌A600≈0.05~0.1;共培养基上添加1张用AAI培养液浸湿的无菌滤纸,26℃、暗培养3 d。筛选培养时先进行30 mg/L的潮霉素选择培养,约10 d后将新鲜愈伤组织转移至50 mg/L的潮霉素选择培养基上进行第二次抗性筛选。筛选的培养条件为32℃、持续光照培养。抗性愈伤组织的预分化和分化,方法同1.2.2。
1.2.4 转基因水稻的分子检测
(1)转基因水稻的PCR检测。
用冷冻研磨SDS法分别提取WT和转化植株总DNA,进行AtCPR5基因全长和潮霉素基因片段(500 bp)的PCR检测。潮霉素基因片段引物序列如下:
HPT-F:5'- ATGAAAAAGCCTGAACTCACCGC-3'
HPT-R:5'- TCCATCACAGTTTGCCAGTGATA-3'
扩增潮霉素基因片段PCR反应条件:94℃ 5 min;95℃ 30 s;58℃ 30 s;72℃ 1 min,30次循环;72℃ 10 min,4℃ 10 h。
(2)转基因水稻的Southern blot检测。
大量提取PCR反应呈阳性的水稻苗总DNA,用BamH I酶切,电泳,转膜后分别与地高辛标记的AtCPR5基因 (探针长度549 bp)、HPT基因探针 (探针长度600 bp)杂交,具体步骤见Roche公司的试剂盒使用说明书。
(3)转基因水稻的半定量RT-PCR检测。
使用TaKaRa公司的RNAiso Plus试剂,分别提取WT和鉴定为阳性植株的总RNA,用DNA酶进行酶解以去除基因组DNA。以水稻actin基因做内参,CPR5-F和CPR5-R为扩增引物,对AtCPR5基因在转基因植株中的表达情况做半定量检测。
2 结果与分析
2.1 温度和光照对愈伤组织诱导的影响
在4种处理条件下诱导的成熟胚,其诱导率的差异很大。其中32℃条件下诱导的成熟胚在第3 d就会长出愈伤组织,同时看到胚芽形成,而27℃条件下诱导的成熟胚出愈时间会延迟1~2 d。诱导7 d后统计诱导率见表1。从表1可以看出,32℃培养相比27℃培养诱导率提高约40%,其中32℃、光照培养诱导率最高,而且愈伤组织生长速度快,体积增长明显 (图2),用少量的种子即可获得足够多的材料用于转化。这与于洋等[16]报道的高温培养更有利于成熟胚诱导的愈伤组织早期生长的结果相符。同时从表1还可以看出,相同温度下,光照和黑暗对愈伤组织的诱导影响不大,而温度对愈伤组织的培养影响却较大。32℃、光照培养条件下的愈伤组织干爽,出愈时间提早,诱导率高,是愈伤组织诱导培养的最佳条件。
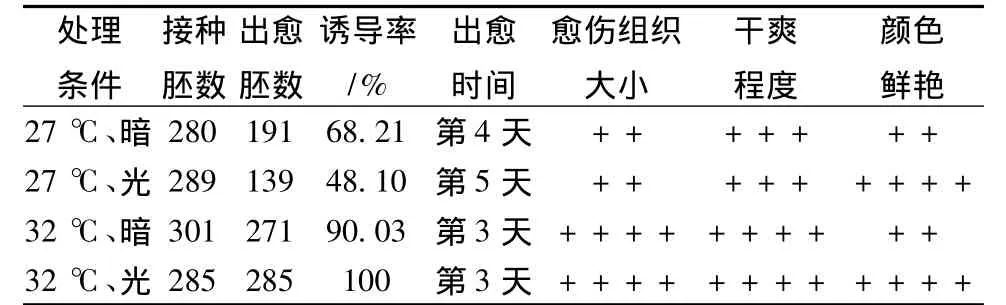
表1 温度和光照对愈伤组织诱导的影响1)Table 1 The effect of temperature and light on callus induction

图2 不同温度、光照条件下诱导的愈伤组织Fig.2 Calli induced under different temperature and light(诱导第28天拍照)

表2 温度和光照对愈伤组织分化和再生的影响1)Table 2 The effect of temperature and light on callus differentiation and shoot regeneration
2.2 温度和光照对愈伤组织继代生长的影响
愈伤组织分别在4种条件下继代培养14 d后,光照条件下继代生长的愈伤组织颜色淡黄,较暗培养的颜色深;27℃培养的愈伤组织较湿润、质地较松散,而32℃培养的愈伤组织体积增长明显,干爽、较紧凑,颗粒较大而不易破碎,这样的愈伤组织胚性好,更有利于浸染和分化再生 (图3)。
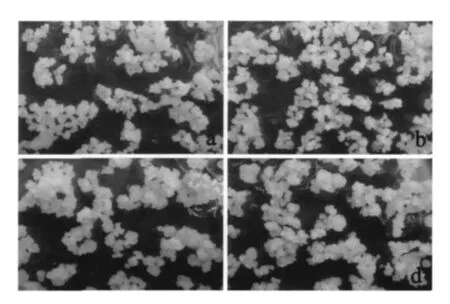
图3 不同温度、光照条件下继代的愈伤组织Fig.3 Calli subcultured under different temperature and light(继代第14天拍照,a:27℃,暗;b:27℃,光;c:32℃,暗;d:32℃,光)
2.3 温度和光照对愈伤组织再生的影响
4种不同诱导和继代处理条件下的愈伤组织经过相同条件的预分化和分化培养后,统计分化率和再生率 (表2)。27℃和32℃条件下培养的愈伤组织分化率均达到90%以上,两者无明显区别,但32℃条件下愈伤组织再生率约90%,比27℃条件下的再生率提高约40%。而且32℃、光照条件下的愈伤组织分化率和再生率均比32℃、暗培养高。说明适当提高温度可以提高愈伤组织再生率,这一结果与于洋等[16]的报道相符。从图4可以看出,32℃、光照培养的愈伤组织在分化培养基上几乎都能分化成苗,相比传统的26~28℃、暗培养的条件,32℃、光照培养不仅可以提高诱导率、缩短诱导周期,而且分化成苗率高。

图4 32℃、光照条件下诱导和继代的愈伤组织在分化培养基上的分化和再生Fig.4 Differentiation and regeneration of calli induced and subcultured under the condition of 32℃and light
2.4 不同的激素配比对水稻愈伤组织分化和再生的影响
通过上述试验确定32℃、光照培养为愈伤组织诱导和继代培养的最佳条件,为进一步研究外源激素6-BA和NAA对愈伤组织分化和再生的影响,从而优化分化培养基,提高再生率。我们将32℃、光照培养条件下继代两次的愈伤组织预分化后,分别接种于不同激素配比的分化培养基,培养20 d统计分化率和再生率 (表3)。
结果表明,随着6-BA和NAA质量浓度的提高,水稻愈伤组织分化率和再生成苗率也提高,其中两者组合质量浓度分别为5 mg/L和1 mg/L时愈伤组织分化率和再生率达到最高。其中6-BA是诱导植株再生所必需的外源激素,较高质量浓度的6-BA可以诱导更多植株再生,但如果6-BA质量浓度过高,会导致植株发生玻璃化现象[26],而NAA能加速愈伤组织的生长,增加细胞数量,积累特异蛋白、糖等必要物质,因此,只有两者分别以5 mg/L和1 mg/L质量浓度组合时可使愈伤组织达到较优的再生效果。
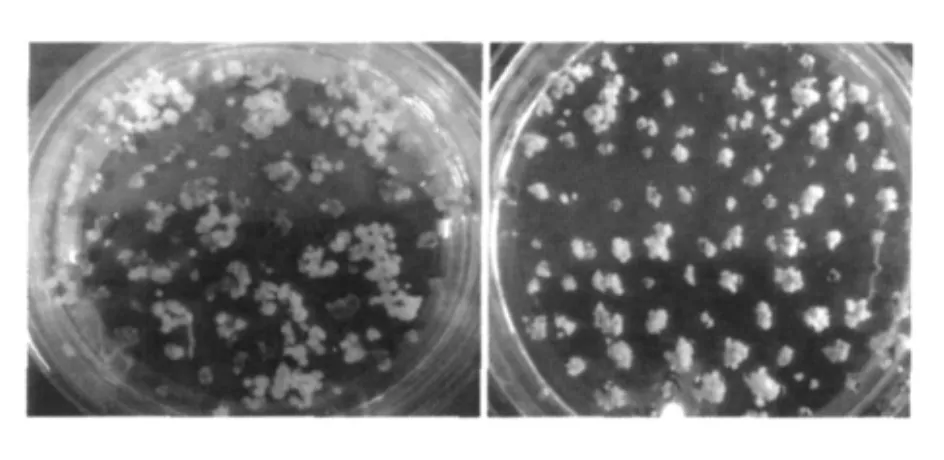
图5 愈伤组织的抗性筛选Fig.5 Resistant selection of calli(左图为筛选培养30 d;右图为筛选培养18 d)
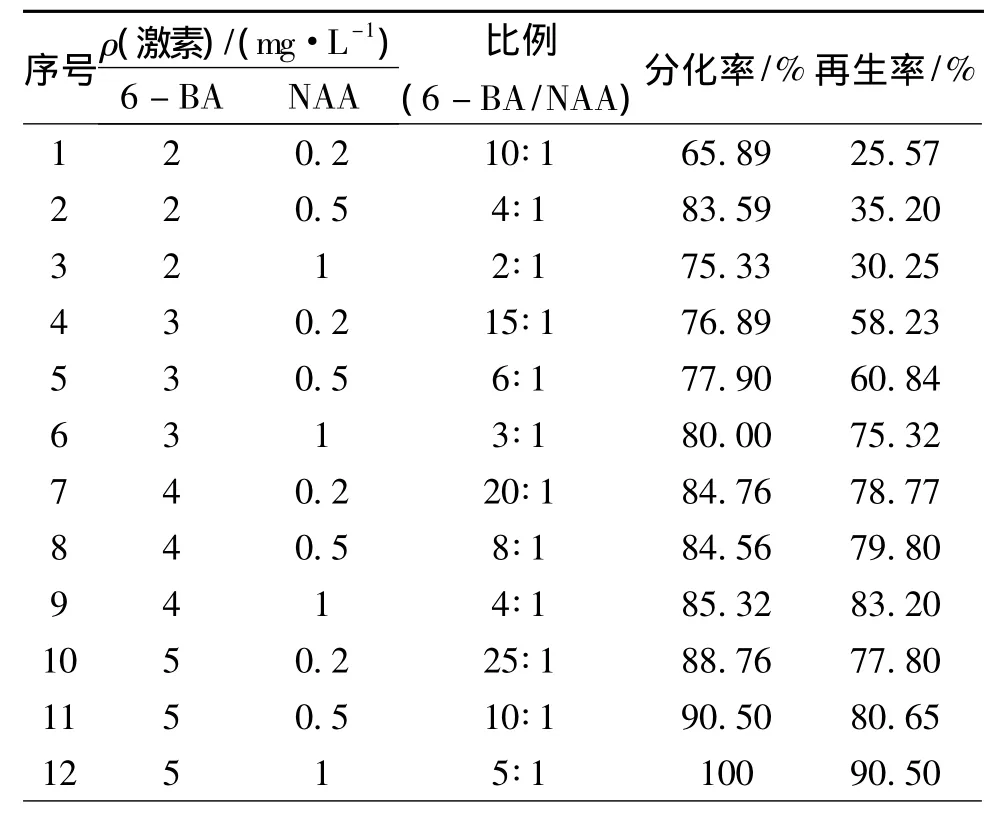
表3 不同植物激素配比对愈伤组织分化及再生的影响Table 3 The effect of different phytohormone concentration on callus differentiation and shoot regeneration
2.5 抗性植株的获得
利用根癌农杆菌浸染愈伤组织后,先进行低质量浓度潮霉素 (30 mg/L)的抗性筛选,这有助于促进浸染后愈伤组织细胞的恢复生长。且采用32℃、持续光照的条件,有助于除去共培养后的农杆菌,降低染菌率,促进细胞分裂生长,使抗性愈伤组织获得率达到90.58%(图5)。筛选后的抗性愈伤组织经过再生培养后,共获得80株T0代抗性水稻植株 (图6)。
2.4 转基因水稻的分子检测
2.4.1 转基因水稻的PCR检测 随机选取20株T0代抗性植株提取DNA,进行PCR扩增。结果表明,未转化的对照无特异性条带,而20株T0代抗性植株均扩增出1 695 bp(图7 a)和500 bp(图7 b)的特异性条带,可初步确定AtCPR5已整合到抗性植株的基因组中。
图6 抗性愈伤组织再生 (左图)和抗性苗生根培养 (右图)Fig.6 Regeneration of resistant calli(the left)and rootage of resistant plantlets(the right)
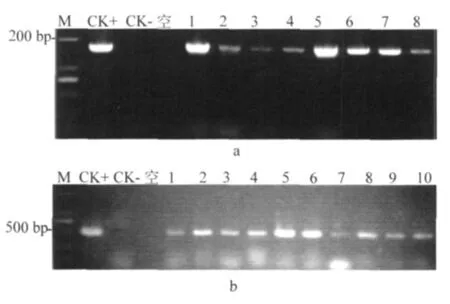
图7 T0代转基因植株的PCR检测Fig.7 PCR detection of T0transgenic plantlets.M:Maker DL2000;CK+:阳性对照 (质粒);CK-:
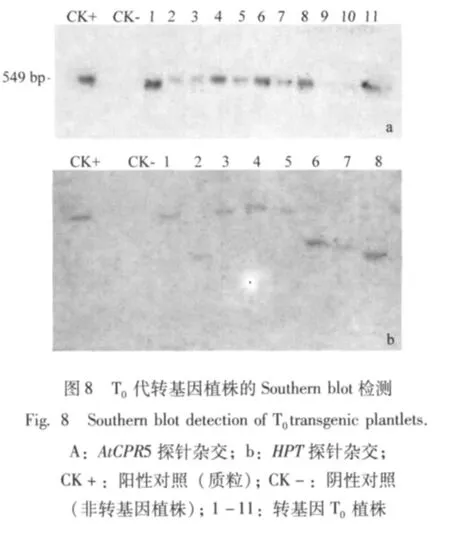
2.4.2 转基因水稻的Southern blot检测 经地高辛标记的AtCPR5基因探针和HPT基因探针杂交检测,转基因植株显示出特征杂交带,未转基因植株则没有杂交带。而且PCR检测呈阳性的样品在Southern杂交中均为阳性,而且是单拷贝插入。
2.4.3 转基因水稻的半定量RT-PCR检测 为检测AtCPR5基因在转基因水稻中的转录表达,分别提取8株转基因水稻的总RNA进行半定量RT-PCR检测。8株转基因水稻均能扩增出1 695 bp的特异性条带,而未转化水稻没有扩增出任何条带 (图8),说明AtCPR5在此8株转基因水稻中均有不同程度的转录表达,其中在第5和第8号植株中表达较弱。

3 讨论
目前,在完善水稻再生体系研究中,对培养基种类[17-19]、外植体选择[20-21]、基因型[22-23]、光照条件等研究报道较多[24-25]。但是水稻作为一种喜温作物,温度对其组织培再生也是一个非常重要的制约因素。人们在利用水稻成熟胚进行再生培养时常将培养条件设定为26~28℃,暗培养[26]。2006年,Seiichi Toki等[27]发现,32℃,光照培养1 d的日本晴成熟种子可直接用于农杆菌浸染,建立了一套适合于日本晴的农杆菌早期浸染水稻成熟胚快速转化体系,一个月内就可获得转基因植株,转化效率为28.6%。本研究通过根癌农杆菌浸染32℃、光照条件下诱导和继代培养的愈伤组织,转化效率可达到90%,从愈伤组织诱导到获得转基因抗性苗约2个月,相比传统条件下3~4个月的水稻转化周期,可以节省1~2个月;相比Seiichi Toki等人的早期浸染水稻成熟胚快速转化法,虽然周期多一个月,但转化效率得到了较大的提高。苏益等[28]为验证Seiichi Toki等人的快速浸染转化法是否适用于中花11成熟胚转化,在愈伤组织预培养时间、浸染时间和凝固剂等方面做了改进,40 d即可获得水稻转基因植株,转化效率和再生效率分别为71.3%和57%。而本试验获得的愈伤组织在优化的预分化和分化培养基上培养约25 d后,再生率和分化率可达到90%以上,相比苏益等人的研究成果,转化率和再生率分别提高近20%和30%。因此,本研究建立起了一套新的适合于中花11再生和转化的体系。利用此体系,笔者还进行了OsCPR5基因、OsphyA基因转化中花11的研究,用于研究两个基因的过量表达和RNAi干扰等。结果均表明,该方法具有可行性、稳定性、高效性,适合于水稻中花11的遗传转化研究。
在根癌农杆菌介导的遗传转化方面,目前的文献研究使用的根癌农杆菌菌液A600常为0.1~1.5,转化率约为50% ~80%(粳稻)。但本实验中使用的菌液A600为0.05~0.1,转化效率高达90%,此浓度范围既可保证较高的转化效率,又可避免因农杆菌浓度过高,导致愈伤组织染菌死亡。同时我们发现共培养时添加1张用AAI培养液浸湿的无菌滤纸,不仅可以有效抑制农杆菌过度生长,而且浸染后的愈伤组织状态较未添加滤纸的状态好,抗性愈伤组织获得率可提高到90.58%,这与黄健秋等[29]的报道相符。
本试验前期的研究证明拟南芥多效性基因CPR5具有耐热功能[6],为了研究水稻的耐热性以期选育耐高温品种,我们将此基因转化水稻获得转化植株,拟检验AtCPR5基因能否在水稻中发挥耐热功能或者其他抗逆功能,从耐热生理指标方面检测转基因植株的耐热能力从而选育耐高温品种(数据在整理中);同时我们从水稻中克隆了AtCPR5的同源基因,命名为OsCPR5。构建了其启动子表达载体以及OsCPR5基因的过表达和RNAi载体,获得了相应的转化植株,研究水稻内源CPR5基因在水稻中的表达情况[30],通过RNAi转化植株和过表达转化植株在各种胁迫下生理指标的测定,来验证OsCPR5基因是否具有拟南芥CPR5基因在抗病、抗逆、耐热方面相似的功能,全面解析OsCPR5基因的功能及作用机理。
[1]BOCH J,VERBSKY M L,ROBERTSON T L,et al.Analysis of resistance gene-mediated defense responses in Arabidopsis thaliana plants carrying a mutation in CPR5[J].Mol Plant-Microbe Interact,1998,11:1196 -1206.
[2]KIRIK V,BOUYER D,SCHOBINGER U,et al.CPR5 is involved in cell proliferation and cell death control and encodes a novel transmembrane protein[J].Curr Biol,2001,11(23):1891-1895.
[3]JING H C,LISA A,MARCEL J G,et al.Arabidopsis CPR5 is a senescence-regulatory gene with pleiotropic functions as predicted by the evolutionary theory of senescence[J].Journal of Experimental Botany,2007,58(14):3885-3894.
[4]JING H C,HEBELER R,OELJEKLAUS S,et al.Early leaf senescence is associated with an altered cellular redox balance in Arabidopisis cpr5/old1 mutants[J].Plant Biology,2008,10:85-98.
[5]GINGER B,REMMY K L,ALICE S,et al.Constitutive expressor of pathogenesis-related genes5 affects cell wall biogenesis and trichome development[J].BMC Plant Biology,2008,8:1-11.
[6]叶青华 .拟南芥中 AtCPR5基因耐热功能的研究[D].广州:华南理工大学,2009:1-63.
[7]秦代锦,陈德西,胡晓,等.水稻遗传转化研究进展[J].生物学杂志,2008,25(5):5-9.
[8]KATIYAR-AGARWAL S,AGARWAL M,GROVER A.Heat-tolerant basmati rice engineered by over-expression of hsp10[J].Plant Molecular Biology,2003,51:677-686.
[9]SATAKE T,YOSHIDA S.High temperature induced sterility in indica rice at flowering[J].Crop Sci,1978,447:6-10.
[10]PAREEK A,SINGLA S L,GROVER A.Protein alterations associated with salinity,desiccation,high and low temperature stresses and abscisic acid application in seedlings of Pusa 169,a high-yielding rice(Oryza sativa L.)cultivar[J].Curr Sci,1998,75:1023 -1035.
[11]IPCC.Summary for policy makers in:Climate change[R].Cambridge:The Scientific Basis Cambridge University Press,2001:13.
[12]PENG S,HUANG J,SHEEHY J E ,et al.Rice yields decline with higher night temperature from global warming[J].Proc Natl Acad Sci USA ,2004,101:9971-9975.
[13]张桂莲,陈立云,雷东阳,等.水稻耐热性研究进展[J].杂交水稻,2005,20(1):1-5.
[14]J萨姆布鲁克,D W 拉赛尔(黄培堂,等译).分子克隆实验指南[M].3版.北京:科学出版社,2002:1595.
[15]李美茹,李洪清.简单高效的根癌农杆菌介导的水稻基因转化方法[J].实验生物学报,2003,36(4):290-294.
[16]于洋,石少华,许昱,等.提高培养温度建立水稻成熟胚再生体系[J].种子,2009,28(10):36-40.
[17]CHEN E H,ZANG P,ZUO S,et al.Factors affecting Agrobacterium mediated transformation efficiency in rice[J].Rice Science,2004,11(4):l81-l85.
[18]L IN Y J,ZHANG Q F.Optimising the tissue culture conditions for high efficiency transformation of indica rice[J].Plant Cell Report,2005,23:540 -547.
[19]GE X J,CHU Z H,LIN YJ,et al.A tissue culture system for different germplasms of indica rice[J].Cell Biology and Morphogenesis,2006,25(5):392-402.
[20]王亚琴,段中岗,黄江康,等.水稻幼穗培养高效再生系统的建立[J].植物学通报,2004,21(1):52-60.
[21]NIMNARA Y,METHINEE S,JARUNYA N.Development of genotype-independent regeneration system for transformation of rice(Oryza sativa ssp.indica)[J].Journal of Plant Research,2007,120:237-245.
[22]尹鸿瑛,安韩冰,安利佳.影响根癌农杆菌介导水稻转化的因素分析[J].植物研究,2001,21(3):437-443.
[23]徐刚,王彩莲,慎玫.基因型和继代培养对水稻组织培养效率的影响[J].浙江农业科学,1988(2):55-58.
[24]斯华敏,VU M H,付亚萍,等.辐照后转移时间对水稻体细胞愈伤组织分化的影响[J].核农学报,2001,15(3):134-140.
[25]黄红梅,杨永智,张治国,等.影响根癌农杆菌介导的高效水稻遗传转化的相关因素分析[J].西北农林科技大学学报,2004,32(9):4-8.
[26]王关林,方宏筠.植物基因工程[M].北京:科学出版社,2002:295-494.
[27]TOKI S,HARA N,ONO K,et al.Early infection of scutellum tissue with Agrobacterium allows high-speed trans formation of rice[J].The Plant Journal,2006,47(6):969-976.
[28]苏益,黄善金,蔺万煌,等.根癌农杆菌介导的水稻快速转化方法研究[J].中国农学通报,2008,24(5):83-86.
[29]黄健秋,卫志明,安海龙,等.根癌土壤杆菌介导的水稻高效转化和转基因植株的高频再生[J].植物学报,2000,42(11):1172-1178.
[30]舒曦.水稻CPR5基因及其启动子功能的初步研究[D].广州:华南理工大学,2010:1-65.
