胰高血糖素样肽-l 及其类似物研究进展*
2011-01-23宋佃卫王德才窦桂芳
宋佃卫 王德才 窦桂芳
(1.泰山医学院药理学教研室,山东 泰安 271016; 2.中国军事医学科学院九所,北京 100850)
随着人民生活水平的日益提高,我国居民饮食结构有了全面的改善,但也导致了糖尿病发病率居高不下。糖尿病成为继心脑血管疾病和肿瘤之后危害人类健康的“第三杀手”。自20世纪末以来,人们对内源性胰高血糖素样肽-1(glucagon like peptide-1,GLP-1)的结构、生理功能等进行了深入研究,现对GLP-1及其类似物的最新研究进展作一综述。
1 GLP-1
1.1 GLP-1的来源
胰高血糖素样肽(GLP)是胰高血糖素基因的产物,由胰高血糖素原通过翻译后加工形成多个活性肽,主要包括GLP-1和GLP-2。胰高血糖素原是由160个氨基酸组成的蛋白质,其中第33~61位氨基酸序列编码胰高血糖素,第72~108位和第126~158位分别编码GLP-1和GLP-2。其在不同组织内被加工成不同产物,在胰腺经激素原转化酶的作用,被转化为胰高血糖素,在肠道则被转化为GLP-1和GLP-2。其中GLP-2能促进正常小肠黏膜生长,并能促进慢性肠病及放射性损伤的肠上皮的修复和愈合[1]。GLP-1主要由远端回肠及结肠的L细胞分泌,它通过G蛋白偶联受体通道发挥更广泛的生物学效应,该通道在胰岛、肺、胃肠道、中枢神经系统中均有表达。
1.2 GLP-1生理及代谢特征
GLP-1的相对分子质量是3298,人体内基础水平在0.4~1.4 pmol/L,进食几分钟后体内的GLP-1浓度开始升高,餐后30~60 min内达到10~12 pmol/L峰值,但很快被体内广泛表达的二肽基肽酶IV(DPP-IV)所降解。DPP-IV可特异性识别GLP-1的N末端第二位丙氨酸残基,并从此处切除二肽使GLP-1失活[2]。GLP-1在体内主要以GLP-1(7-36)NH2和GLP-1 (7-37)NH2两种形式存在,前者比后者在体内有更长的半衰期,酰胺化的肽链更稳定, 二者具有相似的生物学活性。肾脏在GLP-1代谢过程中起重要作用,大鼠肾切除后GLP-1的代谢率下降,肾功能衰竭的患者血浆GLP-1水平升高,提示肾脏参与了GLP-1的清除,其生物半衰期仅2~6 min[3]。
1.3 GLP-1受体作用机制
GLP-1受体是一个与G蛋白偶联的含有7个跨膜结构的胰高血糖素受体家族成员,主要信使为cAMP。当GLP-1与受体结合后,通过G蛋白激活腺苷酸环化酶,使细胞内cAMP水平升高,导致细胞膜K+通道关闭,细胞去极化,诱发电压依赖性Ca2+通道开放,细胞外Ca2+内流,胞内Ca2+浓度升高而触发胰岛素的合成和释放。cAMP水平升高又激活蛋白激酶A (PKA),使相关蛋白磷酸化,进而刺激β细胞胰岛素基因的转录和翻译,形成一种互动的良性循环[4]。当把实验小鼠β细胞膜上GLP-1受体基因敲除后,GLP-1使胞内cAMP升高作用减弱[5]。
1.4 GLP-1的生理功能
1.4.1促进胰岛素的合成和分泌
GLP-1促进胰岛素合成和分泌的作用是通过胰腺β细胞膜上GLP-1受体实现的。有人将非空腹大鼠麻醉后分离胰腺,进行原位灌注,测定其胰岛素分泌量。与基础分泌量相比[ (1.4 ± 0.5)pmol/min],用3 mmol/L 葡萄糖和GLP-1一起灌注,胰岛素分泌量未增加 [(2.0 ± 0.6)pmol/min)],而用11 mmol/L 葡萄糖和GLP-1灌注则可引起胰岛素的双相分泌;加用GLP-1后,第二相胰岛素分泌显著增加 [(115.4 ± 14.1)pmol/min vs(30.1 ± 7.6)pmol/min,P< 0.001][6]。实验证明GLP-1 刺激胰岛素分泌有葡萄糖依赖性。血糖愈高,其作用愈强,血糖下降时GLP-1促进胰岛素合成和分泌的作用减弱。
1.4.2抑制胰高血糖素的分泌
GLP-1 对胰高血糖素的分泌也有调节作用,部分是通过增加生长激素释放抑制激素的分泌,部分则是对α 细胞的直接作用。胰高血糖素分泌减少使肝脏葡萄糖输出下降,进而使清晨空腹血糖水平保持正常[7]。
1.4.3保护胰腺β细胞
在人的一生中胰岛不间断的重塑更新,一般认为该过程是预防糖尿病所必需的。GLP-1 通过抑制β细胞凋亡和促进β细胞增殖,从而GLP-1在胰岛重塑过程中发挥重要作用。有人用新鲜分离的人胰岛进行的对照研究显示,在体外用GLP-1 处理胰岛可减少β细胞的凋亡。实验第3 天,用GLP-1 处理的样本中凋亡细胞核占6.1%,而在对照样本中这一比例为15.5% (P< 0.01) ;在第5 天,则两组凋亡比例分别为8.9% 和 18.9% (P< 0.01)[8]。Bulotta等[9]发现,GLP-1能促使胰腺导管内皮细胞转化为胰岛素样细胞,促进β细胞的分裂和分化,给予永久性胰腺上皮细胞(IMPE)GLP-1后能促使胰岛素分泌,所以GLP-1是胰腺内分泌分化的一个决定因素。β细胞功能的进行性减退是糖尿病的主要病理变化之一,GLP-1能减少β细胞凋亡和促进β细胞增殖,从而显著增加β细胞的数量,对于2 型糖尿病的治疗尤为重要。
1.4.4降低体重
有研究[10]表明,大脑也能合成GLP-1,动物和人类注射GLP-1可以增加饱食感,减少食物的摄入,这可能与外侧下丘脑、脑丘背内侧核和下丘脑腹内侧等多个大脑区域分布有丰富的GLP-1受体有关。GLP-1能抑制餐后胃排空和减少胃酸分泌,可通过抑制迷走神经而抑制胃和十二指肠的蠕动,增加幽门部的压力从而延缓胃排空,降低食欲。给正常个体静脉注射GLP-1可使50%的个体胃排空时间由(28±2)min延长到(50±9)min[11]。GLP-1通过以上多种途径产生减轻肥胖降低体重的作用。临床实验[12]证明,给2型糖尿病患者使用GLP-1 激活剂后,体重平均下降5.3 kg,平均维持时间为3年。
2 GLP-1类似物
2.1 肽类
2.1.1Exenatide
本产品源于对一种毒蜥唾液的研究。希拉毒蜥(Helodermasuspeetum)分布于美洲地区,该动物每年仅仅进食4次即可以,断食期间,胰腺关闭,不分泌胰岛素,进食时,才有胰岛素分泌。这种现象引起人们的研究兴趣。后有研究者利用高效液相层析方法分析这种毒蜥的唾液,结果分离到一个特殊蛋白质峰值。测序发现,它由39个氨基酸残基组成,与GLP-1有53%的同源性,将其命名为Exendin-4[13]。由于天然产物来源有限,美国Amylin公司和Lilly公司联合研制化学全合成Exendin-4,将其命名为Exenatide,中文名为艾塞那肽,商品名为Byetta,2005年被美国和欧洲批准用于口服抗糖尿病药物无效的2型糖尿病患者的辅助治疗。该制剂现已在我国上市。国内对应产品艾塞那肽、注射用艾塞那肽、艾塞那肽注射液也分别于2005和2006年获新药临床注册。Exenatide是天然的GLP-1受体激动剂,对于二肽基肽酶IV有高度抵抗作用,血浆半衰期可以长达60~90 min。本品与胰岛素降低糖化血红蛋白的作用相当,但它能更好地控制餐后血糖且不易引起低血糖反应,同时可以降低体重,因此,更适用于肥胖的糖尿病患者[14],并且能够促进β细胞增殖,抑制胰岛细胞的凋亡,维持胰岛的良好功能[15]。约40%~50%患者用药后体内出现抗Exenatide抗体,但抗体滴度很低(1︰125),且在大多数病例中,还没有观察到抗体的形成与Exendin-4降血糖活性下降之间有直接的相关性;但是当抗体滴度较高时,可能会影响Exendin-4的活性[16]。临床研究[17]表明Exendin-4的不良反应多为轻度和中度,恶心为最常见的与剂量相关的不良反应。恶心症状(43.5%)在最初的8周治疗中最普遍,随着治疗的继续,恶心症状逐渐减轻;10%以上的患者出现低血糖(19.6%)、腹泻(12.8%)和呕吐(12.8% ),此外,本品可引起头晕、头痛、食欲减退、体重减轻等,但无须因此调整剂量,随着用药时间的延长不良反应可望减轻减少。近来,怀疑exenatide与急性胰腺炎有关,美国FDA收到这方面的报告共30份,在该药说明书中已增加有可能引起急性胰腺炎的警告。为了进一步评估该药的安全性和有效性,还有必要继续对本药进行追踪。
2.1.2Exenatide LAR
Exenatide LAR是Amylin, Alkermes和EliLilly公司共同开发的一种由聚合物微球包裹的Exenatide长效缓释制剂。目前,Exenatide LAR完成III期临床研究阶段,正等待上市。Exenatide LAR每周只需注射一次,而Exenatide每天需要注射两次。2006年11月Kim等[18]公布了一项Exenatide长效注射剂的Ⅱ期临床研究结果,Exenatide LAR能够显著降低口服二甲双胍或饮食运动控制无效患者的糖化血红蛋白、空腹血糖和体重。一项30周的临床研究结果表明[19],Exenatide LAR组HbA1c平均下降1.9%,统计学研究表明与治疗前有着显著性差异,Exenatide一般只能降低1.5%。除了具有恶心、呕吐等胃肠道不良反应,长期使用Exenatide LAR后67%的患者产生抗体,而Exenatide为38%,Exenatide LAR产生抗体的几率高于Exenatide[20]。尽管抗体的形成与降血糖作用之间的相关性不明确,但抗体滴度较高时,可能会影响其降血糖活性[16]。
2.1.3Liraglutide
Liraglutide又名NN2211,由Novo Nordisk公司研发。2009年7月3日,Liraglutide获欧盟管理当局上市批准。Liraglutide的降糖效果可以称之为“智能降糖”,它的降糖作用会随血糖水平的高低而自动“开关”,因此患者很少出现低血糖反应。其氨基酸序列与人GLP-1具有97%同源性,对GLP-1的天然结构有两处修饰:34位Arg被Lys替代,在26位的Lys上增加了一个16碳的脂肪酸,脂肪酸是通过谷氨酰基连接到Lys26上的,该衍生物在体内可借助酰胺键与血浆白蛋白形成复合物,减少二肽基肽酶IV的降解作用,半衰期可以长达10~14 h。在一项为期14 周有377 名患者参与的临床研究中,1.25 和1.9 mg/ 日的Liraglutide单药治疗可以使HbA1c 下降约1.7%,与安慰剂比较,P< 0.0001。接受Liraglutide 1.9 mg/ 日治疗的患者体重平均减少3.0 kg,并且体重减少呈剂量依赖性[21]。在一项临床研究中单独使用liraglutide,实验者没有出现低血糖事件,但同样具有恶心、呕吐等胃肠道不良反应[22]。虽然liraglutide与GLP-1有高度的相似性,但没有人产生抗体[23]。2009 年,Novo Nordisk 公司公布了为期26周的LEAD-6 研究结果[24],此项研究包括15 个国家的464 名使用二甲双胍类和磺脲类药物已无法控制2 型糖尿病的患者,研究中将患者分为2 组,平行使用Liraglutide (1.8 mg,每天1次)及Exenatide (10 μg,每天2次)。研究结果表明,与Exenatide比较,Liraglutide 在降低糖化血红蛋白含量方面发挥的作用更为显著(Liraglutide 降低1.12%,而使用Exenatide 只降低0.79%,P<0.0001);在减轻体重方面两者并无较大差异(Liraglutide体重减轻3.24 kg,而Exenatide 减轻2.87 kg)。
2.1.4血浆白蛋白重组肽类
2.1.4.1CJC-1131 CJC-1131是由ConjuChem公司开发的一种GLP-1与血浆白蛋白重组肽,是GLP-1经化学修饰后的多肽。为了抵抗DPP-IV的降解,将GLP-1 N端第2位L-丙氨酸(L-Ala)用D-Ala替换,并且在C端的Lys氨基上连接一个酰胺类化合物,既具有与白蛋白同样长的半衰期,又具有GLP-l的生理活性。在动物实验中CJC-1131能增加胰岛β细胞团和改善β细胞功能[25],但CJC-1131体内识别GLP-1受体的能力较差,活性降低,但因为在人体内半衰期比较长(约10 d),健康成人约为8.9~14.7 d,2型糖尿病患者约为9.1~13.8 d,所以能部分抵消了上述不足[26]。目前CJC-1131处于III期临床研究阶段。
2.1.4.2CJC-1134-PC 即PC-DACTM∶Exendin-4,是由ConjuChem公司采用PC-DACTM技术开发的一种Exendin-4与血清白蛋白重组肽,而不是GLP-1与白蛋白的重组。目前处于Ⅲ期临床研究阶段。一项在58名2型糖尿病患者中进行的双盲安慰剂对照临床实验表明[27],单次皮下注射CJC-1134-PC可以显著降低2型糖尿病患者至少一周的空腹血糖以及随机血糖和体重,并具有良好的耐受性。体外实验研究表明,CJC-1134-PC能增加胰岛β细胞cAMP的生成,与Exendin-4的体外活性相似(CJC-1134-PC的EC50为3.47 nmol,Exendin-4为2.62 nmol)[28]。
2.1.4.3Albugon 也称为GSK 716155、albiglutide,是由葛兰素史克( Glaxo SmithKline, GSK)公司开发的一种GLP-1二聚体与血清白蛋白重组肽,目前处于Ⅲ期临床研究阶段。对2型糖尿病患者的研究表明[29],Albugon的体内半衰期较长,约为6~7 d,可以每周皮下注射1次。它能够显著降低2型糖尿病患者的餐后及空腹血糖。常见的不良反应是头痛、恶心等。其药效学和药动学不受注射部位的影响。但Albugon 与GLP-1 受体亲和力较弱,其体外活性仅是Exendin-4的1%[30]。
2.1.5生物表达的重组肽
重组Exendin-4人血清白蛋白融合蛋白(rEx-4/HAS)可以在毕赤酵母中表达,并可以作为制备方法用于工业化生产。rEx-4/HAS可以与GLP-1 受体结合,在体外促进cAMP生成。在体内rEx-4/HAS可有效地降低血糖和改善糖尿病db/db小鼠的葡萄糖耐量,利用猴的药代动力学研究也显示rEx-4/HAS具有较长的血浆半衰期。但是其体外生物活性仅是Exendin-4的5%,可能是因为与白蛋白融合后空间位阻的影响[31]。
2.1.6谊生泰[rhGLP-1(7-36)]
上海华谊集团的“谊生泰”是我国首个拥有自主知识产权的肠促胰岛素分泌肽类药物。GLP-1是由末端空肠、回肠和结肠的L细胞分泌的葡萄糖依赖性的肠降血糖多肽激素,GLP-1 (7-36)为GLP-1的活性氨基酸序列,而“谊生泰”[rhGLP-1(7-36)]是该公司通过基因工程重组技术制备得到的该段活性氨基酸序列。目前,“谊生泰”已进入Ⅲ期临床试验,这标志着首个国产肠促胰岛素分泌肽类药物已进入“上市倒计时”。预计到2012~2014年,2 型糖尿病患者有望用上这种国产生物新药。
2.2非肽类小分子GLP-1受体激动剂
上述的多肽类GLP-1类似物口服无效,均需要皮下注射使用,长期应用会引发皮肤炎症、皮疹,并影响患者依从性。所以人们一直致力于开发口服的非肽类小分子化合物。中国科学院上海药物研究所报道了一个口服有效的治疗Ⅱ型糖尿病的小分子化合物Boc5,其结构如图1。其能够促进大鼠胰岛中葡萄糖刺激的胰岛素分泌,降低db/db小鼠的糖化血红蛋白,较少小鼠的摄食量,并且这些作用均能被GLP-1受体阻断剂GLP-1 (9 - 39)所阻断,提示它可能是一种非肽类GLP-1 受体激动剂[32]。 Boc5 能够持续改善糖尿病小鼠的血糖,降低其体重,是目前唯一种具有多种抗糖尿病药理作用的非肽类小分子GLP-1受体激动剂。
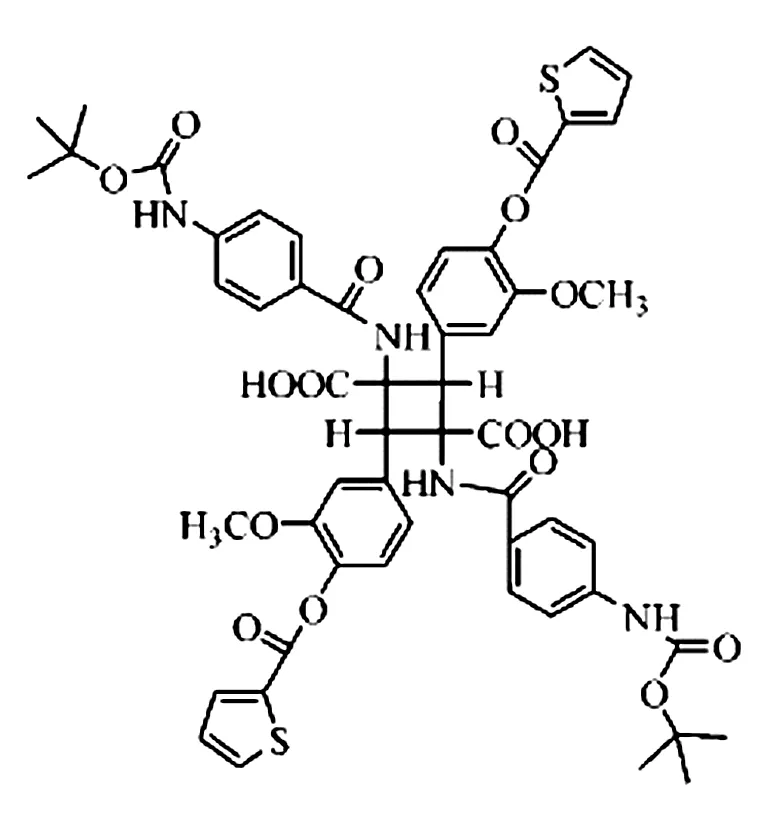
图1 Boc5结构图
综上所述,GLP-1及其类似物的发现为糖尿病的治疗提供了新思路和新方法,其能从多条途径降低血糖,同时还能改善胰岛β细胞功能,降低体重等作用,并具有长效且不易引起临床低血糖反应,优于传统的降血糖药物。但是现有的GLP-1类似物大部分是肽类,必需注射使用,所以存在患者依从性差,应用不方便等缺点。因此,改善肽类GLP-1类似物药动学特点,寻找非肽类小分子的GLP-1受体激动剂将具有重要的意义。我国自主研发的小分子化合物Boc5具有较强的GLP-1受体激动活性,具有良好的开发应用前景。
[1] Rowland KJ,Brubaker PL. Life in the crypt: a role for glucagon-like peptide-2[J].Mol Cell Endocrinol,2008, 288(12): 63-70.
[2] Brubaker PL, Drucker DJ. Minireview: glucagon-like peptides regulate cell proliferation and apoptosis in the pancreas, gut, and central nervous system [J]. Endocrinology,2004,145(6): 2653-2659.
[3] Dennis MS, Zhang M, Meng YG, et al. Albumin binding as a general strategy for improving the pharmacokinetics of proteins[J]. J Biol Chem, 2002, 277(38): 35035-35043.
[4] Vahl TP, Tauchi M, Durler TS, et al. Glucagon-like peptide-1 (GLP-1) receptors expressed on nerve terminals in the portal vein mediate the effects of endogenous GLP-1 on glucose to lerance in rats[J]. Endocrinology, 2007, 148(10): 4965-4973.
[5] Holst JJ. Glucagon-like peptide1 (GLP-l): an intestinal hormone, signaling nutritional abundancc, with an unusual therapeutic potential [J]. Mol Endocriol, 2003, 17(2): 161-171.
[6] De Heer J, Holst JJ. Sulfonylurea compounds uncouple the glucose dependence of the insulinotropic effect of glucagon-like peptide 1[J]. Diabetes, 2007,56: 438-443.
[7] Drucker DJ. The biology of incretin hormones[J]. Cell Metab, 2006, 3: 153-165.
[8] Farilla L, Bulotta A, Hirshberg B, et al. Glucagon-like peptide 1 inhibits cell apoptosis and improves glucose responsiveness of freshly isolated human islets[J]. Endocrinology, 2003, 144: 5149-5158.
[9] Bulotta A, Hui H, Anastasi E, et al. Cultured pancreatic ductal cells undergo cell cycle redist-ribution and β-cell-like differentiation response to glucagon-like peptide-1[J].J Mol Endocrinol, 2002, 29: 347-360.
[10] DruckerDJ, Nauck MA. The incretin system: glucagon-like peptide-1 receptor agonists and dipeptidyl peptidase-4 inhibitors in type 2 diabetes [J]. Lancet, 2006, 368(11): 1696-1705.
[11] Little TJ, Pilichiewicz AN,Russo A, et al. Effects of intravenous glucagon-like peptide-1 on gastric emptying and intragastric distribution in healthy subjects:relationships with postprandial glycemic and insulinemic responses[J]. Clin Endocrinol Metab,2006, 91(5): 1916-1923.
[12] Stonehouse A, Guan X, Holcombe JH,et al. 3.5 years of exenatide maintained progressive weight reduction and was associated with improvements in cardiovascular risk factors in patients with type 2 diabetes (T2DM)[J].Obesity,2007, 15: A85.
[13] Eng J, kleinman WA, SinghL, et al. Isolation and charaeterization of exendin-4,an exendin-analogue, from Heloderma susPectum venom.further evidenee for an exendin-4 receptor on dispersed acini from guinea pig panrcas [J]. Biol chem,1992,267:7402-7405.
[14] Brodows RG, Qu Y, Johns D, et al. Quantifying the effect of exenatide and insulin glargine on postprandial glucose excursions in patients with type 2 diabetes[J]. Curr Med Res Opin, 2008, 24(5) :1395 - 1397.
[15] Lupir, Mancarella R, Delguerra S, et al. Effects of exendin-4 on islets from type 2 diabetes patients[J]. Diabetes Obes Metab, 2008, 10 (6) : 515 - 519.
[16] Drucker DJ, Nauck MA. The incretin system: glucagon-like peptide-1 receptor agonists and dipeptidyl peptidase-4 inhibitors in type 2 diabetes [J]. Lancet, 2006, 368(11): 1696-1705.
[17] Iltz JL, Baker DE, Setter SM, et al. Exenatide: an incretin mimetic for the treatment of type 2 diabetes mellitus [J]. Clin Ther, 2006, 28 (5) : 652 - 665.
[18] Kim D, Macconell L, Zhuang D, et al. Effects of once weekly dosing of a long-acting release formulation of exenatide on glucose control and body weight in subjects with type 2 diabetes [J]. Diabetes Care, 2007, 30 (6) : 1487 - 1493.
[19] Drucker DJ, Buse JB, Taylor K, et al. Exenatide once weekly versus twice daily for the treatment of type 2 diabetes: a randomized, open-label, non-inferiority study [J]. Lancet, 2008, 372(9645) : 1240 - 1250.
[20] Byetta(exenatide injection)Prescribing Information[C]. Amylin Pharmaceuticals, San Diego, California, 2007.
[21] Vilsboll T, Zdravkovic M, Le-Thi T et al. Liraglutide, a long-acting human glucagon-like peptide-1 analog, given as monotherapy significantly improves glycemic control and lowers body weight without risk of hypoglycemia in patients with type 2 diabetes[J]. Diabetes Care, 2007, 30: 1608-1610.
[22] Seino Y, Rasmussen MF, Zdravkovic M, et al. Dosedependent improvement in glycemia with once-daily liraglutide without hypoglycemia or weight gain: a double-blind randomized, controlled trial in Japanese patients with type 2 diabetes[J]. Diabetes Res Clin Pract, 2008, 81(2): 161-168.
[23] Feinglos M N. Effects of liraglutide (NN2211), a long-acting GLP-1 analogue, on glycaemic control and bodyweight in subjects with type 2 diabetes[J].Diabetic Medicine, 2005, 22 (83):1016-1023.
[24] Buse JB, Rosenstock J, Sesti G, et al. Liraglutide once a day versus exenatide twice a day for type 2 diabetes: a 26-week randomised, parallel-group, multinational, open-label trial (LEAD-6) [J]. Lancet, 2009, 374(9683): 39-47.
[25] Leger R,Thibaudeau K, Robitaille M, et al. Identification of CJC-1131-albumin bioconjugate as a stable and bioactive(7-36) analog[J]. Bioorg Med Chem Lett, 2004, 14(17): 4395-4398.
[26] Brubaker PL. Incretin-based therapies: mimetics versus protease inhibitors[J].Trends Endocrinol Metab, 2007,18( 6 ): 240-246.
[27] Safety and pharmacodynamics of CJC-1134-PC, a novel GLP-1 receptor agonist, in patients with type 2 diabetes mellitus. http://www.medkb.com/Uwe/Forum.aspx/diabetes-forum/18094.
[28] Baggio LL, Huang QL, Cao XM, et al. An albumin-exendin-4 conjugate engages central and peripheral circuits regulating murine energy and glucose Homeostasis[J]. Gastroenterology, 2008,134(4): 1137-1147.
[29] Matthews JE, Stewart MW, Deboever EH. Pharmacodynamics, pharmacokinetics, safety and tolerability of albiglutide, a long-acting GLP-1 mimetic, in patients with type 2 diabetes[J]. J Clin Endocrin Metab, 2008, 93 (12): 4810 - 4817.
[30] Baggio LL, Huang Q, Brown TJ, et al. A recombinant human glucagon-like peptide (GLP)-1-albumin protein (albugon) mimics peptidergic activation of GLP-1 receptor-dependent pathways coupled with satiety, gastrointestinal motility, and glucose homeostasis [J]. Diabetes, 2004, 53(9): 2492-2500.
[31] Huang YS, Chen Z, Chen YQ, et al. Preparation and characterization of a novel exendin-4 human serum albumin fusion protein expressed in Pichia pastoris[J]. J Pept Sci, 2008, 14 (5): 588- 595.
[32] Su H, He M, Li H, et al. Boc5, a non-peptidic glucagon-like Peptide-1 receptor agonist, invokes sustained glycemic control and weight loss in diabetic mice [J]. Plos One, 2008, 3 (8): 2892 - 2902.
