贫困农村和富裕城市6月龄婴儿粪钙卫蛋白水平的差异及其影响因素
2011-01-22刘金荣盛晓阳胡燕琪余晓刚刘珊珊
刘金荣 盛晓阳 胡燕琪 余晓刚 刘珊珊 张 杰
食物匮乏或不恰当喂养所导致的一种或多种营养素缺乏是造成婴幼儿生长发育不良的重要因素,而近期在尼泊尔[1]、孟加拉国[2]以及前期在冈比亚[3, 4]的研究则提示,发展中国家,尤其是贫困落后地区,生活环境或食物卫生状况不佳所引发的慢性或反复肠道隐性炎症,可能导致肠道功能损伤以及全身性免疫刺激,从而也成为影响婴幼儿生长发育的重要因素之一。在中国贫困落后地区,婴儿体格生长明显落后于发达地区。贫困农村婴儿以母乳喂养为主,母亲营养可以满足生后前6个月婴儿的营养需求。因此,本研究假设,贫困农村婴儿存在着隐性肠道炎症,从而影响婴儿生长。
粪钙卫蛋白(fecal calprotectin,FC)是目前筛查、诊断和监测成人[5, 6]或儿童[7, 8]肠道炎性疾病最有效的生化指标之一。当肠道存在炎症反应时,中性粒细胞渗出至肠腔增加,导致FC水平升高。相比其他反映肠道炎症的血液生化指标,如血WBC、CRP、ESR、抗中性粒细胞胞浆抗体和抗酵母菌抗体等,FC具有更高的敏感度和特异度[5, 7, 9]。
本研究以中国富裕城市6月龄健康婴儿的FC水平为对照,证实经济水平落后、卫生状况不佳的贫困地区6月龄婴儿存在肠道隐性炎症,并探讨母乳喂养和辅助食品添加对婴儿FC水平的影响。
1 方法
1.1 纳入标准 2009年10月至2010年6月,分别在云南省文山州西畴县(国家级贫困县)和上海市杨浦区控江社区,在常规健康体检的6月龄婴儿中,招募年龄5个月1 d至6月29 d的单胎、足月健康婴儿。
1.2 排除标准 ①出生体重<2 000 g;②胎龄<37周;③有出生缺陷或神经缺陷或其他严重缺陷者;④近1个月内有腹痛和腹泻者;⑤近2周内有发热、上呼吸道感染或其他感染或服用非类固醇类抗炎药或出现鼻黏膜出血等症状者。
1.3 样本量计算 本研究的主要目的为比较贫困农村与富裕城市婴儿FC水平的差异。查阅文献[10],假设贫困农村婴儿比富裕城市婴儿的FC水平高 100 μg·g-1,婴儿FC 水平的组内标准差为140 μg·g-1,根据两样本均数比较时样本量估算公式:
n=(μα+μβ)2(1+1/k)σ2/δ2
取α=0.05,β=0.10,k=1,则每组需招募33名婴儿。
1.4 知情同意 本研究获得上海交通大学医学院附属新华医院伦理委员会审核批准。所有接受调查婴儿的监护人均了解本次调查的目的和内容,并签署知情同意书。
1.5 粪便样本的收集和检测 云南样本收集所使用的密封塑料盒由研究小组成员提供,由村医提前分发给符合入组条件婴儿的监护人。由监护人在婴儿健康体检的当天或前1天收集1~5 g粪便样品,置于密封塑料盒中,并于婴儿健康体检时交给研究小组成员,置于-20℃冰箱冷冻保存,后置于生物冰袋中保持冷冻状态,当日空运回上海,继续置于-20℃冰箱冷冻备用。所有样品均在收集后的3个月内完成检测。上海样本收集使用的密封塑料盒由本研究小组成员在婴儿体检时发放,家长收集粪便样品后电话通知研究小组成员上门回收,置-20℃冰箱保存。
FC测定采用ELISA试剂盒(瑞士Bühlmann公司生产)。检测步骤:①抽提:冷冻粪便在室温下解冻后,用接种环挑取50~100 mg粪便,准确称重;按粪便重量(mg):抽提缓冲液体积(mL)=1∶49加入抽提缓冲液,充分振荡30 min,混匀。将混匀的液体移入离心管,高速离心5 min,将上清液移入干净试管中。②ELISA步骤:将粪便抽提液按1∶50稀释,样本均设复孔,常规ELISA流程操作。③读数:采用全自动酶标仪(Bio-Rad,美国,加州)于450 nm波长处读数。根据标准品的A值和浓度绘制标准曲线,测定范围为10~600 μg·g-1。
1.6 婴儿体格测量 由研究小组成员负责婴儿体格测量。采用标准人体测量秤(seca,德国,精确度5 g)和婴儿量床(seca,德国,精确度0.1 cm)测量婴儿体重和身长。连续测量2次。如2次身长测量相差不超过0.4 cm,体重测量相差不超过10 g,则取第1次测量结果;如前2次测量相差超过上述范围,则再次测量,直至2次测量数据相差在允许范围之内,取最后1次测量数据。
1.7 婴儿母乳喂养及辅助食品添加情况调查 在婴儿体格测量当日,由研究小组成员询问监护人有关婴儿母乳喂养及辅助食品添加情况,在监护人充分理解各问题的基础上,由研究小组成员填写完成调查问卷。内容包括:①是否仍继续母乳喂养;②是否已添加谷物类(米粉、米饭、面条、玉米、粟米和小米);③是否已添加蔬菜或水果;④是否已添加肉类(猪牛肉、鸡鸭肉和动物内脏);⑤是否已添加蛋类(鸡蛋或其他蛋类)。回答均为:是或否。
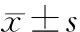
2 结果
2.1 研究对象基本情况 本研究共调查婴儿145名,其中1名上海婴儿无6月龄的体格生长数据,9名云南婴儿缺失出生体重,共135名婴儿进入分析,其中云南贫困农村婴儿96名,上海富裕城市婴儿39名。
如表1所示,135名婴儿的平均年龄为(6.1±0.2)个月,出生体重为2.2~4.6 kg,平均(3.2±0.5) kg,富裕城市婴儿的出生体重显著高于贫困农村婴儿(t=-3.707,P<0.01)。6月龄时,135名婴儿的平均体重为(7.7±1.0) kg,平均身长为(66.1±2.5) cm;富裕城市婴儿体重(t=-5.741,P<0.01)和身长(t=-5.449,P<0.01)均显著高于贫困农村婴儿。在生后前6个月,贫困农村婴儿体重增长(4.3±0.9) kg,显著低于富裕城市婴儿的体重增长(5.0±0.9) kg(t=-4.148,P<0.01)。
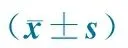
表1 研究对象的基本情况
2.2 婴儿6月龄时的FC水平 由于研究初期未预计到本研究中6月龄婴儿的FC水平远高于预期,在前期检测中,FC水平>600 μg·g-1的24名婴儿(23名贫困农村婴儿,1名富裕城市婴儿)的粪便抽提液未再稀释检测,也未妥善保留;而粪便样本多次冻融会影响检测结果,因此未获得具体数据。在后期检测中,FC水平>600 μg·g-1的12名婴儿(11名贫困农村婴儿,1名富裕城市婴儿)的粪便抽提液在原稀释倍数的基础上,再按1∶6稀释测定FC水平,测得FC水平为615.0~126 7.9 μg·g-1。
FC水平>600 μg·g-1比例,贫困农村婴儿(34/96名,35.4%)明显高于富裕城市婴儿(2/39名,5.1%)(χ2=13.010,P<0.01)。男婴(18/70名,25.7%)和女婴(18/65名,27.7%)间差异无统计学意义(χ2=0.067,P=0.795)。
99/135名FC水平≤600 μg·g-1的婴儿中,FC水平呈非正态分布,中位数为172.0(24.5~595.9)μg·g-1。62名FC水平≤600 μg·g-1的贫困农村婴儿FC中位数为196.4(24.5~595.9 μg·g-1),37名富裕城市婴儿为138.8(26.2~557.2)μg·g-1,差异有统计学意义(Z=-2.011,P<0.05)。男婴FC水平中位数为169.6 (26.2~577.1)μg·g-1,女婴为185.0 (24.5~595.9)μg·g-1,差异无统计学意义(Z=-0.217,P=0.828)(图1)。
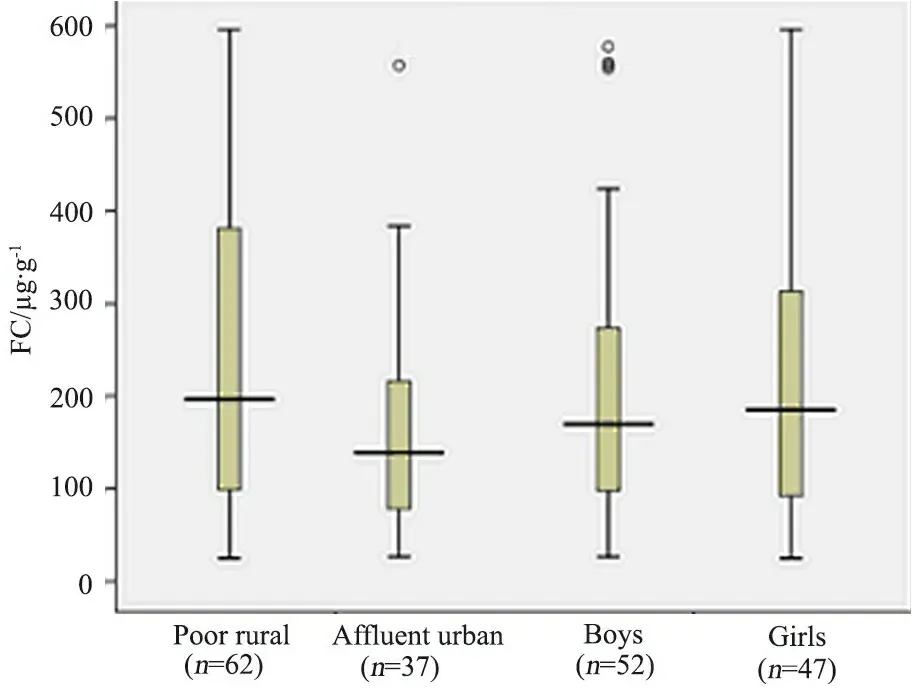
图1 99名FC水平≤600 μg·g-1婴儿FC水平的组间比较
Fig 1 Comparison of FC levels between groups in 99 FC level ≤600 μg·g-1infants
Notes Poor ruralvsaffluent urban,Z=-2.011,P<0.05; boysvsgirls,Z=-0.217,P=0.828
2.3 母乳喂养对FC水平的影响 本研究中96贫困农村婴儿均为母乳喂养,且均已添加辅助食品。由于贫困农村与富裕城市婴儿FC水平差异显著,未将两者合并分析。2名富裕城市婴儿FC水平>600 μg·g-1,其中1名婴儿停止母乳喂养,1名婴儿继续母乳喂养;20/37名FC水平≤600 μg·g-1的富裕城市婴儿已停止母乳喂养,FC水平中位数为130.3(54.7~557.2) μg·g-1;17/37名婴儿继续母乳喂养,FC水平中位数为183.0(26.2~383.5)μg·g-1,母乳喂养与停止母乳喂养婴儿FC水平的差异无统计学意义(Z=-0.914,P=0.361)。
2.4 添加辅助食品对婴儿FC水平的影响 仅1名富裕城市婴儿未添加辅助食品,仍为纯母乳喂养;其余134名婴儿均已添加辅助食品。婴儿添加辅助食品最多的是谷物类,其次为蔬菜、水果,蛋类和肉类的添加较少。
表2所示,96名贫困农村婴儿中,34名FC水平>600 μg·g-1与62名FC水平≤600 μg·g-1婴儿相比,在添加谷物、蔬菜、水果和肉类的比例上,差异无统计学意义(均P>0.05);在添加蛋类的比例上差异有统计学意义(χ2=10.262,P<0.01)。在39名富裕城市婴儿中,2名FC水平>600 μg·g-1婴儿,其中1名已添加谷类,蔬菜、水果和蛋类;另1名4种辅助食品均已添加;余37名婴儿中,添加蛋类的比例显著高于贫困农村婴儿(χ2=30.009,P<0.01);已添加与未添加各种辅助食品的婴儿FC水平差异无统计学意义(均P>0.05)。
表2 婴儿添加辅助食品的比较[n(%)]
Tab 2 Comparison of complementary feeding in infants[n(%)]
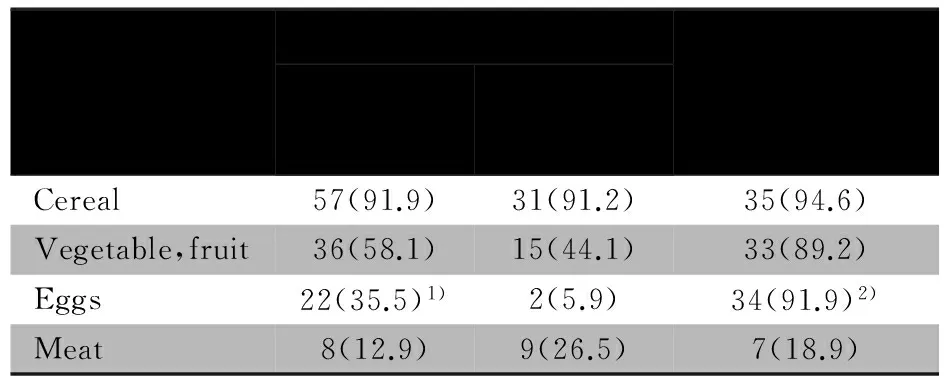
ComplementaryfoodFCofruralinfant/μg·g-1≤600(n=62)>600(n=34)FC≤600μg·g-1(Urbaninfant)(n=37)Cereal57(91.9)31(91.2)35(94.6)Vegetable,fruit36(58.1)15(44.1)33(89.2)Eggs22(35.5)1)2(5.9)34(91.9)2)Meat8(12.9)9(26.5)7(18.9)
Notes 1)vsFC>600 μg·g-1,χ2=10.262,P<0.01; 2)vsrural infants,χ2=30.009,P<0.01
3 讨论
钙卫蛋白是S100蛋白家族中的一种钙、锌结合蛋白;主要存在于中性粒细胞中,占其胞质蛋白的60%,是一种有效的中性粒细胞趋化因子[11]。FC可通过ELISA法检测。FC的理化性质稳定,新鲜粪便样品在常温下可以保留7 d,其抽提液可在-20℃储存长达6个月,这些特性均利于样本的收集和检测,同时极大提高了检测敏感度[12]。
本研究发现,贫困农村6月龄婴儿的FC水平明显高于富裕城市婴儿,其中35.4%(34/96名)的贫困农村婴儿的FC水平>600 μg·g-1,这一现象值得关注。FC对筛查和诊断炎症性肠病的价值已经得到肯定[5, 7, 13]。成人FC水平的正常上限为50 μg·g-1,儿童则有建议以100或160 μg·g-1作为临界值[14~16]。新生儿、婴儿的FC水平明显高于年长儿和成年人,而且有较大波动和个体差异[10, 17~19]。目前所报道的1岁以内足月健康婴儿FC的中位数和范围如表3所示,其中FC水平中位数最高的为Savino等[20]报道的13~90 d的纯母乳喂养婴儿。Josefesson等[21]在对极低出生体重婴儿的长期随访中发现,患坏死性小肠结肠炎或其他严重肠道感染性疾病的婴儿FC水平显著升高,并建议以FC水平>2 000 μg·g-1作为早期诊断指标。Campeotto等[22]则建议以FC水平363和636 μg·g-1作为筛查婴儿轻度和重度肠病的临界值。
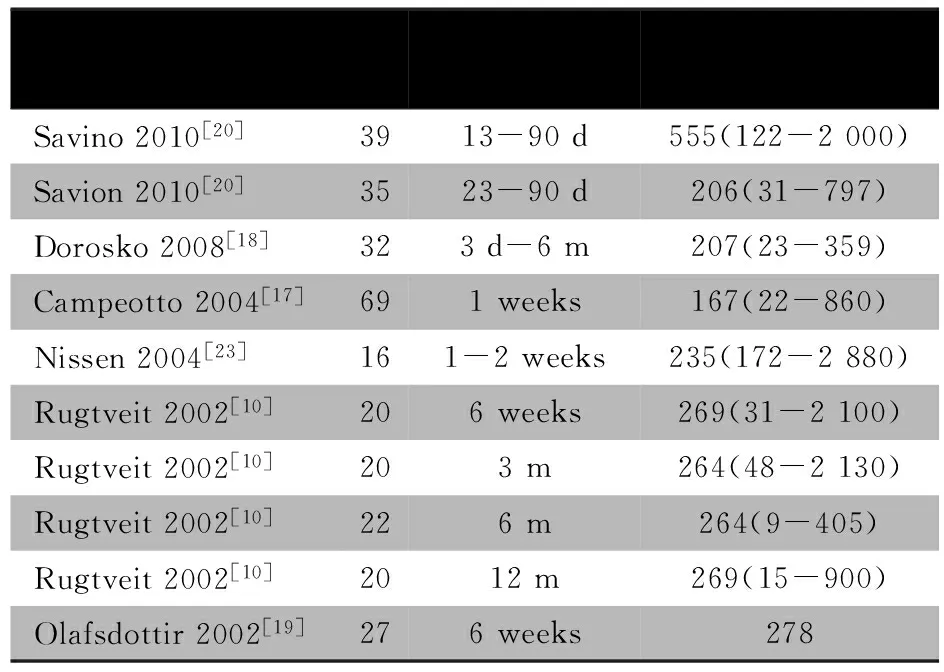
表3 足月健康婴儿FC水平
Notes 1) data were represented as median(range);m:month
本研究因未预计到有较高比例贫困农村婴儿的FC水平>600 μg·g-1,在前期研究中未再将粪便样品稀释检测。后期检测中,>600 μg·g-1的粪便样品经进一步稀释后测得FC水平。相比富裕城市39名婴儿中仅2名FC水平>600 μg·g-1,以及FC≤600 μg·g-1的贫困农村婴儿FC水平显著高于富裕城市婴儿,该现象不能仅以母乳喂养和辅助食品添加等因素解释,推测在贫困农村婴儿中由于环境因素的影响可能存在着较高比例的肠道隐性炎症。
新生儿、婴儿的高FC水平反映了其肠道中性粒细胞数量增加,这种现象可能是由于新生儿和婴儿肠道不成熟而通透性较高,也可能是由于肠道相关淋巴组织(gut-associated lymphoid tissue,GALT)发育而使中性粒细胞通过肠黏膜增加。很多环境因素影响婴儿肠道成熟和GALT发育,其中喂养和肠道内菌群定植是最重要的影响因素。
研究提示[18, 20],母乳喂养婴儿的FC水平高于配方奶和混合喂养婴儿。虽然母乳中含少量钙卫蛋白,但该含量不足以使母乳喂养婴儿的FC水平明显升高。母乳喂养婴儿FC水平较高的原因被归纳为母乳有利于促进婴儿肠道双歧杆菌和乳酸杆菌生长,这些肠道微生物通过刺激GALT的正常发育、IgA的合成和分泌以及T辅助细胞的平衡,促进婴儿出生后免疫系统的成熟;同时,母乳亦可促进婴儿肠道成熟,在此过程中存在的轻微肠道炎症使婴儿FC水平升高。
辅助食品添加是婴儿期又一重要的影响肠道菌群、肠道功能的喂养因素,不同食物引入是否会影响婴儿FC水平,目前未见相关报道。本研究选取6月龄处于辅助食品添加初期的婴儿作为研究对象,分析不同食物引入对婴儿FC水平的影响,但未发现继续母乳喂养以及不同食物引入对婴儿FC水平有明显影响。
本研究比较两地婴儿的体格生长状况,富裕城市婴儿从出生至6个月的体重增长明显高于贫困农村婴儿,贫困农村婴儿生长缓慢也难以单纯用母乳喂养或辅助食品添加解释。结合贫困农村婴儿FC水平升高,推测该现象可能是由肠道隐性炎症所致。隐性肠道炎症损害小肠功能主要有两方面,一方面破坏肠道绒毛刷状缘的乳糖酶,妨碍消化和吸收;另一方面破坏肠道屏障功能,使大分子物质移位通过黏膜进入体内,导致局部和系统性的免疫和炎症反应。
肠道损伤和免疫反应对婴儿生长影响最先由Solomos等[3]提出,Lunn等[24, 25]和Campbell等[4]等在冈比亚农村的研究发现,在2~15个月的婴幼儿中,64%以上的身长和体重增长不足可以用肠道黏膜功能受损解释。近期,在尼泊尔[1]和孟加拉国[2]的研究进一步提供了相关证据。
本研究发现,贫困农村6月龄婴儿FC水平高于富裕城市婴儿,并有35.4%的贫困农村婴儿FC水平>600 μg·g-1,推测可能与当地经济水平落后、卫生状况不佳,婴儿肠道暴露于病原微生物的机会增加,导致肠道隐性炎症所致。本研究中贫困农村婴儿FC水平异常升高的现象以及对婴儿生长的可能影响值得进一步追踪研究。
本研究的不足之处和局限性:①本研究设计时未预计到部分6月龄婴儿FC水平远高于预期,部分样本未获得具体检测结果;②本研究未对贫困农村和富裕城市婴儿的生活环境做进一步的调查,两地除了经济和卫生水平上的巨大差异;在地理和人文环境等方面也有一定差异,也可能影响结果的可靠性;③两地婴儿FC水平的变化趋势及影响婴儿FC水平的因素均在进一步的研究中。
[1]Panter-Brick C, Lunn PG, Langford RM, et al. Pathways leading to early growth faltering: an investigation into the importance of mucosal damage and immunostimulation in different socio-economic groups in Nepal. Br J Nutr, 2009, 101(4):558-567
[2]Goto R, Mascie-Taylor CG,Lunn PG. Impact of intestinal permeability, inflammation status and parasitic infections on infant growth faltering in rural Bangladesh. Br J Nutr, 2009, 101(10):1509-1016
[3]Solomons NW, Mazariegos M, Brown KH, et al. The underprivileged, developing country child: environmental contamination and growth failure revisited. Nutr Rev, 1993, 51(11):327-332
[4]Campbell DI, Elia M,Lunn PG. Growth Faltering in rural gambian infants is associated with impaired small intestinal barrier function, leading to endotoxemia and systemic inflammation. J Nutr, 2003, 133(5):1332-1338
[5]Gisbert JP,McNicholl AG. Questions and answers on the role of faecal calprotectin as a biological marker in inflammatory bowel disease. Dig Liver Dis, 2009, 41(1):56-66
[6]Angriman I, Scarpa M, D′Inca R, et al. Enzymes in feces: useful markers of chronic inflammatory bowel disease. Clin Chim Acta, 2007, 381(1):63-68
[7]Canani RB, Terrin G, Rapacciuolo L, et al. Faecal calprotectin as reliable non-invasive marker to assess the severity of mucosal inflammation in children with inflammatory bowel disease. Dig Liver Dis, 2008, 40(7):547-553
[8]Bremner A, Roked S, Robinson R, et al. Faecal calprotectin in children with chronic gastrointestinal symptoms. Acta Paediatr, 2005, 94(12):1855-1858
[9]Gisbert JP, Gonzalez-Lama Y,Mate J. Role of biological markers in inflammatory bowel disease. Gastroenterol Hepatol, 2007, 30(3):117-129
[10]Rugtveit J,Fagerhol MK. Age-dependent variations in fecal calprotectin concentrations in children. J Pediatr Gastroenterol Nutr, 2002, 34(3):323-324
[11]Roseth AG, Fagerhol MK, Aadland E, et al. Assessment of the neutrophil dominating protein calprotectin in feces. A methodologic study. Scand J Gastroenterol, 1992, 27(9):793-798
[12]Ton H, Brandsnes S, Dale S, et al. Improved assay for fecal calprotectin. Clin Chim Acta, 2000, 292(1-2):41-54
[13]Fagerberg UL, Loof L, Lindholm J, et al. Fecal calprotectin: a quantitative marker of colonic inflammation in children with inflammatory bowel disease. J Pediatr Gastroenterol Nutr, 2007, 45(4):414-420
[14]Berni Canani R, Rapacciuolo L, Romano MT, et al. Diagnostic value of faecal calprotectin in paediatric gastroenterology clinical practice. Dig Liver Dis, 2004, 36(7):467-470
[15]Canani RB, de Horatio LT, Terrin G, et al. Combined use of noninvasive tests is useful in the initial diagnostic approach to a child with suspected inflammatory bowel disease. J Pediatr Gastroenterol Nutr, 2006, 42(1):9-15
[16]Diamanti A, Panetta F, Basso MS, et al. Diagnostic work-up of inflammatory bowel disease in children: the role of calprotectin assay. Inflamm Bowel Dis, 2010, 16(11):1926-1930
[17]Campeotto F, Butel MJ, Kalach N, et al. High faecal calprotectin concentrations in newborn infants. Arch Dis Child Fetal Neonatal Ed, 2004, 89(4):353-355
[18]Dorosko SM, Mackenzie T,Connor RI. Fecal calprotectin concentrations are higher in exclusively breastfed infants compared to those who are mixed-fed. Breastfeed Med, 2008, 3(2):117-119
[19]Olafsdottir E, Aksnes L, Fluge G, et al. Faecal calprotectin levels in infants with infantile colic, healthy infants, children with inflammatory bowel disease, children with recurrent abdominal pain and healthy children. Acta Paediatr, 2002, 91(1):45-50
[20]Savino F, Castagno E, Calabrese R, et al. High faecal calprotectin levels in healthy, exclusively breast-fed infants. Neonatology, 2010, 97(4):299-304
[21]Josefsson S, Bunn SK,Domellof M. Fecal calprotectin in very low birth weight infants. J Pediatr Gastroenterol Nutr, 2007, 44(4):407-413
[22]Campeotto F, Baldassarre M, Butel MJ, et al. Fecal calprotectin: cutoff values for identifying intestinal distress in preterm infants. J Pediatr Gastroenterol Nutr, 2009, 48(4):507-510
[23]Nissen AC, van Gils CE, Menheere PP, et al. Fecal calprotectin in healthy term and preterm infants. J Pediatr Gastroenterol Nutr, 2004, 38(1):107-108
[24]Lunn PG, Northrop-Clewes CA,Downes RM. Intestinal permeability, mucosal injury, and growth faltering in Gambian infants. Lancet, 1991, 338(8772):907-910
[25]Lunn PG. The impact of infection and nutrition on gut function and growth in childhood. Proc Nutr Soc, 2000, 59(1):147-154
