环磷酰胺治疗增殖性狼疮性肾炎的Meta分析
2011-01-22黄献文欧阳小琳龚新芳
沈 琪 杨 彤 黄献文 欧阳小琳 龚新芳 黄 静
狼疮性肾炎是系统性红斑狼疮(SLE)累及肾脏所引起的一种免疫复合物性肾炎,是SLE主要的损伤器官和死亡原因,增殖性狼疮性肾炎(PLN)是病情较重和治疗难度较高的类型。对于PLN给予积极的糖皮质激素和免疫抑制剂治疗已成为共识,但采用何种方案仍有争议。最近的研究结果显示,环磷酰胺(CTX)/糖皮质激素联合仍是目前推荐的治疗PLN的一线方案[1]。随着其他免疫抑制剂治疗PLN研究的开展,且CTX的不良反应受到重视,有必要对CTX治疗PLN的疗效和安全性重新进行评估。
目前,有关CTX治疗PLN的Meta分析有16篇:Bansal等[2](1997)纳入19篇不同证据级别的临床研究,且发表时间较久;Flanc等[3](2004)纳入12篇RCT文献,未纳入中文文献;欧三桃等[4](2006)纳入9篇中英文RCT文献,反映当时的证据水平;Moore等[5](2006)纳入5篇RCT文献;Zhu等[6]、Wlash等[7]及齐华林等[8](2007)均纳入了4篇RCT文献,均未纳入中文文献;殷蕾等[9](2008)纳入11篇RTC文献,但英文文献纳入不全,且中文文献质量偏低;陈明玉等[10](2008)纳入10篇中文RCT文献;Mak等[11](2009)纳入10篇英文文献,3篇以摘要形式发表,其中2篇摘要目前已全文发表;王媛媛等[12](2009) 未发表的Meta分析纳入39篇文献,但多数研究质量较低,Jadad评分为3分的仅1篇文献[13];马东锋等[14](2009) 未发表的Meta分析纳入7篇中英文文献,但存在文献检索不全情况;笔者2010年发表的Meta分析纳入14篇中英文发表的文献,主要评价霉酚酸酯(MMF)的疗效及安全性[15];Lee等[16](2010)纳入10篇英文文献、Kamanamool等[17](2011)纳入5篇英文文献、Touma等[18](2010)纳入4篇英文文献,均未纳入中文文献。考虑上述Meta分析存在的不足,因此有必要全面地对中英文发表的RCT文献进行Meta分析,评价CTX治疗PLN的疗效及安全性,为临床用药以及进一步大规模、多中心的RCT研究提供指导。
1 方法
1.1 文献纳入标准 同时符合以下条件的文献被纳入:①符合美国风湿病协会SLE的诊断标准,且病理类型为Ⅲ或Ⅳ型PLN患者,年龄不限;②RCT和半随机对照试验;③干预措施:试验组予CTX或与其他药物联合治疗,对照组予其他药物治疗。
1.2 文献排除标准 ①继发于过敏性紫癜、肾淀粉样变性及病毒感染(如HIV、HBV、HCV、B19细小病毒)等引起的继发性肾病;②原发性肾病综合征及儿童先天性肾病综合征。
1.3 疗效判定指标
1.3.1 主要结局指标 终末期肾病(ESRD)发生率、病死率、完全缓解率和总缓解率(完全缓解率+部分缓解率)。
1.3.2 次要结局指标 部分缓解率、复发率、SCr、50%补体溶血单位(CH50)和不良反应(如闭经、感染、WBC减少和胃肠道反应等)发生率。
1.4 文献检索策略
1.4.1 数据库 Cochrane图书馆的临床对照试验中心资料库(CENIRAL)、PubMed、EMBASE、中国生物医学文献光盘数据库、中国期刊全文数据库和中国维普数据库。检索时间均从建库至2010年11月30日;此外还手工检索肾脏病会议论文和内部资料等灰色文献。
1.4.2 检索策略 参考Cochrane协作网制定的RCT检索策略。 英文检索词:randomized-controlled-trial 、 blind、controlled-clinical-trial、lupus nephritis、cyclophosphamide;中文检索词:人类、随机化、临床试验、对照、对比、狼疮性肾炎、肾病、环磷酰胺。全文获取途径为检索电子期刊全文数据库或直接与作者联系索取。
1.5 文献质量评价方法
1.5.1 纳入和排除文献方法 杨彤和黄献文按照检索策略独立完成检索并核对文献摘要,对于可能为RCT或在2名评价者中存在争议的文献,获取全文,由相同的2名评价者按照Cochrane推荐的专用质量评价表和资料提取表进行质量评价和数据提取,主要内容包括:① 一般信息;②患者的一般情况,包括平均年龄和性别;③干预措施:包括所用药物,药物剂量,用药途径等;④临床结局指标,包括疗效和安全性指标。随后交叉核对结果。对于非中英文的文献,先翻译成英文或中文再进行评价。
1.5.2 文献偏倚评价 按照Cochrane 5.0.2手册推荐的RCT质量评价标准进行。评价内容包括:①随机分配方法;②分配方案隐藏;③对研究对象、治疗方案实施者和研究结果测量者采用盲法;④结果数据的完整性;⑤选择性报告研究结果;⑥其他偏倚来源。针对每一项研究结果,对上述6条内容作出“是”(低度偏倚)、“否”(高度偏倚)和“不清楚”(缺乏相关信息或偏倚情况不确定)的判断。完全满足上述6条质量标准,即“正确或充分”者,其发生各种偏倚的可能性最小;≥上述1条未描述者发生相应偏倚的可能性为高度。
在文献纳入和排除、文献评价中如遇分歧通过讨论解决或与沈琪协商解决。如研究报告中未提供有关资料,则与原文作者联系以获取所需资料。
1.6 统计学方法 采用RevMan 5.0软件进行Meta分析,计数资料采用OR值及其95%CI表示,计量资料采用加权均数差(WMD)或标准化均数差(SMD)及其95%CI表示。
首先对纳入文献的临床异质性和方法学异质性进行分析,按照临床异质性和方法学异质性进行亚组分析,并采用χ2检验分析各文献结果间的统计学异质性,当文献间无统计学异质性(P≥0.1,I2≤50%)时,采用固定效应模型分析;如文献间存在统计学异质性(P<0.1,I2>50%)时,采用随机效应模型分析。
样本量足够大时采用漏斗图分析可能的发表偏倚,采用OR或RR对数(logOR或logRR)为横坐标,OR或RR对数值标准误的倒数为纵坐标绘制,若图形对称,说明不存在发表偏移的影响,若图形不对称,则提示存在发表偏移。
2 结果
2.1 研究的一般情况 共检索到符合条件的文献1 253篇,其中英文文献967篇,中文文献286篇。最终37篇RCT文献进入Meta分析[19~55](图1)。

图1 文献筛选流程图
Fig 1 Flow chart of article screening and selection process
纳入37篇文献的一般情况见表1。英文文献30篇[19~40,43~48,50,51],中文文献7篇[41,42,49,52~55]。3篇文献[34~36]是同一研究的不同阶段,但考虑到其随访时间不同,报道了不同的终点指标,作为3篇文献处理;文献[25]是文献[24]的延续,但考虑到其随访时间不同,报道了不同的终点指标,作为2篇文献处理;2篇文献[30,43]以摘要形式发表,余为全文发表;3篇文献[19,20,40]为同一研究的草案及不同的研究指标。共纳入2 296例PLN患者,7篇文献为CTX/糖皮质激素联合治疗与单用糖皮质激素对照,13篇文献为CTX/糖皮质激素联合治疗与MMF/糖皮质激素联合治疗对照,5篇文献为CTX/糖皮质激素联合治疗与环孢素(CsA)/糖皮质激素联合治疗对照,4篇文献为CTX/硫唑嘌呤(AZA)联合治疗与MMF对照,4篇文献为大剂量CTX与小剂量CTX对照,3篇文献为CTX与AZA对照,静脉给予CTX与口服CTX对照、CTX与他克莫司(FK506)对照、CTX长与短疗程对照,静脉给予CTX与口服CTX/AZA联合治疗对照和静脉给予CTX与静脉给予CTX/甲泼尼龙(MP)联合治疗对照的文献均为1篇。
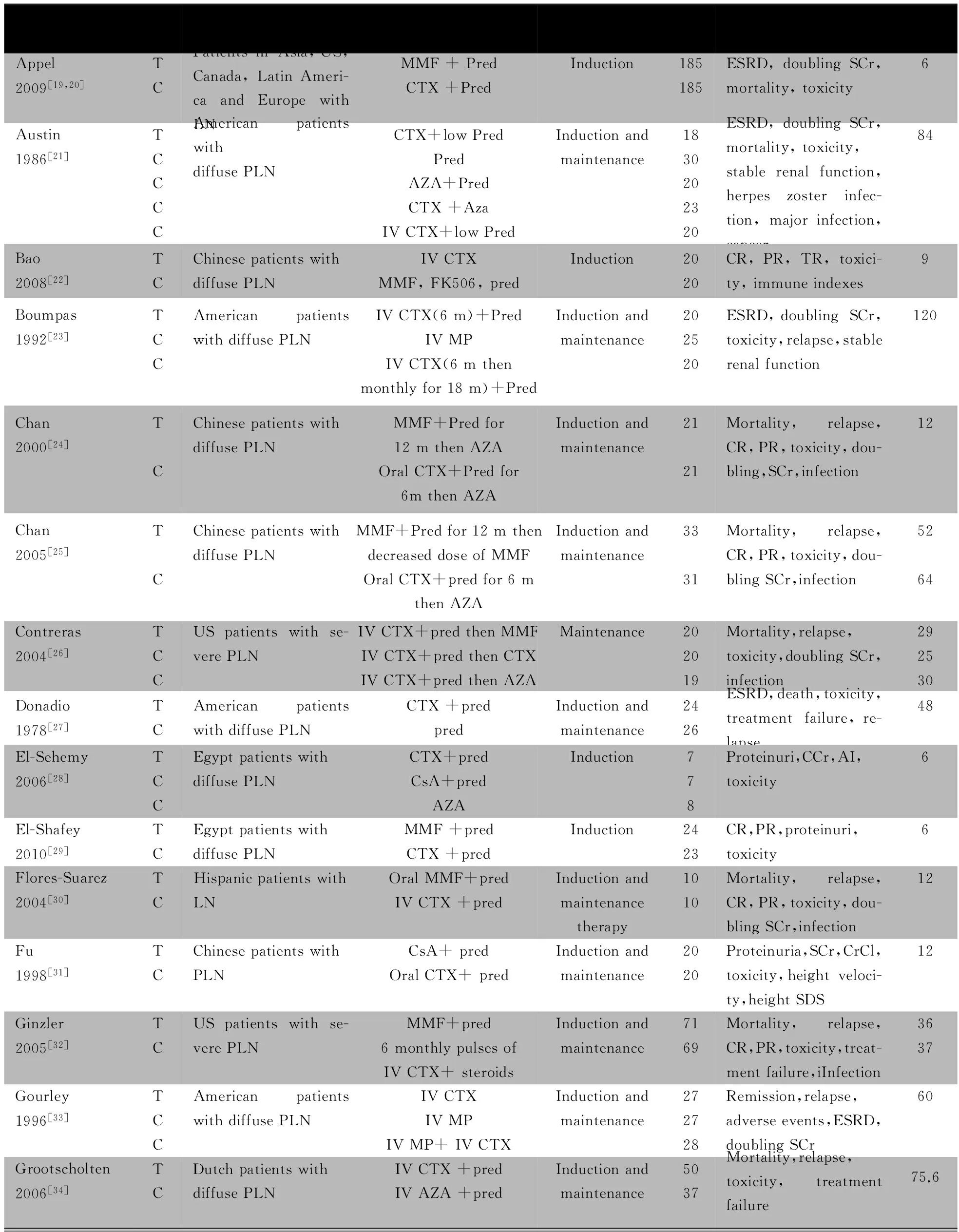
表1 纳入37篇文献的一般情况
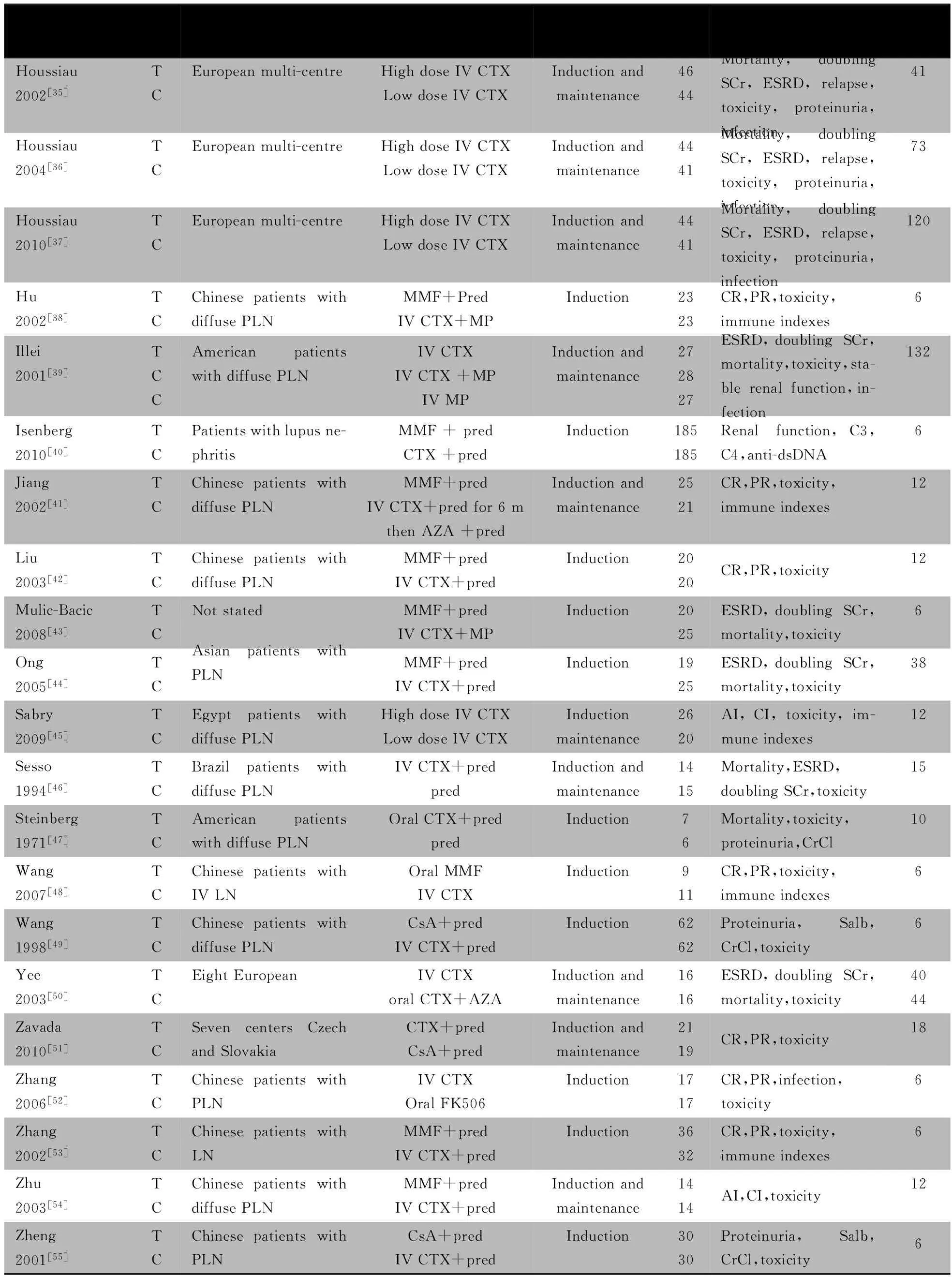
续表1
Notes m:months; T:trial group; C:control group; TR:total remissions; CR:complete remissions; PR :part remissions ;IV:intravenous; MMF:mycophenolate mofetil; CTX:cyclophosphamide; AZA: azathioprine; CsA: cyclosporin A;Pred:prednisone;MP:methylprednisolone; Salb :serum albumin ;AI: activity index;CI: chronicity index
2.2 文献偏倚评价 37篇文献均提及随机,其中19篇采用了正确的随机方法;6篇文献采用了分配隐藏;4篇文献采用盲法;纳入文献均报道了失访和退出情况,均未提及是否选择性报道结果,均未报告其他偏倚来源(图2)。
2.3 大剂量与小剂量CTX对照治疗PLN疗效和安全性的Meta分析
2.3.1 主要结局指标 病死率:3篇文献[35~37]报道了病死率,异质性检验P=0.81,无统计学异质性,采用固定效应模型分析。Meta分析结果显示,OR=0.24,95%CI:0.06~0.89,提示大剂量CTX组病死率显著低于小剂量CTX组,2/136vs10/129,P=0.03(图3)。ESRD发生率:3篇文献[35~37]报道了ESRD发生率,异质性检验P=0.96,无统计学异质性,采用固定效应模型分析。Meta分析结果显示,OR=2.22,95%CI:0.67~7.43,提示两组ESRD发生率的差异无统计学意义,9/136vs4/129,P=0.19(图3)。完全缓解率:文献[35]报道了完全缓解率。OR=0.51,95%CI:0.20~1.33,提示大剂量与小剂量组完全缓解率的差异无统计学意义(表2)。
2.3.2 次要结局指标 表2显示,24 h尿蛋白定量、复发率、SCr、SCr倍增发生率的文献间具同质性;部分缓解率、感染、带状疱疹、闭经和癌症发生率的文献未行异质性检验。除大剂量CTX组SCr倍增发生率显著低于小剂量CTX组外,余次要结局指标两组差异均无统计学意义。
2.4 CTX /糖皮质激素联合治疗与单用糖皮质激素组治疗PLN疗效和安全性的Meta分析
2.4.1 主要结局指标 病死率:6篇文献[21,27,33,39,46,47]报道了CTX/糖皮质激素联合治疗与单用糖皮质激素组的病死率,异质性检验P=0.27,无统计学异质性,采用固定效应模型分析。Meta分析结果显示,OR=1.46,95%CI:0.75~2.84,提示两组差异无统计学意义,34/165vs16/115,P=0.26(图4)。ESRD发生率:6篇文献[21,23,27,33,39,46]报道了两组ESRD发生率,异质性检验P=0.92,无统计学异质性,采用固定效应模型分析。Meta分析结果显示,OR=0.56,95%CI:0.31~1.00,提示CTX/糖皮质激素联合治疗组ESRD发生率显著低于单用糖皮质激素组,28/192vs29/131,P=0.05(图4)。完全缓解率:文献[47]报道了两组的完全缓解率。 OR=3.00,95%CI:0.10~88.13,提示两组差异无统计学意义(表3)。
2.4.2 次要结局指标 表3显示,SCr倍增发生率、SCr清除率、24 h尿蛋白定量、肾功能稳定、肾功能恶化、感染、带状疱疹、闭经、骨骼毒性、膀胱炎和肿瘤发生率的文献间具同质性。复发率、SCr水平的文献未行异质性检验。除CTX/糖皮质激素联合治疗组复发率、SCr倍增发生率显著低于单用糖皮质激素组;肾功能稳定、SCr水平、带状疱疹、闭经发生率显著高于单用糖皮质激素组外,余次要结局指标两组差异均无统计学意义。
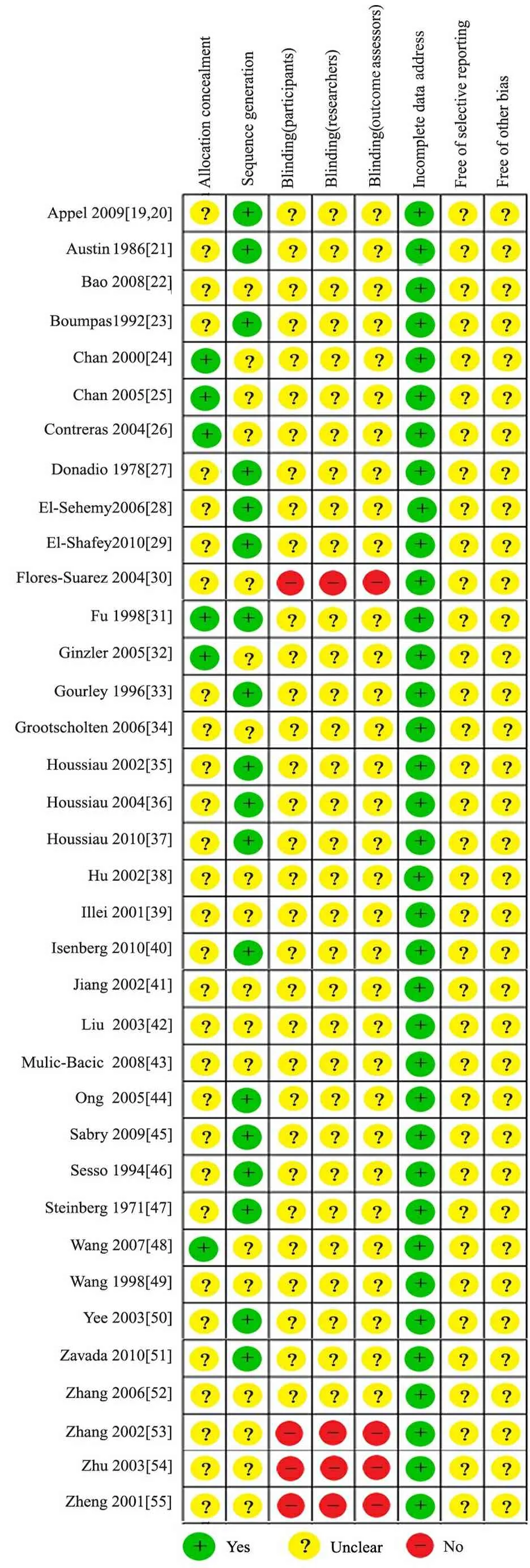

图2 纳入37篇文献偏倚的评价结果
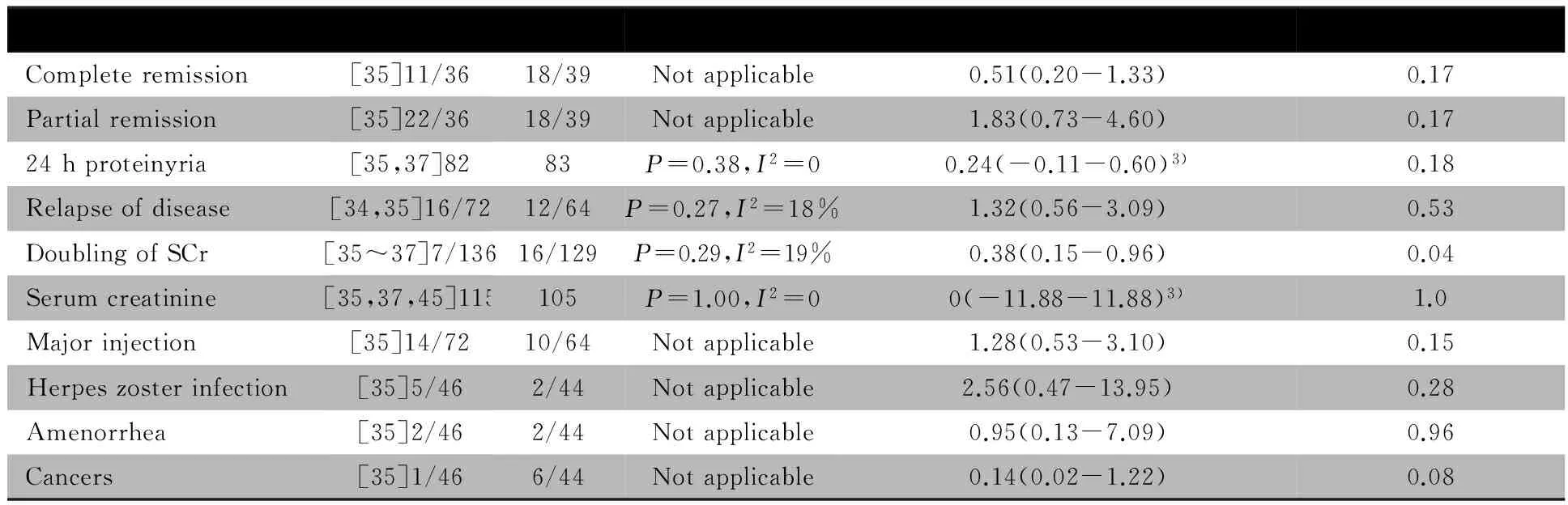
图3 CTX大剂量与小剂量组治疗PLN疗效的Meta分析
Notes 1) total events/patients of treatment group; 2)total events/patients of control group;3) data were represented as mean difference

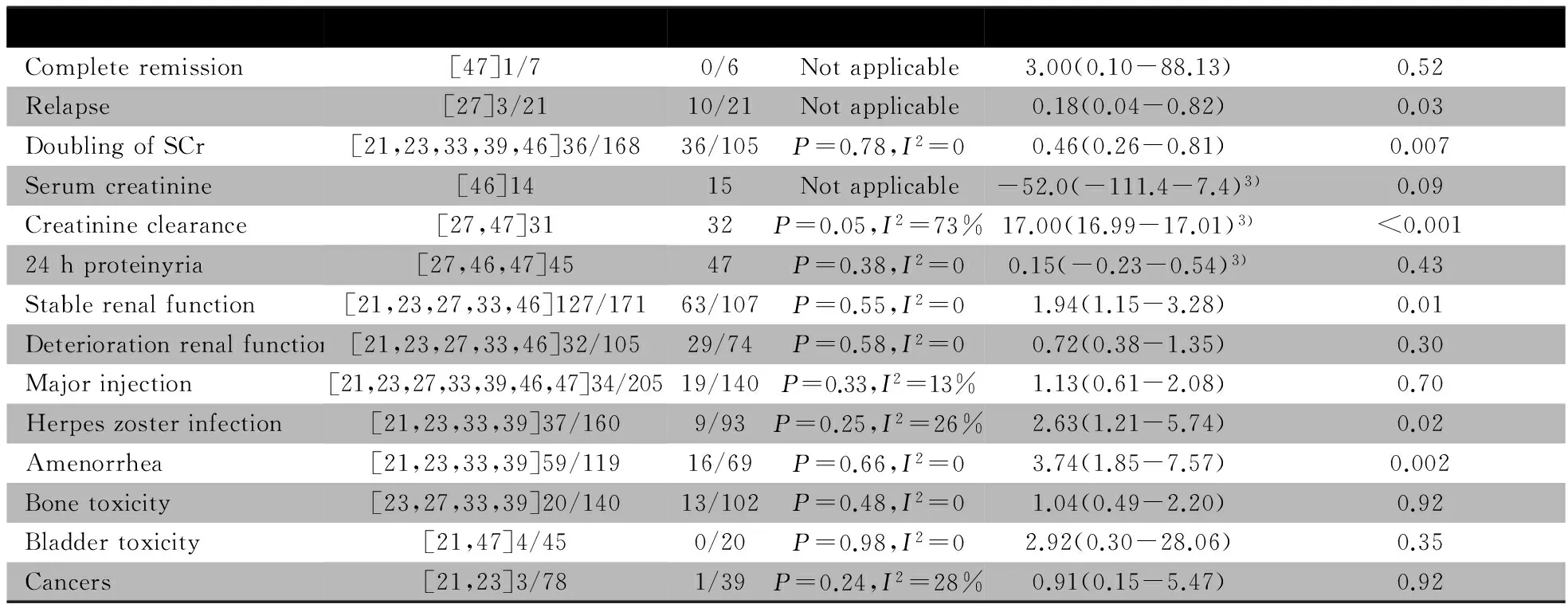
图4 CTX/糖皮质激素联合治疗组和单用糖皮质激素组治疗PLN疗效的Meta分析
Notes 1) total events/patients of treatment group; 2)total events/patients of control group;3) data were represented as mean difference
2.5 CTX与AZA治疗PLN疗效和安全性的Meta分析
(1)设置一个循环控制变量来实现递减或递增1;(2)for语句圆括号内的3个表达式是可选的,都可以省略,但分号一定要保留。如果省略了条件表达式,那么默认为真;(3)可在一个for循环语句中提供用逗号分隔的表达式3和表达式1,但表达式2只能有一个;(4)for语句变量初始化部分声明的变量,其作用域只局限于for语句内部。
2.5.1 主要结局指标 病死率:文献[21,26,34]报道了CTX组和AZA组的病死率,异质性检验P=0.18,无统计学异质性,采用固定效应模型分析。Meta分析结果显示,OR=1.01,95%CI:0.43~2.39,提示两组差异无统计学意义(图5)。ESRD发生率:文献[21,26,34]报道了CTX组和AZA组ESRD发生率,异质性检验P=0.24,无统计学异质性,采用固定效应模型分析。Meta分析结果显示,OR=0.56,95%CI:0.19~1.59,两组差异无统计学意义(图5)。
2.5.2 次要结局指标 表4显示,复发率文献间具异质性;SCr倍增、感染、带状疱疹和闭经发生率的文献间具同质性;肾功能稳定发生率、肾功能恶化发生率、SCr、SCr清除率、24 h尿蛋白定量、急性活动指数、慢性活动指数、膀胱炎和肿瘤发生率的文献未行异质性检验。除CTX组感染、带状疱疹和闭经发生率高于AZA组外,余次要结局指标两组差异均无统计学意义。
2.6 CTX与CsA治疗PLN的疗效及其安全性的Meta分析 文献[51]报道了CsA组9个月完全缓解率(OR=0.88,95%CI:0.21~3.66)、18个月完全缓解率(OR=0.29,95%CI:0.06~1.33),9个月部分缓解率(OR=1.51,95%CI:0.43~5.28)、18个月部分缓解率(OR=0.45,95%CI:0.13~1.59),9个月无效率(OR=2.67,95%CI:0.58~12.33)、18个月无效率(OR=2.13,95%CI:0.45~10.10),WBC减少(OR=2.00,95%CI:0.32~12.41)、高血压(OR=0.36,95%CI:0.10~1.33)、闭经(OR=3.00,95%CI:0.11~79.91)、带状疱疹(OR=1.89,95%CI:0.16~22.75)及脓毒血症(OR=2.85,95%CI:0.11~74.34)发生率与CTX组差异均无统计学意义。
表5显示,24 h尿蛋白定量、抗双链DNA抗体和补体C3、血清白蛋白和SCr水平的文献间具同质性;CH50、生长速度、生长速度标准差的文献未行异质性检验。除血清白蛋白水平两组差异无统计学意义外,余次要结局指标两组差异均有统计学意义。
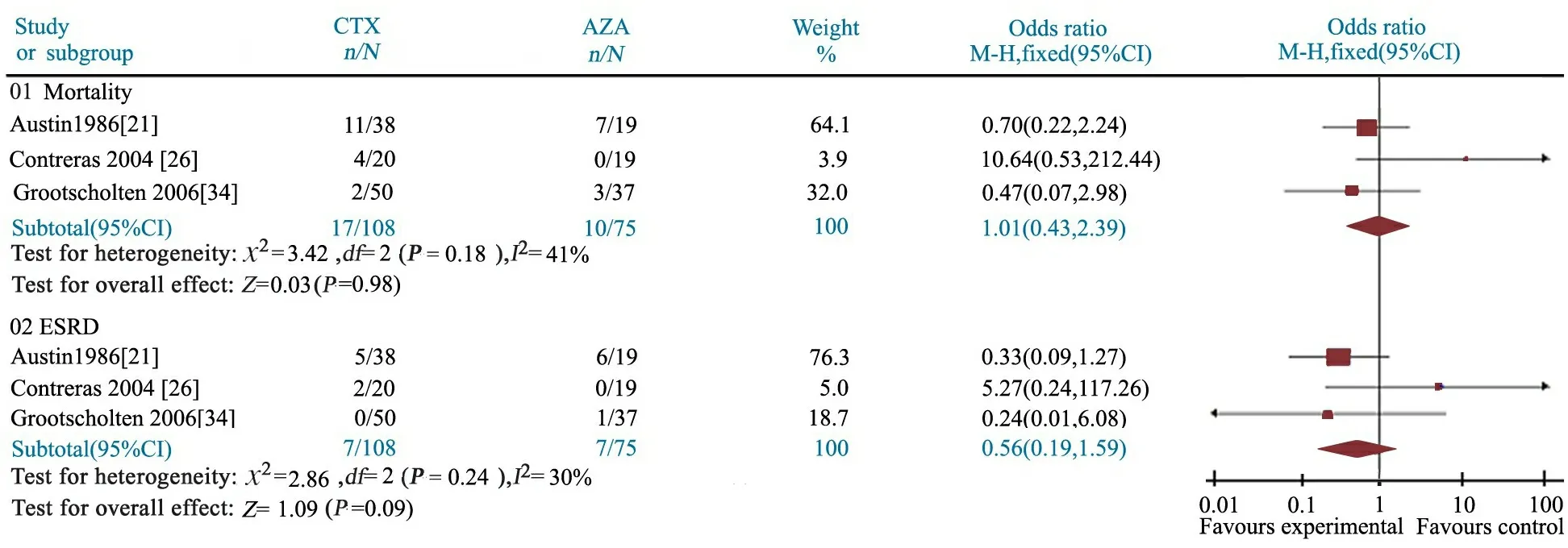
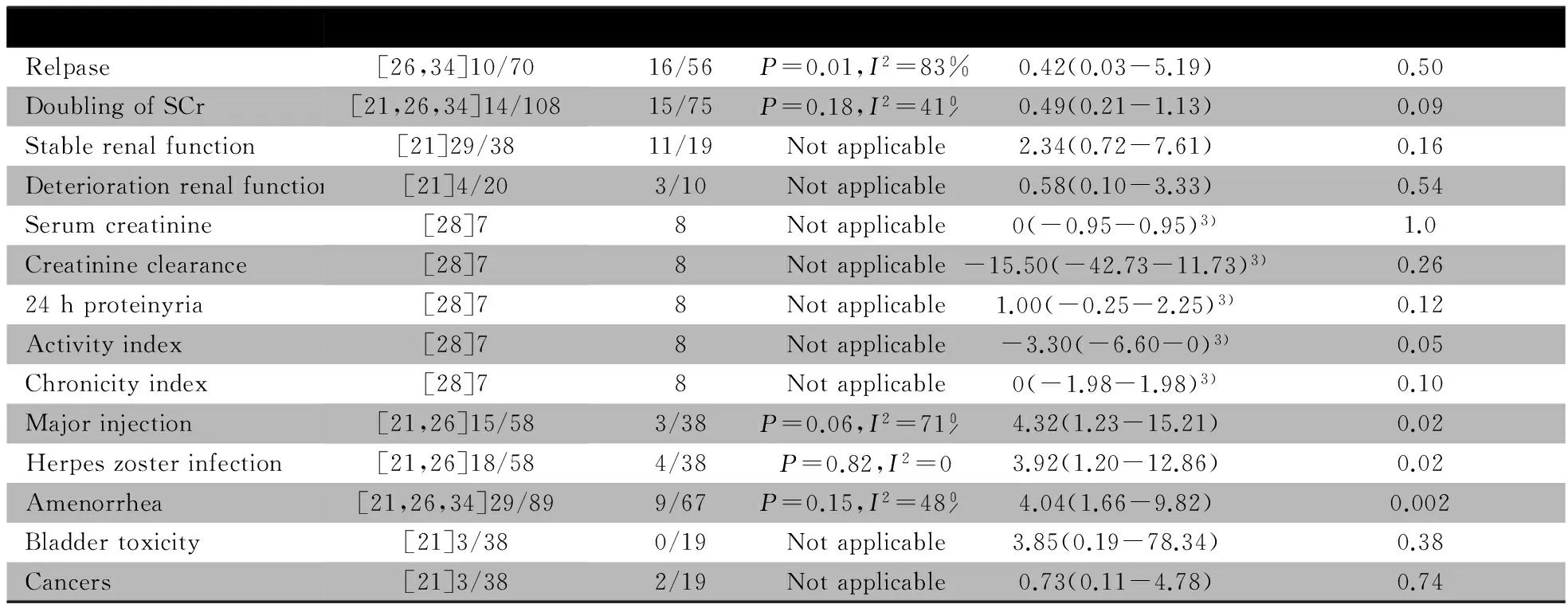
图5 CTX组与AZA组治疗PLN疗效的Meta分析
Notes 1) total events/patients of treatment group; 2)total events/patients of control group;3) data were represented as mean difference
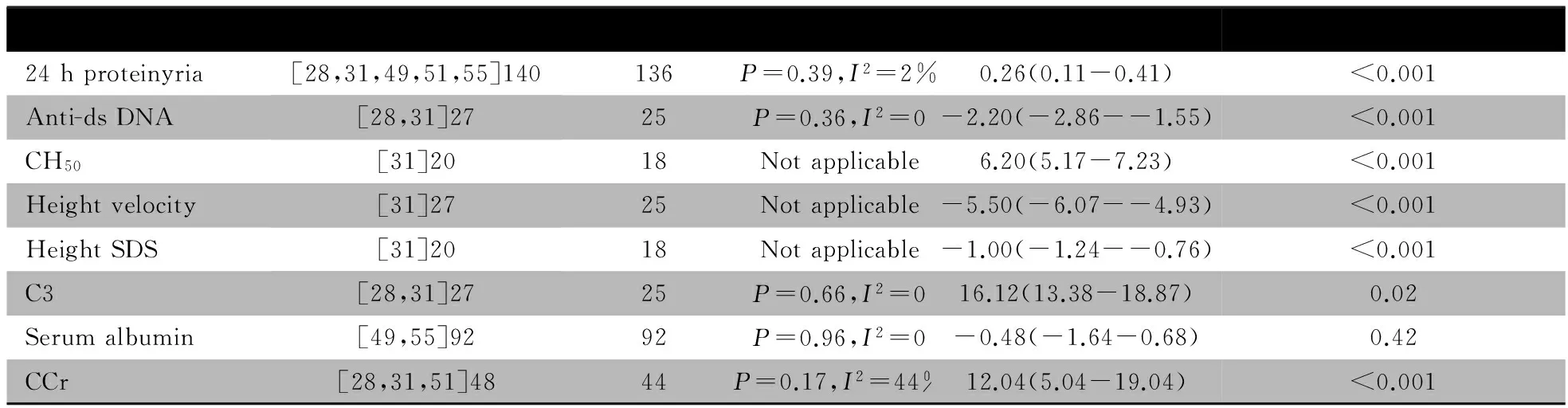
表5 CTX组与CsA组治疗PLN疗效和安全性的Meta分析
Notes 1) total paitients of treatment group; 2)total paitients of control group
2.7 CTX/糖皮质激素联合治疗与 MMF/糖皮质激素联合治疗、CTX/AZA联合治疗与MMF对照治疗PLN疗效和安全性的Meta分析 具体结果可参见笔者前期研究[15],在此不再赘述。
2.8 静脉与口服应用CTX治疗PLN的疗效和安全性 文献[21]报道了两组疗效和安全性的结局指标。静脉给予CTX组病死率(OR=0.39,95%CI:0.09~1.67)、ESRD(OR=0.18,95%CI:0.02~1.83)、SCr倍增(OR=0.65,95%CI:0.14~2.93)、肾功能稳定(OR=1.54,95%CI:0.34~6.93)、肾功能恶化(OR=0.65,95%CI:0.14~2.93)、感染(OR=0.56,95%CI:0.08~3.77)、带状疱疹(OR=0.67,95%CI:0.16~2.73)、闭经(OR=0.38,95%CI:0.07~1.99)、膀胱炎(OR=0.11,95%CI:0.01~2.25)和肿瘤(OR=1.25,95%CI:0.24~6.54)发生率与口服CTX组差异均无统计学意义。
2.9 CTX与FK506治疗PLN的疗效和安全性 文献[52]报道了两组疗效和安全性的结局指标。CTX 组完全缓解率(OR=0.38,95%CI:0.10~1.53)、部分缓解率(OR=1.68,95%CI:0.41~6.96)、高血压(OR=0.47,95%CI:0.04~5.72)、WBC减少(OR=5.65,95%CI:0.25~126.87)、感染(OR=1.94,95%CI:0.38~9.88)、带状疱疹(OR=1.00,95%CI:0.12~8.06)、脱毛症(OR=0.62,95%CI:0.09~4.29)、闭经发生率(OR=8.45,95%CI:0.40~177.29)、SLE-DAI(MD=2.10,95%CI:-0.05~4.25)、24 h尿蛋白定量(MD=0.34,95%CI:-0.57~1.25)、尿RBC计数(MD=17.90,95%CI:-26.12~61.92)、血清白蛋白(MD=-0.39,95%CI:-0.78~-0.00)、补体C3(MD=-0.07,95%CI:-0.22~0.08)及补体C4水平(MD=-0.02,95%CI:-0.08~0.04)与FK506组差异均无统计学意义。
2.10 CTX长期与短期应用治疗PLN的疗效和安全性 文献[23]报道了两组疗效和安全性的结局指标。CTX长期应用组ESRD(OR=0.33,95%CI:0.06~1.97)、SCr倍增(OR=0.33,95%CI:0.07~1.52)、肾功能稳定(OR=3.05,95%CI:0.66~14.14)、肾功能恶化(OR=0.33,95%CI:0.07~1.52)、感染(OR=1.00,95%CI:0.06~17.18)、带状疱疹(OR=0.47,95%CI:0.04~5.69)、闭经(OR=2.71,95%CI:0.50~14.54)和骨毒性(OR=1.42,95%CI:0.27~7.34)发生率与CTX短期应用组差异均无统计学意义。
2.11 静脉与口服应用CTX/AZA联合治疗PLN的疗效和安全性 文献[23]报道了两组疗效和安全性的结局指标。静脉应用CTX/AZA联合治疗组ESRD(OR=2.73,95%CI:0.22~34.01)、SCr倍增(OR=0.38,95%CI:0.01~10.20)、透析(OR=0.21,95%CI:0.01~4.89)、中性粒细胞减少(OR=0.36,95%CI:0.03~3.96)、感染(OR=1.88,95%CI:0.38~9.20)、消化道反应(OR=4.50,95%CI:0.41~49.63)、闭经(OR=1.25,95%CI:0.07~22.13)、恶性肿瘤(OR=3.96,95%CI:0.15~105.65)和出血性膀胱炎(OR=0.38,95%CI:0.01~10.20)发生率与口服CTX /AZA联合治疗组差异均无统计学意义。
2.12 静脉应用CTX 与静脉应用CTX/MP联合治疗PLN的疗效和安全性 文献[39]报道了两组疗效和安全性的结局指标。两组病死率(OR=1.05,95%CI:0.27~4.12)、ESRD(OR=3.00,95%CI:0.12~78.04)、SCr倍增(OR=3.00,95%CI:0.12~78.04)、骨毒性(OR=1.19,95%CI:0.29~4.85)、闭经(OR=1.38,95%CI:0.41~4.62)、带状疱疹(OR=0.74,95%CI:0.23~2.38)和感染(OR=0.74,95%CI:0.23~2.38)发生率差异均无统计学意义。
3 讨论
本Meta分析与其他已发表的Meta分析比较,纳入文献更全面,时效性更强,且均为CTX疗效和安全性的研究;而其他已发表的Meta主要评价不同免疫抑制剂的疗效和安全性。
本Meta分析共纳入37篇RCT文献。文献偏倚评价结果显示,19/37篇文献采用了正确的随机化方法,提示存在一定的选择偏倚;仅6/37篇文献采用了分配隐藏;4篇文献采用盲法,存在测量偏倚的可能性较大;纳入文献均未提及是否选择性报道结果,均未报告其他偏倚来源。提示纳入文献存在偏倚的可能性较大,证据强度偏低。
Pollak 等[56]报道,大剂量糖皮质激素治疗的PLN患者,5年内肾脏的生存率约为40%;随着CTX的应用,CTX联合MP的冲击治疗被认为是治疗PLN的金标准。但近年来随着MMF、AZA及CsA等新型免疫抑制剂的临床应用,为PLN的治疗提供了多种选择。但除与MMF对照的文献较多外,与其他免疫抑制剂对照的文献较少,特别是CTX与CsA、FK506对照的文献仅有1篇,因此尚不能肯定疗效的孰优孰劣。
总结已发表的16项Meta分析[2~12,14~18]结论与本研究也不尽相同。①CTX大剂量与小剂量治疗PLN的疗效:Flanc等[3]认为所有临床指标两组差异均无统计学意义,Lee等[16]认为CTX小剂量治疗的复发率和感染率较低,与本研究结论不一致。②CTX/糖皮质激素联合治疗PLN的疗效:Flanc等[3]认为CTX/糖皮质激素联合治疗较单用糖皮质激素不能显著降低ESRD发生率,与本Meta分析结论不一致。③CTX和AZA治疗PLN的安全性:Flanc等[3]认为两组感染及带状疱疹发生率差异无统计学意义,与本Meta分析结论不一致。④CTX/糖皮质激素联合治疗和MMF/糖皮质激素联合治疗PLN的疗效和安全性:文献[5,7,9]认为,CTX/糖皮质激素联合治疗组的病死率和ESRD发生率更高;文献[4,5,9,10,16]认为,CTX/糖皮质激素联合治疗组的完全缓解率及总缓解率较低,感染、闭经和WBC减少的发生率较高;文献 [3,11]认为两组的疗效接近。Meta分析结论不一致的原因可能与纳入的文献数量和质量有关。
目前,CTX大剂量与小剂量治疗SLE或狼疮性肾炎,普遍接受的观点是应用CTX小剂量可减少药物的不良反应,且可达到与大剂量CTX的相同治疗效果[57,58],这与本研究纳入分析的单篇文献结果均相同,但合并分析后得到结论却不尽相同,这有待于进一步的高质量研究来完善。CTX/糖皮质激素联合治疗与MMF/糖皮质激素联合治疗PLN的疗效可能存在种族差异,Isenberg等[40]研究认为亚州黄种人及白种人群对CTX与MMF反应相近,但黑种人及西班牙人对CTX反应较好,而拉丁美洲人对CTX反应较差,总体来说亚州人群的严重不良反应发生率要高于其他人种。但因仅纳入1篇文献,尚无法得到明确结论。
15%~20% SLE患者为16岁以下的儿童,相比较成人而言,患儿更易并发多脏器损伤,有50%~75%可合并有肾脏的损害[59]。目前CTX治疗儿童SLE及PLN的证据多来自成人的临床研究证据,针对儿童的研究非常少。Fu等[31]纳入10~14岁的PLN患儿,结果提示CsA对PLN的疗效优于CTX,可改善24 h尿蛋白定量,可恢复患儿的生长速度,但仅纳入40例患儿,把握度尚不大,明确结论仍有待探讨。2项观察性研究[60,61]对PLN患儿进行研究,认为CTX治疗PLN有效,但纳入样本量均较小,且观察性研究本身存在偏倚的可能性较RCT更大,因此尚不能下此结论。儿童PLN的治疗还有待于更多高质量的RCT明确。
3.4 本Meta分析的局限性 ①总体研究质量不高,存在着选择、实施和测量偏倚的可能性;②纳入研究的测量指标不统一,观测时间点也不统一,无法对某些信息进行评价;③总体随访时间较短,可能不能真实反映终点指标水平;④纳入的文献仅为中英文文献,纳入的样本量较小,每个Meta分析纳入的文献数量偏少。⑤纳入的文献中,绝大多数病例为成人,不能反映儿童的疗效及安全性。⑥尚未对不同人种的疗效和安全性进行评价。
4 结论
①CTX/糖皮质激素联合治疗较单用糖皮质激素可显著降低ESRD、SCr倍增发生率及复发率,增高肾功能稳定、带状疱疹及闭经的发生率;②CTX/糖皮质激素联合治疗较MMF/糖皮质激素联合治疗可显著降低PLN的完全缓解率及总缓解率,但闭经及WBC减少的发生率较高;③CTX/AZA联合治疗较MMF可显著增高闭经及WBC减少的发生率;④CTX较AZA可显著增高感染、带状疱疹及闭经的发生率;⑤CTX大剂量较小剂量可显著降低病死率及SCr倍增发生率。鉴于本Meta分析的证据强度较低,上述结论需谨慎看待。
[1]Mok CC, Wong RW, Lai KN. Treatment of severe proliferative lupus nephritis: the current state. Ann Rheum Dis, 2003,62(9):799-804
[2]Bansal VK, Beto JA. Treatment of lupus nephritis: a meta-analysis of clinical trials. Am J Kidney Dis, 1997 ,29(2):193-199
[3]Flanc RS, Roberts MA, Strippoli GF, et al. Treatment for lupus nephritis. Cochrane Database of Systematic Reviews, 2004,( 1): CD002922
[4]Ou ST(欧三桃),Zhong LC,Du X,et al. Mycophenolate mofetil for proliferative lupus nephritis: a systematic review.Chin J Evid-based Med (中国循证医学杂志),2006,6(10):712-720
[5]Moore RA , Derry S .Systematic review and meta-analysis of randomised trials and cohort studiesof mycophenolate mofetil in lupus nephritis. Arthritis Res Ther ,2006,8(6):182
[6]Zhu B,Chen N, Lin Y, et al. Mycophenolate mofetil in induction and maintenance therapy of severe lupus nephritis: a meta-analysis of randomized controlled trials. Nephrol Dial Transplant ,2007,22(7): 1933-1942
[7]Walsh M,James M,Jayne D, et al. Mycophenolate mofetil for induction therapy of lupus nephritis: a systematic review and meta-analysis. Clin J Am Soc Nephrol,2007,2(5): 968-975
[8]Qi HL(齐华林), Jiang W, Yan HD. Mycophenolate mofetil for proliferative lupus nephritis: A meta-analysis of randomized controlled trials. J Nephrol Dialy Transplant (肾脏病与透析肾移植杂志),2007,16(5):426-434
[9]Yin L(殷蕾),Zhou W,Jing YL,et al. Comparision of cyclophosphamide versus mycophenolate mofetil in lupus nephritis:a systematic review. J Clin Pediatr (临床儿科杂志),2008,26(1):69-72
[10]Chen MY(陈明玉) , Sun LD , Zhao J,et al. Meta-analysis of mycophenolate mofetil versus cyclophosphamide for diffuse proliferative lupus nephritis. Journal of Xi,an Jiao tong University (Medical Sciences) (西安交通大学学报医学版),2008,29(5):549-555
[11]Mak A, Cheak AA, Tan JY, et al. Mycophenolate mofetil is as efficacious as, but safer than, cyclophosphamide in the treatment of proliferative lupus nephritis: a meta-analysis and meta-regression. Rheumatology (Oxford) ,2009,48(8):944-952
[12]王媛媛.狼疮性肾炎治疗的Meta分析.河北医科大学,内科学,2009
[13]Xiang JH(项金华).Clinical study of mycophenolate mofetil therapy in lupus nephritis.China Medical Engineering(中国医学工程),2007,15(5):428-430
[14]马东锋.狼疮肾炎治疗的系统评价.泸州医学院,内科学,2009
[15]Shen Q(沈琪),Yang T,Ouy XL,et al.Meta-analysis of mycophenolate mofeti treating proliferative lupus nephritis. Chin J Evid Based Pediatr (中国循证儿科杂志),2010,5(1):35-45
[16]Lee YH,Woo JH,Choi SJ,et al.Induction and maintenance therapy for lupus nephritis: a systematic review and meta-analysis. Lupus,2010,19(6): 703-710
[17]Kamanamool N, McEvoy M, Attia J,et al. Efficacy and adverse events of mycophenolate mofetil versus cyclophosphamide for induction therapy of lupus nephritis systematic review and meta-analysis. Medicine (Baltimore), 2010 ,89(4):227-235
[18]Touma Z, Gladman DD, Urowitz MB,et al.Mycophenolate mofetil for induction treatment of lupus nephritis: a systematic review and meta analysis. J Rheumatol, 2011 ,38(1):69-78
[19]Appel GB,ContrerasG, Dooley MA,et al. Mycophenolate mofetil versus cyclophosphamide for induction treatment of lupus nephritis. J Am Soc Nephrol,2009 ,20(5):1103-1112
[20]Sinclair A,Appel G,Dooley MA,et al .Mycophenolate mofetil as induction and maintenance therapy for lupus nephritis: rationale and protocol for the randomized,controlled aspreva lupus management study (ALMS) .Lupus,2007,16(12):972-980
[21]Austin HA,Klippel JH,Balow JE,et al.Therapy of lupus nephritis controlled trial of prednisone and cytotoxic drugs. N Engl J Med,1986,314(10):614-619
[22]Bao H, Liu ZH, Xie HL, et al.Successful treatment of class V+IV lupus nephritis with multitarget therapy. J Am Soc Nephrol,2008,19(10):2001-2010
[23]Boumpas DT, Austin HA, Vaughn EM, et al.Controlled trial of pulse methylprednisolone versus two regimens of pulse cyclophosphamide in severe lupus nephritis. Lancet, 1992,340 (8822):741-745
[24]Chan TM, Li FK, Tang CS ,et al. Efficacy of mycophenolate mofetil in patients with diffuse proliferative lupus nephritis.Hong Kong-Guangzhou nephrology study group. N Engl J Med,2000,343(16): 1156-1162
[25]Chan TM, Tse KC, Tang CS ,et al. Long-term study of myco-phenolate mofetil as continuous induction and maintenance treatment for diffuse proliferative lupus nephritis. J Am Soc Nephrol ,2005,16(4): 1076-1084
[26]Contreras G, Pardo V, Leclercq B ,et al. Sequential therapies for proliferative lupus nephritis. N Engl J Med ,2004, 350(10): 971-980
[27]Donadio JV Jr,Holley KE, FergusonRH, et al. Treatment of diffuse proliferative lupus nephritis with prednisone and combined prednisone and cyclophosphamide.N Engl J Med ,1978,299(21):1151-1155
[28]El-Sehemy MS, Al-Saaran AM, Baddour NM,et al.Comparative clinical prospective therapeutic study between cyclo-phosphamide, cyclosporine and azathioprine in the treatment of lupus nephritis. Egypt J Immunol,2006,13(1):39-52
[29]El-Shafey EM, Abdou SH, Shareef MM.Is mycophenolate mofetil superior to pulse intravenous cyclophosphamide for induction therapy of proliferative lupus nephritis in Egyptian patients? Clin Exp Nephrol, 2010 ,14(3):214-221
[30]Flores-Suarez LF, Villa AR. Preliminary results of an open label randomized clinical trial comparing mycophenolate mofetil (MMF) vs intravenous cyclophosphamide as induction therapy for severe lupus nephritis. Arthritis Rheum ,2004,50(S1):1029
[31]Fu LW, Yang LY, Chen WP, et al. Clinical efficacy of cyclosporin a neoral in the treatment of paediatric lupus nephritis with heavy proteinuria. Br J Rheum, 1998,37(2): 217-221
[32]Ginzler EM, Dooley MA, Aranow C, et al. Mycophenolate mofetil or intravenous cyclophosphamide for lupus nephritis.N Engl J Med ,2005,353(21): 2219-2228
[33]Gourley MF,Austin HA,Scott D,et al.Methylprednisolone and cyclophosphamide, alone or in combination in patients with lupus nephritis, A randomized controlled trial.Ann Intern Med, 1996,125(7):549-557
[34]Grootscholten C,Ligtenberg G,Hagen EC,et al.Azathioprine/methylprednisolone versus cyclophosphamide in proliferative lupus nephritis,A randomized controlled trial. Kidney Int,2006,70(4):732-742
[35]Houssiau FA, Vasconcelos C,D'Cruz D, et al.Immuno-suppressive therapy in lupus nephritis: the Euro-Lupus Nephritis Trial, a randomized trial of low dose versus high-dose intravenous cyclophosphamide. Arthritis Rheum, 2002,46(8):2121-2131
[36]HoussiauFA,Vasconcelos C,D'Cruz D,et al.Early response to immunosuppressive therapy predicts good renal outcome in lupus nephritis: lessons from long-term follow-up of patients in the Euro-Lupus Nephritis Trial. Arthritis Rheum, 2004, 50(12): 3934-3940
[37]Houssiau FA, Vasconcelos C, D'Cruz D, et al.The 10-year follow-up data of the Euro-Lupus Nephritis Trial comparing low-dose and high-dose intravenous cyclophosphamide.Ann Rheum Dis, 2010 ,69(1):61-64
[38]Hu W, Liu Z, Chen H, et al .Mycophenolate mofetil vs cyclophosphamide therapy for patients with diffuse proliferative lupus nephritis. Chin Med J (Engl) ,2002,115(5): 705-709
[39]Illei GG, Austin HA, Crane M,et al. Combination therapy with pulse cyclophosphamide plus pulse methylprednisolone improves long-term renal outcome without adding toxicity in patients with lupus nephritis. Ann Intern Med,2001,135(4):248-257
[40]Isenberg D, Appel GB, Contreras G, et al.Influence of race/ethnicity on response to lupus nephritis treatment: the ALMS study.Rheumatology (Oxford),2010 ,49(1):128-140
[41]Jiang WG(蒋文功),Xiao X,Fang JA. Efficacy of mycophenolate mofetil in patients with difuse proliferative lupus nephriti. Chinese Journal of Integrated Traditional and Western Nephrology (中国中西医结合肾病杂志),2002,3(4):218-221
[42]Liu GP(刘国平),Huang JX,Lin L. Clinical study of mycophenolate mofetil in patients with diffuse proliferative lupus nephritis.Chinese Journal of Integrated Traditional and Western Nephrology (中国中西医结合肾病杂志),2003,4(7):386-388
[43]Mulic-Bacic S, Antic D, Krizic M, et al. Mycophenolate mofetil or intravenous cyclophosphamide in treatment of lupus nephritis. Ann Rheum Dis, 2008,67(S2):349
[44]Ong LM, Hooi LS, Lim TO, et al. Randomized controlled trial of pulse intravenous cyclophosphamide versus mycophenolate mofetil in the induction therapy of proliferative lupus nephritis.Nephrology (Carlton), 2005, 10(5): 504-510
[45]Sabry A, Abo-Zenah H, Medhat T,et al . A comparative study of two intensified pulse cyclophosphamideremission-inducing regimens for diffuse proliferative lupus nephritis: an Egyptian experience. Int Urol Nephrol, 2009, 41(1):153-161
[46]Sesso R, Monteiro M, Sato E,et al. A controlled trial of pulse cyclophosphamide versus pulse methylprednisolone in severe lupus nephritis. Lupus, 1994,3(2):107-112
[47]Steinberg AD,Kaltreider HB,Staples PJ,et al. Cyclophosphamide in lupus nephritis:a controlled trial. Ann Intern Med ,1971,75(2):165-171
[48]Wang J, Hu W, Xie H, et al. Induction therapies for class IV lupus nephritis with non-inflammatory necrotizing vasculopathy: mycophenolate mofetil or intravenous cyclophosphamide. Lupus, 2007,16(9):707-712
[49]Wang LL(王丽丽),Ye RG,Zhang DY,et al.Combination cyclosporin A with cyclophosphamide in patients with lupus nephritis.Chinese Journal of Clinica1 Pharmacology and Therapeutic(中国临床药理学与治疗学杂志),1998,3(2):158-159
[50]Yee CS, Gordon C, Dostal C, et al. EULAR randomised controlled trial of pulse cyclophosphamide and methyl-prednisolone versus continuous cyclophosphamide and prednisolone followed by azathioprine and prednisolone in lupus nephritis. Ann Rheum Dis, 2003, 63(5):525-529
[51]Zavada J, Pesickova S, Rysava R, et al.Cyclosporine A or intravenous cyclophosphamide for lupus nephritis: the Cyclofa-Lune study.Lupus, 2010 ,19(11):1281-1289
[52]Zhang HT(章海涛),Hu WX,Xie HL,et al.Tacrolimus versus intravenous cyclophosphamide in the induction therapy of diffuse proliferative lupus nephritis.J Nephrol Dialy Transplant (肾脏病透析与移植杂志) ,2006,15(6):501-507
[53]Zhang JL(张江林),Zhang X,Ma L,et al. A multicentric and prospective study on mycophenolate mofetil in the treatment of systemic lupus erythematosus. Chin J Rheumatol (中华风湿病学杂志),2002,6(6):406-410
[54]Zhu B(朱彬),Zhou ZA,Liu ZD,et al. Comparision of mycophenolate mofetil therapy versus cyclophosphamide treatment in diffuse proliferative lupus nephritis. Journal of Shan Dong University (Health Science) (山东大学学报医学版),2003,41(6):692-694
[55]Zheng YP(郑颜萍),Wang JX,Ye RG.Comparison of curative effects of cyclosporin A and cyclophophamide on treating lupoid nephritis.Chinese Journal of Integrated Traditional and Western Nephrology (中国中西医结合肾病杂志),2001,2(4):209-211
[56]Pollak V, Pirani CL, Schwartz FD.The natural history of the renal manifestations of systemic lupus erythematosus. J Lab Clin Med, 1964,63:537-550
[57]Bomback AS, Appel GB.Updates on the treatment of lupus nephritis. J Am Soc Nephrol, 2010,21(12):2028-2035
[58]Petri M, Brodsky RA, Jones RJ, et al.High-dose cyclophosphamide versus monthly intravenous cyclophosphamide for systemic lupus erythematosus: a prospective randomized trial. Arthritis Rheum, 2010,62(5):1487-1493
[59]Von Scheven E, Bakkaloglu A. What's new in paediatric SLE? Best Pract Res Clin Rheumatol,2009, 23(5):699-708
[60]Lehman TJ, Onel K.Intermittent intravenous cyclophosphamide arrests progression of the renal chronicity index in childhood systemic lupus erythematosus. J Pediatr,2000, 136(2):243-247
[61]Askenazi D, Myones B, Kamdar A ,et al . Outcomes of children with proliferative lupus nephritis: the role of protocol renal biopsy. Pediatr Nephrol,2007, 22(7):981-986
