肺表面活性物质蛋白B基因多态性与新生儿呼吸窘迫综合征易感性的研究
2011-01-22曾凌空李文斌单瑞艳周玉荣常立文
曾凌空 李文斌 潘 睿 单瑞艳 周玉荣 张 佳 常立文
新生儿呼吸窘迫综合征(NRDS)是新生儿期常见的肺部疾患,多见于早产儿,且胎龄越小发病率越高。欧洲2010年颁布的NRDS指南[1]显示,NRDS发病率在胎龄30~31周为52%,28~29周为74%,26~27周为88%,23~25周高达91%。NRDS发病机制是肺泡表面活性物质缺乏。晚近较多研究关注基因对NRDS发病的影响,有研究表明肺泡表面活性物质蛋白B(SPB)基因多态性是发生NRDS的危险因素之一[2]。SPB-18基因位于转录启动子上游,是一个转运启动信号,能影响转录功能,使SPB的分泌水平产生变化;SPB1580C/T多态性可改变N端糖基化位点,对SPB的加工处理过程有影响,可导致SPB蛋白功能改变,SPB前蛋白在不成熟肺组织中表达较高,且受SPB1580基因调控。SPB-18A/C和SPB1580C/T基因多态性可影响患儿肺组织中SPB水平,可能与NRDS发病有关,但SPB基因多态性存在人种差异。本研究通过探讨上述两个基因位点多态性与NRDS易感性的关系,为NRDS的诊治提供新的理论依据。
1 方法
本研究为病例对照研究,收集NRDS的诊断病例,并按1∶2比例收集胎龄和出生体重相匹配的无明显感染症状早产儿为对照组。纳入的病例均获得家长知情同意。
1.1 NRDS组纳入标准 ①在华中科技大学同济医学院附属同济医院住院的汉族NRDS患儿;②NRDS诊断符合欧洲2010年颁布的NRDS诊断标准[1]:生后12 h内开始进行性呼吸困难加重,吸空气PaO2<50 mmHg,有中心性发绀或需要吸氧才能维持PaO2>50 mmHg(1 mmHg=0.133 kPa),同时胸部X线片提示毛玻璃样改变、支气管充气征和“白肺”等特异性表现。
1.2 对照组纳入标准 ①胎龄<36周因新生儿黄疸住院的患儿,按胎龄和出生体重与NRDS组患儿匹配;②胸部X线片提示无肺部感染和NRDS表现;③血常规和CRP检查提示无明确感染者。
1.3 排除标准 NRDS组和对照组均排除:①严重先天性疾病,如复杂型先天性心脏病、膈疝和脑发育不良等;②遗传代谢性疾病,如苯丙酮尿症、先天性甲状腺功能低下和糖尿病等;③母亲孕后期明确感染史,新生儿生后IgM升高。
1.4 DNA提取 DNA由外周血白细胞中提取,采用经典酚提取法。3 mL血中加入2 mL PBS 混匀,3 000 r·min-1离心15 min,弃上清,向沉淀加入300 μL细胞裂解液 ,37℃水浴60 min,再加入20%十二烷基硫酸钠50 μL和蛋白酶K(20 mg·mL-1)10 μL水浴过夜。次日取经消化的细胞液300 μL,按31∶1加入酚-氯仿-异戊醇(251∶241∶1),混匀10 min,3 000 r·min-1离心10 min,将上层水相移入另一EP管中重复抽提1次。取上层水相再用200 μL氯仿抽提1次,离心后,取上层水相加入2倍体积冷冻无水乙醇及1/30体积2 mmol·L-1醋酸钠,析出DNA,12 000 r·min-1离心10 min,弃上清,以70%乙醇洗涤DNA 2次,加入30~50 μL三羟甲基氨基甲烷-乙二胺四乙酸充分溶解DNA,采用分光光度法测定DNA浓度,分装,-20℃保存。
1.5 单核苷酸多态性(SNP)分析 采用PCR-RFLP及基因测序技术检测SPB-18A/C及SPB1580C/T多态性。
SPB-18引物上游5′-GTCCAGCTATAAGGGGCCGTG,下游GTGAGTGGTGGAGCTGCCTA。反应体系:PCR 2×Mix 10 μL(DBI公司),模板DNA 0.8 μL,上下游引物各1.0 μL,去离子水10 μL。PCR条件:95℃ 3 min,95℃ 30 s,60℃ 1 min,70℃ 1 min,退火温度从60℃降至55℃,每个循环降1℃ ,5个循环,重复1次;95℃ 30 s,55℃ 1 min,70℃ 1 min,共29个循环;72℃延伸5 min。SPB-18 酶切:反应体系为Apapl酶0.5 μL(Takara公司10 U·μL-1),10×buffer 2 μL,PCR产物5 μL,去离子水20 μL,37℃消化6~12 h。
SPB1580引物上游:5′-CTCGAATTCACTCGTGA-ACTCCAGCACCC-3′,下游:5′- GTGAGCTTGCAGCCCTCTC-A-3′。 PCR反应体系: PCR 2×Mix 10 μL,模板DNA 1.2 μL,上下游引物各0.8 μL,去离子水10 μL。PCR反应条件:95℃ 3 min;95℃ 45 s, 退火温度67℃至58℃, 72℃ 1 min,每个循环降1℃,共10个循环;95℃ 45 s,57℃ 1 min,72℃ 1 min,共30个循环;72℃ 10 min延伸。SPB1580酶切:酶切反应体系为DdeⅠ酶0.25 μL (Toyobo公司10 U·μL-1),PCR产物6 μL,10×buffer 3 μL,去离子水20 μL,37℃消化4~6 h。
电泳:上述产物酶切后取15 μL酶消化产物与3 μL 6×上样缓冲液混合,分别上样于15% (SPB-18)和8% (SPB1580)聚丙烯酰胺凝胶, 120 V恒压电泳1.5~2.5 h,硝酸银染色后参照DNA相对分子质量根据电泳条带判断基因型,如图1所示。
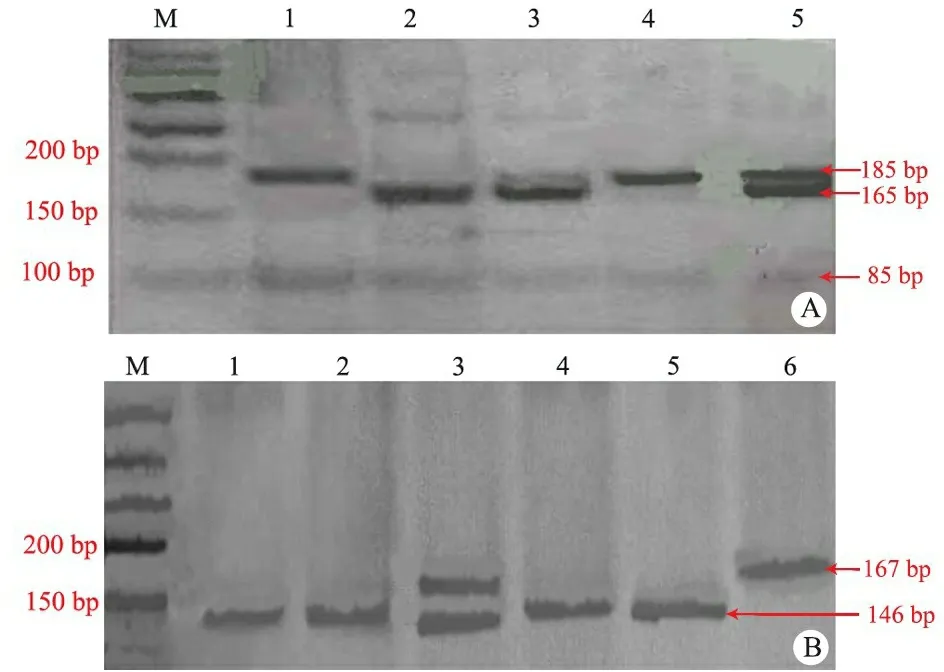
图1 SPB1580和 SPB-18酶切后聚丙烯胶电泳图
Fig 1 PAGE of SPB1580 and SPB-18 after enzymolysis
Notes A:SPB1580, bands 3 and 5 showed CT genotype, the lengths of the fragments were 185 bp, 165 bp, 85 bp and 20 bp; band 2 showed CC genotype(165 bp, 85 bp and 20 bp); bands 1 and 4 showed TT genotype(185 bp and 85 bp); B:SPB-18, bands 1, 2, 4 and 5 showed AA genotype, the lengths of the fragments were 146 bp and 21 bp; band 3 showed AC genotype(167 bp, 146 bp and 21 bp); band 6 showed CC genotype(167 bp)
基因测序: 从基因酶切结果中随机选取20%样本进行基因测序,以验证PCR-RFLP结果。
1.6 统计学分析 基因型和等位基因频率采用直接计数法统计,以Hardy-Weinberg平衡检验确定样本的群体代表性。计数资料采用χ2检验。P<0.05为差异有统计学意义。应用SPSS 13.0软件进行统计分析。
2 结果
2.1 一般情况 2008年5月至2010年5月进入本文分析的NRDS患儿91例,其中男51例、女40例;基因检测时年龄(31.3±3.6)周,体重(1 320±308)g。对照组182例,其中男98例、女84例;基因检测时年龄(31.9±4.2)周,体重(1 335±317)g。两组性别、基因检测时年龄和体重均具可比性(P>0.05)。
2.2 SPB-18和SPB1580基因多态性分布结果代表性 本组中SPB-18和SPB1580基因多态性分布的实际值和预测值差异无统计学意义,χ2分别为0.77和0.73,均P>0.05,符合Hardy-Weinberg平衡,说明研究人群具有代表性。基因测序结果与PCR-RFLP结果无差异。
2.3 SPB-18A/C多态性在NRDS和对照组分布 表1所示,NRDS组AA、AC和CC基因型频率分别为11.0%、40.7%和48.4%,对照组分别为6.6%、31.1%和62.1%,两组3种基因型分布差异均无统计学意义。NRDS组A等位基因频率为31.3%,对照组为22.3%,差异有统计学意义。
2.4 SPB1580T/C多态性在NRDS和对照组分布 表2所示,NRDS组TT、CT和CC基因型频率分别为5.5%、30.8%和63.7%,对照组分别为6.6%、45.1%和48.4%,两组3种基因型分布差异均无统计学意义。NRDS组C等位基因频率为79.1%,对照组为70.9%,两组差异有统计学意义。
表1 SPB-18多态性在NRDS和对照组的分布[n(%)]
Tab 1 The distributions of genotype and allale of SPB-18 in NRDS and control groups[n(%)]

GroupsAllelefrequencyAAACCCGenotypefrequencyACControl125711381283(n=182)(6.6)(31.3)(62.1)(22.3)(77.7)NRDS10374457125(n=91)(11.0)(40.7)(48.4)(31.3)(68.7)χ24.9825.280P0.0830.022
表2 SPB1580多态性在NRDS和对照组的分布[n(%)]
Tab 2 The distributions of genotype and allale of SPB1580 in NRDS and control groups[n(%)]
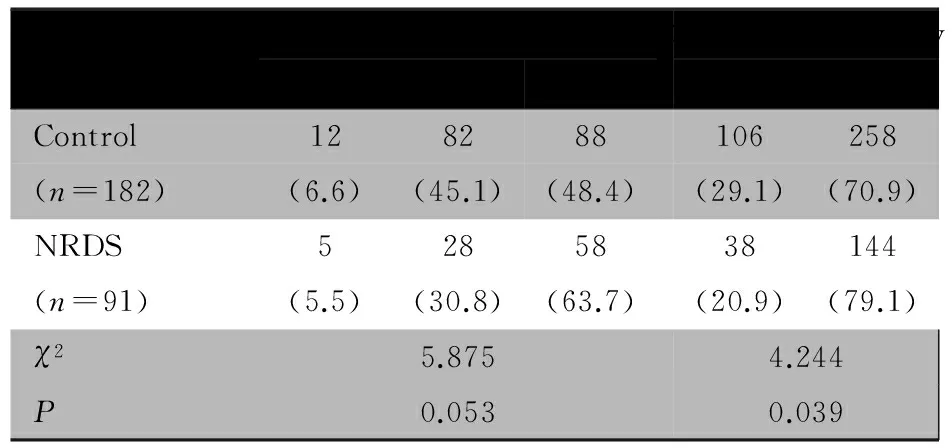
GroupsAllelefrequencyTTCTCCGenotypefrequencyTCControl128288106258(n=182)(6.6)(45.1)(48.4)(29.1)(70.9)NRDS5285838144(n=91)(5.5)(30.8)(63.7)(20.9)(79.1)χ25.8754.244P0.0530.039
2.5 不同种族SPB-18 A等位基因频率分布 本研究汉族人、巴西人[3]、美国人[4]和丹麦人[5]SPB-18等位基因A频率分别为31%(57/182频次)、58%(174/300频次) 、57%(249/436频次)和61%(12 490/20 462频次),差异有统计学意义(P<0.05)。
2.6 不同种族SPB1580 C等位基因频率分布 本研究汉族人、美国人[6]、巴西人[3]和丹麦人[5]SPB1580等位基因C频率分别为79%(144/182频次)、35%(278/804频次)、41%(126/300频次)、46%(9 389/20 462频次),差异有统计学意义(P<0.05);与日本人群[7]等位基因C频率(72%,345/482频次)差异无统计学意义(P>0.05)。
3 讨论
肺泡表面活性物质结合蛋白(SPs)包括SPA、SPB、SPC和SPD。其中SPB虽然仅占所有表面活性物质的2%,却有不可替代的作用。遗传性的SPB缺乏是致命的。在活体内给予抗SPB抗体可致NRDS。在SPs缺乏的动物模型中,给予SPB治疗可改善肺顺应性和氧合作用。研究表明SPB在体外有许多生理学活性,如促进磷脂在液气表面吸附,稳定单分子层的表面活性剂膜,在塌陷肺泡表面膜的再分布等[8]。
有研究表明,SPB基因多态性与NRDS易感性相关[9~11]。SPB基因的多态性位点目前研究最多的是SPB-18C/A、 1013C/A、 1580C/T、和9306A/G[12,13]。本研究的靶基因位点SPB-18是GC丰富的重复片段,位于TATA BOX侧方,重复片段的上游一半在-35位点与SP1联接[13,14]。SPB-18基因位于转录启动子上游,TATA box下游15 bp,是一个转运启动信号,能影响转录功能,使SPB蛋白的分泌水平产生变化。有研究应用荧光标记法发现C等位基因比A的转录效率更高,并发现SP1与C等位基因结合比A等位基因更紧密。基因型为CA的正常志愿者肺泡灌洗液中SPB水平比AA者高2.6倍。AA基因型人群肺泡灌洗液中SPB水平较低[4]。 SPB1580C/T多态性可改变N端糖基化位点。等位基因位为C(ACT,苏氨酸)时,在天冬酰胺129-谷氨酰胺130-苏氨酸131(ACT)处有糖基化位点,等位基因为T(ATT,异亮氨酸)时,则无糖基化位点。氨基末端糖基化对SPB的加工处理、分泌和折叠等过程均有影响,可导致SPB蛋白水平和功能改变[15]。SPB前蛋白在不成熟肺组织中高,且受SPB1580基因调控[16]。这两个位点基因多态性可影响患儿肺组织中SPB蛋白水平,可能与NRDS发病有关。
本研究结果可见,NRDS组SPB-18 A等位基因频率显著高于对照组(31.3%vs22.3%);SPB1580 C等位基因频率显著高于对照组(79.1%vs70.9%),提示该2个基因多态性是NRDS发病的危险因素,这与巴西的研究结果不一致[17]。引起NRDS发病机制较为复杂,可能是多个因素共同决定。有病例对照研究发现在NRDS患儿中SPB内含子4长度多态性与SPA基因多态性协同变化比其单独变化显著,提示SPB和SPA可能共同作用于NRDS发病。另外发现SPB-18A/C和SPB1013存在不平衡的连锁关系,SPB-18位的A和1013C/A位点的C连锁 。Floros 等[2]的家族相关性研究观察了132个家庭,每个家庭至少有1例新生儿患NRDS,进行多等位基因家系相关性分析,该研究NRDS的诊断标准主要依据临床指标,对胸部X线片的特异性表现没有严格要求,但统计学指标较严格。该研究发现NRDS 保护基因为SPB-18A/1013C/1580T/9306G, SBP-18A/1013A/1580T/9306A。易感基因为SBP-18A/1013C/1580T/9306A[21]。以上研究提示遗传因素与NRDS发病的联系是多样的和协同的。不同种族人群中SPB-18A/C和SPB1580C/T基因多态性分布显著不同。本研究文献复习其他种族SPB基因多态性位点数据,发现本研究汉族人SPB1580 C、SPB-18A等位基因频率与美国、丹麦和巴西人差异均有统计学意义;SPB1580C等位基因频率与日本人群差异不显著。提示同位于东亚地区的中国和日本,由于地域和人种上较为接近,SPB-18A等位基因频率可能不存在明显的差异;而美国、丹麦和巴西人群与本研究汉族人群差异显著。
本文的初步研究发现,SPB-18A/C和SPB1580C/T基因多态性与NRDS发病的联系,但仍存在一定的不足之处和局限性:本研究样本量有限,尽管研究者尽量平衡引起NRDS的其他危险因素,比如胎龄、出生体重等,结果仍可能产生一定的偏倚。理想的遗传关联性研究样本量应在1 000例以上。国外的多项研究结论亦不尽相同,除了与以上因素有关外,还与不同人种的基因差异有关。下一步将应用家系为基础的相关性研究,如传递不平衡分析等。扩大样本量,探讨NRDS与SPB上多基因位点及SPB与其他SP基因协同作用的关系。
[1]Sweet DG, Carnielli V, Greisen G,et al.European consensus guidelines on the management of neonatal respiratory distress syndrome in preterm infants-2010 update.Neonatology,2010,97(4):402-417
[2]Floros J, Thomas NJ, Liu W, et al.Family-based association tests suggest linkage between surfactant protein B (SP-B) (and flanking region) and respiratory distress syndrome (RDS): SP-B haplotypes and alleles from SP-B-linked loci are risk factors for RDS.Pediatr Res, 2006,59(4 Pt 1):616-621
[3]Lyra PP, Vaz FA, Moreira PE, et al.Comparison of surfactant protein B polymorphisms of healthy term newborns with preterm newborns having respiratory distress syndrome.Braz J Med Biol Res, 2007,40(6):779-786
[4]Steagall WK, Lin JP, Moss J. The C/A(-18) polymorphism in the surfactant protein B gene influences transcription and protein levels of surfactant protein B.Am J Physiol Lung Cell Mol Physiol, 2007,292(2):448-453
[5]Bokvad-Hansen M, Nordestgaard BG, Dahl M.Surfactant protein-B polymorphisms, pulmonary function and COPD in 10,231 individuals.Eur Respir J, 2010
[6]Quasney MW, Waterer GW, Dahmer MK, et al.Association between surfactant protein B + 1580 polymorphism and the risk of respiratory failure in adults with community-acquired pneumonia.Crit Care Med, 2004,32(5):1115-1119
[7]Sumita Y, Sugiura T, Kawaguchi Y, et al.Genetic polymorphisms in the surfactant proteins in systemic sclerosis in Japanese: T/T genotype at 1580 C/T (Thr131Ile) in the SP-B gene reduces the risk of interstitial lung disease.Rheumatology (Oxford),2008,47(3):289-291
[8]Sarker M, Waring AJ, Walther FJ, et al.Structure of mini-B, a functional fragment of surfactant protein B, in detergent micelles.Biochemistry,2007,46(39):11047-11056
[9]Haataja R, Ramet M, Marttila R, et al.Surfactant proteins A and B as interactive genetic determinants of neonatal respiratory distress syndrome.Hum Mol Genet, 2000,9(18):2751-2760
[10]Floros J, Fan R, Diangelo S, et al.Surfactant protein (SP) B associations and interactions with SP-A in white and black subjects with respiratory distress syndrome.Pediatr Int,2001,43(6):567-576
[11]Fan R, Floros J, Xiong M. Transmission disequilibrium test of two unlinked disease loci: application to respiratory distress syndrome.Adv Appl in Stat,2002,1:277-308
[12]Hu R, Xu Y,Zhang Z, et al. Surfactant protein B 1580 polymorphism is associated with susceptibility to chronic obstructive pulmonary disease in Chinese Han population. J Huazhong Univ Sci Technolog Med Sci, 2004,24(3): 216-218
[13]Lin Z, Pearson C, Chinchilli V,et al.Polymorphisms of human SP-A, SP-B, and SP-D genes: association of SP-B Thr131Ile with ARDS.Clin Genet, 2000,58(3):181-191
[14]Margana R, Berhane K, Alam MN, et al.Identification of functional TTF-1 and Sp1/Sp3 sites in the upstream promoter region of rabbit SP-B gene.Am J Physiol Lung Cell Mol Physiol,2000,278(3):477-484
[15]Wang G, Christensen ND, Wigdahl B, et al.Differences in N-linked glycosylation between human surfactant protein-B variants of the C or T allele at the single-nucleotide polymorphism at position 1580: implications for disease.Biochem J,2003,369(Pt 1):179-184
[16]Hamvas A, Heins HB, Guttentag SH, et al.Developmental and genetic regulation of human surfactant protein B in vivo.Neonatology, 2009,95(2):117-124
[17]Liu W, Bentley CM, Floros J.Study of human SP-A, SP-B and SP-D loci: allele frequencies, linkage disequilibrium and heterozygosity in different races and ethnic groups.BMC Genet, 2003,4(1):13
