Nav1.5钠离子通道P环E375残基侧链负电荷决定通道的电导与稳态失活
2011-01-17胡振盛赵钟钟
胡振盛, 郭 佳, 陈 文, 庄 重,赵钟钟,2, 张 朝,2
1.江苏省分子医药生物技术重点实验室,南京师范大学生命科学学院,南京 210046;2.江苏省医药超分子材料及应用重点实验室,南京 210046
引言
电压门控型钠离子通道在神经元、骨骼肌和心肌等可兴奋组织的动作电位产生过程中起着重要作用。在临床上,钠离子通道是多种药物 (如麻醉剂、抗惊厥剂和抗心律失常药)的作用靶点,其编码基因突变将导致肌强直、心律不齐、癫痫等多种遗传性钠“通道病”(sodium"channelopathies")的发生[1~3]。
钠离子通道的主要功能亚基α由一条肽链反复跨膜形成的4个结构域构成,每个结构域包含6个跨膜片段 (S1~S6)。其中,S4富含带正电荷的侧链氨基酸 (赖氨酸和精氨酸),对膜的去极化敏感,是通道的电压感受器 (voltage sensor);S5与S6之间的连接肽段形成发卡样结构半嵌入膜内,被称为P环 (pore loop)[4~6],在通道的通透性和离子选择性中发挥着重要作用[7~9]。
氨基酸序列分析表明,由P环形成的钠离子通道内衬的外口结构中,至少含有一套高度保守的负电氨基酸残基环,由两个谷氨酸 (E)和两个天冬氨酸 (D)顺序排列而成(图1)[8,10]。Chiamvimonvat等[11,12]在研究大鼠骨骼肌钠通道 (Nav1.4)的功能时发现,将上述4个氨基酸突变为半胱氨酸 (C),即中和侧链的负电荷,会引起通道电导的显著改变;有趣的是,跨膜结构域Ⅰ中的E403C突变,使单通道记录的电流呈现独特的反复振荡现象 (flick)。Zhang等[13]在全细胞记录模式下发现,E403C突变使钠通道从失活状态恢复的时间明显延长,用巯基修饰剂MTSES恢复E403侧链的负电荷后,可以消除这种现象。
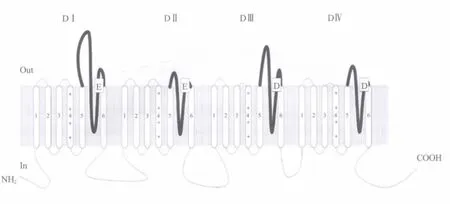
图1 包含四个结构域(DⅠ~DⅣ)的电压门控型钠离子通道结构示意图 “E”和“D”表示通道外口处P环保守性负电荷侧链的氨基酸残基,“+”表示电压感受器S4富含的正电荷侧链氨基酸残基Fig.1 A diagram of the structure of voltage-gated sodium channel containing 4 dom ains(DⅠ~DⅣ) "E" and"D"represent conservative negatively charged residues of P-loops in the outer mouth of sodium channel,"+" represents positively charged residues in voltage sensors
E403C突变对通道门控作用的影响是否的确由谷氨酸侧链的负电荷被中和而引起?此部位负电荷的作用是否具有普遍性?为了回答这些问题,我们采用基因定点突变、real-time PCR、Western blotting和全细胞膜片钳等实验技术,将人心肌钠离子通道Nav1.5结构域Ⅰ中P环375位高度保守的负电性谷氨酸残基 (E375),分别突变为电中性的丙氨酸 (A)、正电性的赖氨酸 (K)和负电性的天冬氨酸 (D),记录了不同钠通道突变体在人胚肾上皮细胞HEK293中表达后的全细胞电流,并对其动力学性质进行了分析。
材料与方法
实验材料与仪器
含有人心肌钠离子通道 α亚基 (Nav1.5,hH1)和β亚基 (hβ1)cDNA的质粒pcDNA3.1-SCN5A和pcDNA3.1-SCN5B,由美国哥伦比亚大学药理学系Robert S.Kass教授友好提供。含绿色荧光蛋白cDNA的质粒pcDNA3.1-EGFP为本实验室所有。
使用的主要仪器有:HERACELL150i CO2培养箱 (Thermo Scientific,USA),IX71荧光倒置显微镜 (Olympus,Japan),TW 150-4微电极玻璃毛细管 (World Precision Instrument,USA),P-97微电极拉制仪 (Sutter Instrument,USA),Axopatch 200B膜片钳放大器(Molecular Devices,USA),以及Digidata 1440A数模转换器 (Molecular Devices,USA)。
钠离子通道基因定点突变
将野生型钠通道重组质粒用Eco81I(TaKaRa)进行酶切,得到包含E375位点的318 bp的片段,将其作为模板,用突变正向引物 (E375A:5'CCTGAGGGTCTGCTGATAGAGGCGCGCCCAGCAGT 3';E375D:5'CCTGAGGGTCTGCTGATAGAGGCGGTCCCAGCAGT 3';E375K:5'CCTGAGGGTCTGCTGATAGAGGCGCTTCCAGCAGT 3')和反向引物(5'CCTAAGGCACAAGTGCGTGCGCAACTTCACAGCGCT 3')进行PCR扩增,产物纯化后经Eco81I酶切,用T4 DNA连接酶 (TaKaRa)连接至原质粒中。
细胞培养与转染
人胚肾上皮细胞HEK293用含10%胎牛血清 (Hyclone)和1%双抗的DMEM培养基(Gibco)培养,以30%的密度传代于3.5 cm培养皿,24 h后用脂质体法 (Lipofectam ine 2000, Invitrogen)转染,质粒转染量为:hH1重组质粒 (野生型或突变型)0.5μg、hβ1重组质粒0.3μg、EGFP重组质粒0.2μg,平行共转染于HEK293细胞。
Real-tim e PCR检测钠离子通道的m RNA表达水平
转染后 36 h,用 TRIzol试剂 (Invitrogen)提取细胞总 RNA,经 Nanodrop (Spectrophoto meter)定量后,以Oligo(dT)和Random hexamers为引物,用反转录试剂盒(TaKaRa)反转录为cDNA。以反转录的cDNA为模板,用基因特异性引物,进行定量PCR (SYBR Green,TaKaRa),以18S rRNA作为内参。
Western blotting检测钠离子通道蛋白表达水平
转染后36~48 h,提取细胞总蛋白,经SDS-PAGE并转移至PVDF膜,封闭液处理1 h后,用Nav1.5抗体 (A lomone,Israel)和内参GAPDH抗体孵育过夜,洗脱一抗,用辣根过氧化物酶标记的二抗孵育2 h,进行DAB显色。
全细胞膜片钳记录钠电流
转染后36~48 h,选取带有绿色荧光的转染阳性细胞进行全细胞电流记录。细胞外液成分 (mmol/L):NaCl 140、KCl 5、CaCl22、MgCl21、Glucose 10、HEPES 10,用NaOH调节pH至7.4;电极内液成分 (mmol/L):NaCl 35、CsF 105、MgCl21、HEPES 10、EGTA 10,用CsOH调节pH至7.2。电极入液后,电阻为2.2~3.3MΩ;负压吸引至高阻抗封接 (>1 G)后,给予快、慢电容补偿;破膜后将串联电阻补偿至80%以上。将Clampex10.0数据采集软件 (Molecular Devices,USA)的采样频率设置为5 kHz,滤波2 kHz[13,14]。
数据分析与统计
钠离子通道稳态激活过程中,不同电压下的电导由公式(1)(Vm为膜电位,Vrev为反转电位)计算,并以最大电导进行标准化处理。

以去极化电压为横坐标、标准化电导为纵坐标,用Boltzmann方程(2)拟合得到稳态激活曲线 (V1/2为半激活电压,k为斜率因子)。

用双脉冲刺激检测通道的稳态失活过程,以预刺激脉冲的去极化电压为横坐标、检验脉冲下的标准化电流I/Imax为纵坐标,用Boltzmann方程(3)拟合得到稳态失活曲线 (V1/2为半失活电压,k为斜率因子)[14]。

所记录的电流用 Clampfit10.0(Molecular Devices,USA)和 Origin6.0(M icrocal Software)分析,数据以Mean±SEM表示,野生型与突变型电流密度的差异采用两样本均数比较的t检验进行统计,以P<0.05为有显著性差异。
结果
野生型钠离子通道的全细胞钠电流记录
在荧光显微镜下选取带绿色荧光的转染阳性细胞进行全细胞钠电流记录。将细胞膜电位钳制于-140mV,随后给予电压从-90到+60mV、阶越5mV、持续30ms的脉冲刺激,记录不同电压条件下的钠电流INa。由图2A和B可见,通道在-50mV左右开始激活,随去极化程度的增加,激活电流逐渐增大,在-30mV达到峰值,而后随着进一步去极化又逐渐减小,所记录的电流符合典型心肌钠电流的特征[13,14]。

图2 野生型与突变型钠离子通道全细胞电流的比较 (A)野生型与突变型钠离子通道的稳态激活电流。细胞膜电位钳制于-140mV,给予电压从-90到+60mV、阶越5mV、持续30ms的脉冲。(B)野生型和突变型钠离子通道稳态激活的I-V曲线。*P<0.01,E375A和E375K与野生型相比。(C)野生型和突变型钠离子通道电流密度峰值的统计结果。*P<0.01,E375A与野生型相比;**P<0.01,E375K与E375A相比Fig.2 Who le-ce ll current com parison of wild-type(WT)and m utant sodium channe ls (A)Steady-state activation currents of WT and mutant sodium channels elicited with 30 ms depolarizing steps in 5 mV increment from -90 to +60 mV.(B)Steady-state activation I-V curves of WT and mutant sodium channels.*P<0.01,E375A and E375K compared with WT.(C)Statistic peak current density of WT and mutant sodium channels.*P<0.01,E375A compared with WT,**P<0.01,E375K compared w ith E375A
E375突变对全细胞钠电流密度的影响
如图2A~C所示,将E375残基突变为丙氨酸 (E375A),使其侧链负电荷被中和,突变体钠通道的电流仍呈现典型心肌钠电流的特征,但与野生型不同的是,E375A突变体的电流密度显著减小,峰值由野生型的33.50 pA/pF减为10.72 pA/pF;将E375残基突变为赖氨酸 (E375K),使其侧链带正电荷,全细胞钠电流密度减小为5.28 pA/pF,与野生型和E375A相比均有显著差异 (P<0.05);反之,通过天冬氨酸突变 (E375D)恢复E375侧链的负电荷后,全细胞钠电流又恢复至野生型水平。
E375突变对钠离子通道稳态激活和稳态失活的影响
用Boltzmann方程分别拟合得到钠离子通道的稳态激活曲线和稳态失活曲线 (图3,表1)。由稳态激活曲线可见,E375A和E375K突变钠通道的半激活电压分别显著左移11.33和13.83mV,斜率因子分别减小0.6和0.31;E375D半激活电压显著左移7.89mV,斜率因子减小0.5。

图3 E375突变对钠离子通道Nav1.5门控动力学的影响 用Boltzmann方程分别拟合得到的野生型和突变型钠离子通道稳态激活曲线(A)和稳态失活曲线(B)。*P<0.05,突变型与野生型相比;**P<0.05,E375K与E375A相比Fig.3 Effect of E375 m utation on Nav1.5 gating kinetics Steady-state activation curves(A) and steady-state inactivation curves(B)of WT and E375A,E375K,E375D mutant sodium channels,conductance from individual cells were normalized to single Boltzmann function fits.*P<0.05,mutant compared with WT;**P<0.05,E375K compared with E375A

表1 钠离子通道稳态激活与稳态失活的动力学参数比较Table 1 Com parison of steady-state activation and steady-state inactivation of sodium channel gating kinetics
由稳态失活曲线可见,E375A和E375K突变钠通道的半失活电压分别显著右移6.38和9.92mV,斜率因子分别显著增加1.14和1.16;而E375D的半失活电压和斜率因子与野生型相比无显著差异。
钠离子通道及其突变体在HEK293细胞中的表达
分别提取总mRNA和总蛋白进行real-time PCR和Western blotting,以检测钠离子通道的表达情况。结果显示,野生型与突变型钠离子通道均可在HEK293细胞中表达,且在mRNA水平和蛋白水平上的表达无显著差异 (图4)。


图4 野生型与突变型钠离子通道的表达 (A)Real-time PCR检测野生型和突变型钠离子通道mRNA的表达水平;(B、C)Western blotting检测野生型和突变型钠离子通道蛋白的表达水平Fig.4 Expression of WT and m utant sodium channel (A) Real-time PCR analysis of WT and mutant Nav1.5 mRNA expression level;(B,C) Western blotting analysis of WT and mutant Nav1.5 protein level
讨论
自从钠离子通道基因首次被成功克隆以来,研究者结合分子克隆、基因定点突变、基因异源表达和膜片钳等技术,对离子通道的结构、功能及其调节进行了许多研究,为我们理解离子通道的结构、功能及其调节提供了有价值的信息。P环是影响离子通道通透性和离子选择性的关键部位,对位于其外口的保守性负电荷侧链氨基酸的功能研究,为我们阐释通道门控作用的分子机制及构建离子通道的工作模型提供了实验基础和依据。
与野生型钠离子通道相比,E375A和E375K突变体的全细胞钠电流密度显著减小至10.72和5.28 pA/pF,分别为野生型的1/3和1/6,然而,real-time PCR和Western blotting检测结果显示,在mRNA和蛋白水平上,E375A、E375K和E375D突变体的表达与野生型相比无显著差异。这些结果说明,E375A和E375K突变体电流密度的减小并非由通道表达量而是由通道电导的改变引起的。
Chiamvimonvat[12]和Zhang[13]等发现,大鼠骨骼肌钠通道Nav1.4的E403C突变会引起通道电导的显著减小,使用巯基修饰剂MTSES使半胱氨酸侧链恢复负电荷后,单通道和全细胞钠电流均恢复至野生型水平,提示E403侧链的负电荷是决定Nav1.4电导的关键因素。
本研究中,我们将人心肌钠离子通道Nav1.5的同源性位点突变为丙氨酸 (E375A),使其侧链负电荷被中和,全细胞钠电流密度显著减小至10.72 pA/pF,为野生型的1/3。通过E375K突变,将E375置换为正电性的赖氨酸,全细胞钠电流密度显著减小为5.28 pA/pF,为野生型的1/6、E375A的1/2。而在E375D突变体中,侧链负电荷恢复,全细胞钠电流密度也相应地恢复至28.40 pA/pF,与野生型相比无显著差异。这一结果也说明,在电压门控型钠离子通道结构域I中,P环外口保守性谷氨酸侧链的负电荷对通道电导的决定作用具有普遍性。
与野生型钠离子通道相比,E375A与E375K突变体的半激活电压均显著左移,斜率因子略有减小,而E375D突变并不能充分消除这种左移现象,这与Nav1.4的E403C突变不影响通道的激活过程不同。推测导致这种差异的原因,可能是由于Nav1.5和Nav1.4在谷氨酸临近位点的氨基酸残基存在电荷差异,前者为正电性的R376,而后者为电中性的N404。
与稳态激活过程不同,在稳态失活过程中,E375A突变体的半失活电压显著右移6.38mV,斜率因子显著增加1.14;E375K的半失活电压显著右移9.92mV,与野生型和E375A相比均有显著差异 (P<0.05),斜率因子显著增加1.16。通过E375D突变恢复375残基侧链的负电荷后,通道的稳态失活过程相应地恢复至野生型水平,半失活电压和斜率因子与野生型无显著差异。说明E375残基侧链的负电荷决定钠离子通道Nav1.5的稳态失活过程。
Na+、K+、Ca2+等电压门控型阳离子通道的结构域共享包含6个跨膜肽段的结构,电压感受器S4均富含正电性的侧链赖氨酸和精氨酸,提示静电相互作用在离子通道的电压依赖性开放与关闭过程中起着根本性的作用。在钠离子通道的激活过程中,随着膜电位的去极化,S4从膜内伸出,由此诱发通道构象的改变而使“激活闸门”开放。失活分为两个步骤:跨膜结构域Ⅲ和Ⅳ位于胞内的连接部分移向内口并堵塞通道导致的快速失活 (fast inactivation),以及通道内部构象变化引起的缓慢失活 (slow inactivation)[4,15~17]。我们推测,在钠离子通道的门控过程中,P环 (结构域I)外口的保守性负电荷谷氨酸侧链,可能通过与S4片段的正电性残基之间的静电相互作用来决定通道的缓慢失活过程。本研究中,E375不同突变体的侧链大小 (长短)、极性、疏水性等也有可能对通道内部的微结构域产生影响,从而导致通道功能的偏移,但具体机制还有待进一步研究。
致谢 美国哥伦比亚大学药理学系Robert S.Kass教授友好提供pcDNA3.1-SCN5A和pcDNA3.1-SCN5B重组质粒,在此表示感谢。
1. George AL Jr.Inherited disorders of voltage-gated sodium channels.J Clin Invest,2005,115(8):1990~1999
2.Ruan Y,Liu N,Priori SG.Sodium channel mutations and arrhythm ias.Nat Rev Cardio l,2009,6(5):337~348
3. Am in AS,Asghari-Roodsari A,Tan HL.Cardiac sodium channelopathies.Pflugers Arch,2010,460(2):223~237
4.Tao X,Lee A,Limapichat W,Dougherty DA,MacKinnon R.A gating charge transfer center in voltage sensors. Science,2010,328(5974):67~73
5. Yu FH, Catterall WA. Overview of the voltage-gated sodium channel fam ily.Genom e Biol,2003,4(3):207
6. Maltsev VA,Kyle JW,Undrovinas A.Late Na+current produced by hum an cardiac Na+channel isoform Nav1.5 is modulated by its beta1 subunit.J Physio l Sci,2009,59(3): 217~225
7.Bosmans F,Martin-Eauclaire MF,Swartz KJ.Deconstructing voltage sensor function and pharmacology in sodium channels.Nature,2008,456(7219):202~208
8.Perez-Garcia MT,Chiam vim onvat N,Marban E,Tomaselli GF.Structure of the sodium channel pore revealed by serial cysteine mutagenesis.Proc Natl Acad Sci USA, 1996,93(1):300~304
9. Feng XH,Chen JX,Liu Y,Ji YH.Electrophysiological characterization of Bm K I,an alpha-like scorpion toxin,on rNav1.5 expressed in HEK293t cells.Toxico l In Vitro,2008, 22(6):1582~1587
10.Noda M,Shim izu S,Tanabe T,Takai T,Kayano T,Ikeda T,Takahashi H,Nakayama H,Kanaoka Y,Minam ino N. Primary structure of Electrophorus electricus sodium channel deduced from cDNA sequence.Nature,1984, 312(5990):121~127
11.Chiam vim onvat N,Perez-Garcia MT,Ranjan R,Marban E, Tomaselli GF. Depth asymmetries of the pore-lining segments of the Na+channel revealed by cysteine mutagenesis.Neuron,1996,16(5):1037~1047
12.Chiam vimonvat N,Perez-Garcia MT,Tomaselli GF,Marban E.Control of ion flux and selectivity by negatively charged residues in the outer m outh of rat sodium channels.J Physio l,1996,491(1):51~59
13.Zhang Z,Xu Y,Dong PH,Sharma D,Chiamvimonvat N. A negatively charged residue in the outer mouth of rat sodium channel determ ines the gating kinetics of the channel. Am J Physio l Ce ll Physio l, 2003, 284(5): C1247~C1254
14.Nguyen TP,Wang DW,Rhodes TH,George AL Jr. Divergent biophysical defects caused by mutant sodium channels in dilated cardiom yopathy with arrhythm ia.Circ Res,2008,102(3):364~371
15.Zhang M,Liu J,Jiang M,Wu DM,Sonawane K,Guy HR, Tseng GN.Interactions between charged residues in the transmembrane segments of the voltage-sensing domain in the hERG channel.J Mem brane Bio l,2005,207(3): 169~181
16.Goldin AL.Mechanism s of sodium channel inactivation. Curr Opin Neurobio l,2003,13(3):284~290
17. Ulbricht W. Sodium channel inactivation: Molecular determ inants and modulation.Physio l Rev,2005,85(4): 1271~1301
