肿瘤抑制蛋白质P53单克隆抗体的制备及其免疫活性分析
2011-01-16武军华魏文清贾培媛赵宇王晨宇刘晶王玉霞
武军华,魏文清,贾培媛,赵宇,王晨宇,刘晶,王玉霞
(1.军事医学科学院毒物药物研究所军事毒理及生化药理研究室,北京100850;2.北京军区总医院,北京100700)
肿瘤抑制蛋白质P53单克隆抗体的制备及其免疫活性分析
武军华1*,魏文清2*,贾培媛1,赵宇1,王晨宇1,刘晶2,王玉霞1
(1.军事医学科学院毒物药物研究所军事毒理及生化药理研究室,北京100850;2.北京军区总医院,北京100700)
目的制备可特异性地识别肿瘤抑制蛋白质P53的单克隆抗体。方法应用重组人野生型P53蛋白为免疫抗原,采用经典的细胞融合技术制备单克隆抗体。亲和层析纯化抗体蛋白;ELISA测定抗体滴度。纯化的抗体作用于含有不同p53基因型的MDA-MB-231〔p53(mutant)〕和〔H1299,p53(null)〕肿瘤细胞系,Western印迹、免疫组化和免疫荧光染色法检测抗体与内源性P53蛋白的结合特异性。结果对筛选到的3株单克隆抗体1P15,2P37和3P40,进行了亲和层析技术纯化。SDS-PAGE结果显示,纯化后的3株抗体纯度均在90%以上;ELISA滴度测定结果显示,3株单抗的滴度均在1∶6000以上。免疫印迹结果表明,3株抗体在p53检测中具有较高的灵敏度,其中3P40的灵敏度最高,可以达到5 ng。Western印迹、免疫组化以及免疫荧光染色结果显示,抗体与细胞内源性P53蛋白的结合特异性,说明3P40可以特异性地结合细胞总蛋白提取物以及细胞中内源性P53蛋白,而在检测不表达P53蛋白的细胞系样品时,没有非特异性结合。结论成功制备3株对P53具有高亲和力的单克隆抗体,其中3P40的抗体滴度和灵敏度最佳。
肿瘤抑制蛋白质P53;单克隆抗体;酶联免疫吸附分析
大量研究表明,肿瘤抑制蛋白质P53参与了包括生长[1]、发育[2]、增殖[3]、衰老[4]和凋亡[5]等众多的生理病理过程。P53蛋白被称为基因卫士,其在维持基因组稳定,修复细胞损伤,诱导细胞凋亡等方面具有重要功能。研究表明,肿瘤的发生与P53蛋白的功能密切相关,半数以上的实体瘤细胞均存在P53蛋白的基因突变或功能丧失[6]。因此,以重建P53蛋白功能为靶标的抗肿瘤生物药物,包括野生型P53蛋白药物、p53基因治疗等在国内外引起了广泛的关注[7]。制备P53单克隆抗体对于量化P53蛋白在肿瘤发生发展中的作用、检测P53蛋白药物在动物体内分布代谢研究都有重要的意义。
本研究以原核表达的P53蛋白为抗原,免疫小鼠,并采用经典的杂交瘤细胞融合技术,筛选抗P53蛋白单克隆抗体;应用酶联免疫吸附法(ELISA)测定和Western印迹分析亲和层析纯化的单克隆抗体与P53蛋白的结合活性及检测灵敏度;通过Western印迹、免疫组化和免疫荧光染色分析抗体与肿瘤细胞P53蛋白的结合特异性,为基于P53蛋白开发的生物类制剂的免疫检测及分析提供技术手段。
1 材料与方法
1.1 动物、试剂和仪器
BALB/c小鼠,由军事医学科学院实验动物中心提供,动物许可证号:SCXK(军)2007-004;原核表达的P53蛋白由本室制备[8]rProtein A-SepharoseTM4 Fast Flow及Protein G-SepharoseTM4 Fast Flow(美国Amersham公司);辣根过氧化酶(horseradish peroxidase,HRP)标记的羊抗小鼠IgG,N-四甲基联苯胺(TMB)(北京中杉金桥生物技术公司);牛血清白蛋白(BSA)(北京元亨圣马生物技术研究所)。硝酸纤维素膜(美国Millipore公司);4,6-二氨基-乙苯基吲哚(DAPI)(美国Sigma公司);增强化学发光(enhanced chemiluminescence,ECL)(Applygen Technologies Inc.),96孔细胞培养板和ELISA板(美国Costar公司),酶标仪(Thermo Scientific VARIOSKAN FLASH(美国Thermo公司),UV-250型分光光度计(日本岛津公司),TG16W高速离心机(长沙平凡仪器厂)。
1.2 P53单克隆抗体的制备和纯化
采用经典的杂交瘤技术,参照贾培媛等[9]方法筛选到3株可稳定分泌抗P53单克隆抗体的杂交瘤细胞:1P15,2P37和3P40。将3株细胞分别注射到BALB/c小鼠腹腔内,收集产生的腹水,参照郎立伟等[10]方法,以rProtein A-SepharoseTM4 Fast Flow纯化1P15,Protein G-SepharoseTM4 Fast Flow纯化2P37和3P40,具体操作如下:将腹水12 000×g,离心5 min,取上清液过滤。处理后的样品与等体积结合缓冲液混合,层析柱4℃条件下反复上样5次。以结合缓冲液洗脱杂蛋白,紫外检测杂蛋白吸收降至基线后继续冲洗约10个床体积,用甘氨酸洗脱液0.1 mol·L-1,pH 2.7洗脱抗体,收集含有抗体的馏分,并迅速用Tris-HCl 1.0 mol·L-1将pH值调至约7.5,置于结合缓冲液中4℃透析。用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析抗体纯度,采用Lowry等[11]方法测定蛋白浓度。
1.3 直接ELISA法测定纯化抗体的滴度
参考贾培媛等[9]的方法,将P53蛋白用抗原包被液(碳酸盐缓冲液50 mmol·L-1,pH 9.6)稀释至终浓度4 μg·ml-1,每孔100 μl包被96孔酶标板,4℃过夜。吸去过量的包被抗原,加入用PBS稀释的5%脱脂奶粉,37℃封闭40 min;将纯化的抗体用含有0.1%吐温-20的PBS(PBST)按1∶400,1∶800,1∶1600,1∶3200,1∶6400,1∶12 800进行稀释,以每孔100 μl加入酶标板中;37℃孵温1 h;用PBST洗去过量一抗,加入1∶1000稀释的HRP标记羊抗小鼠IgG,每孔100 μl,37℃孵温1 h;TMB显色,450 nm测定吸光度值(A450nm),表示抗原抗体反应的强弱。
1.4 Western印迹法测定抗体与P53蛋白结合特异性
参考赵宇等[8]报道的方法,将P53蛋白样品用PBS稀释后进行蛋白SDS-PAGE,将胶浸泡于电转液内(Tris 25 mmol·L-1,甘氨酸190 mmol·L-1,20%甲醇,pH 8.3),转移至硝酸纤维素膜上,加入封闭液,37℃慢摇封闭1 h;加入封闭液(5%脱脂奶粉的TBST)稀释的抗P53单克隆抗体(1∶1000),4℃过夜。洗涤液(TBST:Tris-HCl 50 mmol·L-1,pH 7.5,NaCl 150 mmol·L-1,1%吐温-20)洗涤3次,加入封闭液稀释的山羊抗小鼠IgG(1∶1000),37℃慢摇45 min,洗涤6次,ECL显色。
1.5 免疫组化测定抗体3P40与细胞内P53蛋白结合活性
常规方法培养乳腺癌MDA-MB-231〔属于p53突变株(mutant)〕和非小细胞肺癌细胞H1299〔属于p53缺陷型(null)肿瘤细胞系〕。将2种细胞均以每孔1×105密度接种至6孔板中,培养过夜。吸去培养基后,用4%多聚甲醛固定细胞,4℃固定过夜;固定后的细胞在室温下用95%乙醇透化10 min,加入以2%BSA 1∶500稀释的p53单抗3P40(1 mg·ml-1),4℃孵育过夜;用PBS洗去未结合一抗,按照免疫组化试剂盒的操作说明,加入HRP标记二抗,DAB显色,苏木素进行复染,显微镜下观察拍照;与一抗孵育后的MDA-MB-231细胞加入TRITC标记的羊抗小鼠二抗(2%BSA 1∶200稀释稀释),室温孵育1 h,洗涤,滴加DAPI 1 mg·L-1进行复染,在荧光显微镜下观察,拍照。
2 结果
2.1 p53单克隆抗体的纯化及纯度
将经过细胞融合、克隆筛选得到的能稳定分泌抗p53抗体的2P37,3P40及1P15细胞株注射至小鼠腹腔内,收集产生的腹水采用Protein G-SepharoseTM4 Fast Flow可以对2P37及3P40高度纯化,而应用rProtein A-SepharoseTM4 Fast Flow对1P15具有较高的回收效率。Lowry等方法定量纯化的单克隆抗体和SDSPAGE分析结果显示,2P37,3P40及1P15株单克隆抗体经亲和层析后,纯度均达到了90%以上(图1)。
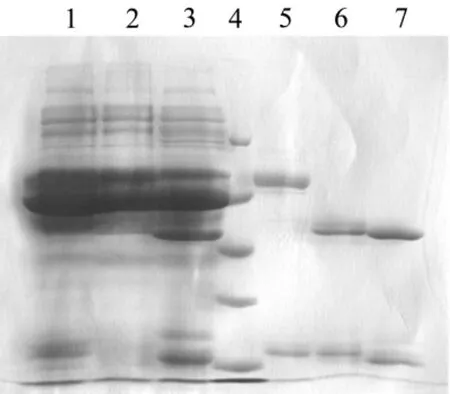
图1 SDS-PAGE分析纯化后的2P37,3P40及1P15单克隆抗体.纯化后的抗体样品用12%SDS-PAGE进行纯度分析.泳道1:1P15腹水;泳道2:2P37腹水;泳道3:3P40腹水;泳道4:蛋白相对分子质量标准;泳道5:纯化1P15;泳道6:纯化2P37;泳道7:纯化3P40.蛋白标准品的相对分子质量分别为97 000,66 000,43 000,31 000以及21 000.Fig.1 Analysis of 2P37,3P40 and 1P15 purified monoclonal antibodies against p53 by SDS-PAGE.
2.2 p53单克隆抗体与原核表达人源P53蛋白的结合活性
图2结果说明2P37,3P40及1P15株抗体均能与人源P53蛋白结合。通过ELISA方法检测2P37,3P40及1P15株抗体滴度并进行比较发现,3P40滴度最高,可达1∶12 000以上。图3结果显示,3株抗体可应用于免疫印迹检测P53蛋白,其中3P40的灵敏度最高,可达5 ng。
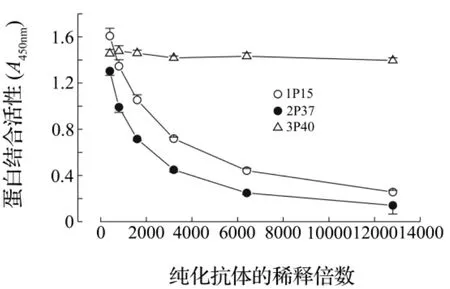
图2 ELISA法测定2P37,3P40及1P15单克隆抗体滴度.利用96孔板,按每孔100 μl,加入P53 4 mg·L-1的抗原包被液.±s,n=4.Fig.2 Titer of 2P37,3P40 and 1P15 purified monoclonal antibodies determined by ELISA.

图3 Western印迹法检测2P37,3P40及1P15单克隆抗体与P53蛋白结合的灵敏度.抗体1P15和2P37:P53蛋白上样量为1000,500,100,50和10 ng(泳道1~5);抗体3P40:P53蛋白上样量为200,100,50,20和5 ng(泳道1~5).3株单抗(1 g·L-1)以含0.1%吐温-20的磷酸缓冲盐溶液稀释,1P15及2P37稀释1500倍,3P40稀释5000倍.Fig.3 Binding sensitivity of 2P37,3P40 and 1P15 monoclonal antibodies to P53 protein by Western blotting.
2.3 单克隆抗体与肿瘤细胞内源性P53蛋白的结合活性

图4 Western印迹检测3P40单克隆抗体与肿瘤细胞中内源性P53蛋白结合的特异性.细胞中蛋白样品上量为30μg.3P40用含5%脱脂奶粉的PBST稀释,稀释比例为1∶1500.M:标志物;泳道1:MDA-MB-231细胞;泳道2:H1299细胞.Fig.4 Binding specificity of 3P40 monoclonal antibody to endogenous P53 protein from tumor cells identified by Western blotting.
图4 Western印迹结果表明,3P40抗体可特异性地识别MDA-MB-231细胞总蛋白中的P53。图5免疫组化及免疫荧光结果显示,结合反应主要定位于细胞核,与之前利用其他商品化的P53抗体检测结果相一致[8]。而H1299细胞属于p53缺陷型,因此,Western印迹及免疫组化染色均没有得到阳性结果,说明3P40的结合作用具有高度特异性。

图5 免疫组织化学(A)和免疫荧光染色技术(B)检测3P40单克隆抗体对肿瘤细胞中内源性P53蛋白的识别作用(×200).3P40以1∶500稀释.A1和A2分别为MDA-MB-231和H1299细胞;B1,B2和B3分别显示P53蛋白,细胞核及P53蛋白与细胞核叠加.箭头示叠加的细胞.Fig.5 Identification of P53 in tumor cells using 3P40 monoclonal antibody by immunohistochemical staining(A)and immunofluorescence(B)(×200).
3 讨论
本研究以原核表达的野生型人源P53蛋白为免疫抗原,采用经典的细胞融合技术制备了3株单克隆抗体,经ELISA和Western印迹鉴定发现,3株抗体均可以特异性地结合P53蛋白,其中抗体3P40具有较高的结合活性和检测灵敏度。应用抗体3P40进行肿瘤细胞实验结果表明,3P40可特异性地鉴别细胞总蛋白中的内源性P53蛋白。不同的免疫染色结果表明,结合作用主要发生在细胞核,如实地反映了内源性P53蛋白的分布,与该蛋白作为转录因子的功能相一致。随着P53蛋白功能研究及P53蛋白作为抗肿瘤药物研究的进一步深入,抗P53蛋白特异性单克隆抗体将提供有效的免疫分析和药物检测手段。
[1]Zheng H,Ying H,Yan H,Kimmelman AC,Hiller DJ,Chen AJ,et al.Pten and p53 converge on c-Myc to control differentiation,self-renewal,and transformation of normal and neoplastic stem cells in glioblastoma[J].Cold Spring Harb Symp Quant Biol,2008,73:427-437.
[2]Nagao M,Campbell K,Burns K,Kuan CY,Trumpp A,Nakafuku M.Coordinated control of self-renewal and differentiation of neural stem cells by Myc and the p19ARF-p53 pathway[J].J Cell Biol,2008,183(7):1243-1257.
[3]Rother K,Kirschner R,Sänger K,Böhlig L,Mössner J,Engeland K.p53 downregulates expression of the G1/S cell cycle phosphatase Cdc25A[J].Oncogene,2007,26(13):1949-1953.
[4]Xue W,Zender L,Miething C,Dickins RA,Hernando E,Krizhanovsky V,et al.Senescence and tumour clearance is triggered by p53 restoration in murine liver carcinomas[J].Nature,2007,445(7128):656-660.
[5]Yu J,Zhang L.The transcriptional targets of p53 in apoptosis control[J].Biochem Biophys Res Commun,2005,331(3):851-858.
[6]Hollstein M,Sidransky D,Vogelstein B,Harris CC.p53 mutations in human cancers[J].Science,1991,253(5015):49-53.
[7]Wiman KG.Strategies for therapeutic targeting of the p53 pathway in cancer[J].Cell Death Differ,2006,13(6):921-926.
[8]Yu Z,Wu J,Wu S,Jia P,Tong Y,Wu X,et al.A recombinant cell-permeable p53 fusion protein is selectively stabilized under hypoxia and inhibits tumor cell growth[J].Cancer Lett,2009,279(1):101-107.
[9]Jia P,Wang Y,Yu M,Wu J,Yang R,Zhao Y,et al.An organophosphorus hapten used in the preparation of monoclonal antibody and as an active immunization vaccine in the detoxication of soman poisoning[J].Toxicol Lett,2009,187(1):45-51.
[10]郎立伟,王玉霞,王晨宇,赵宇,贾培媛,傅风华.双抗体夹心酶联免疫法检测不同样品中的蓖麻毒素[J].国际药学研究杂志,2009,36(1):12-16.
[11]Sapan CV,Lundblad RL,Price NC.Colorimetric protein assay techniques[J].Biotechnol Appl Biochem,1999,29(Pt 2):99-108.
Preparation and binding activity of monoclonal antibody against P53 protein
WU Jun-hua1*,WEI Wen-qing2*,JIA Pei-yuan1,ZHAO Yu1,WANG Chen-yu1,LIU Jing2,WANG Yu-xia1
(1.Division of Military Toxicology and Biochemical Pharmacology,Institute of Pharmacology and Toxicology,
Academy of Military Medical Sciences,Beijing100850,China;2.General Hospital of Beijing Military Area Command,Beijing100700,China)
OBJECTIVETo prepare monoclonal antibodies specially recognized P53 protein.METHODSRecombinant human wild-type P53 protein expressed in E.coli.BL21 was used as antigen.Monoclonal antibodies were prepared and identified via the classic protocol of monoclonal antibody preparation.Identified monoclonal antibodies were purified by affinity chromatography.Antibody titer was determined by enzyme linked immunosorbent assay(ELISA).The specific binding activity of antibody was detected by Wes ten blotting and immunohistochemistry.RESULTSThree antibodies,1P15,2P37 and 3P40,against P53 protein were prepared and purified by affinity chromatography.The purity of antibodies was higher than 90%shown by SDS-PAGE.The titers of antibodies were more than 1∶6000 determined by ELISA.All antibodies could recognize P53 protein by Western blotting,in which 3P40 had the sensitivity of 5 ng for P53.Two tumor cell lines with different p53 gene type(MDA-MB-231,p53 mutant;H1299,p53 null)were used to determine the binding activity of antibody 3P40 by Western blotting and immunohistochemistry.The result indicated that endogenous P53 protein in tumor cells could be identified by 3P40.CONCLUSIONThree monoclonal antibodies against P53 are prepared.Antibody 3P40 is the most sensitive and specific one to P53.
P53 protein;monoclonal antibody;enzyme-linked immunosorbent assay
The project supported by National Natural Science Foundation of China(30973562);National Mega-project of Science Research of China(2009ZX09103-614);and National Basic Research Program of China(2010CB933904)
WANG Yu-xia,E-mail:wangyuxia1962@hotmail.com,Tel:(010)66931645
Q785
A
1000-3002(2011)05-0479-04
10.3867/j.issn.1000-3002.2011.05.012
国家自然科学基金(30973562);国家重大新药创制专项(2009ZX09103-614);国家重点基础研究发展计划资助项目(2010CB933904)
武军华(1971-),女,实验师,主要从事免疫药理学研究;魏文清(1967-),女,副主任技师,主要从事免疫药理学研究。
王玉霞,E-mail:wangyuxia1962@hotmail.com,Tel:(010)66931645
*共同第一作者。
*Joint first authors.
(来稿日期:2010-09-16接受日期:2011-01-11)
(本文编辑:乔虹)
