扶正和胃合剂配合GEMOX方案治疗中晚期胰腺癌
2011-01-16尤建良姚新新
尤建良, 姚新新
胰腺癌是我国常见恶性肿瘤之一,近年来发病率呈上升趋势,远期生存率低。如何提高中晚期胰腺癌的治疗效果、延长生存期,特别是提高生存质量,一直备受医学界的关注。中西医结合治疗为胰腺癌的治疗开拓了更为广阔的思路。笔者从2005年1月—2008年12月应用中药扶正和胃合剂配合GEMOX方案治疗52例中晚期胰腺癌患者,取得了较好的疗效,现报告如下。
1 资料与方法
1.1 一般资料
全组52例,男27例,女25例。年龄23~72岁,平均(52.06±10.18)岁。曾经根治性手术切除5例;剖腹探查肿瘤未能切除,仅作内引流术15例;因腹腔已广泛转移或粘连而仅行剖腹探查术28例;介入治疗4例。52均经CT或MRI检查、肿瘤标记物测定及病理学检查证实为胰腺癌。按国际抗癌联盟(UICC) 2002年TNM分期标准[1]均为Ⅲ、Ⅳ期胰腺癌患者,其中Ⅲ期24例、Ⅳ期28例。所有病例的Karnofsky评分均≤60分。
1.2 治疗方法
采用中药扶正和胃合剂联合GEMOX方案[1]化疗。扶正和胃合剂为无锡市中医院制剂室生产[苏药制字Z04002112],成分含有潞党参、猪苓、炒白术、谷麦芽、茯苓神、薏苡仁、制半夏、陈皮、炙枇杷叶,炙甘草等。每次30 mL口服,每天3次,28天为1周期,共服药6个周期以上。GEMOX方案具体为:吉西他滨(GEM)(江苏豪森药业股份有限公司) 1 000 mg/m2,静脉滴注30 min,第1、8天;奥沙利铂(OXA)(江苏恒瑞医药股份有限公司) 100 mg/m2,静脉滴注2 h,第1天。28天为1周期,2个周期后评价疗效。
1.3 观察指标
1.3.1临床主要症状(S)观察患者临床主要症状,并按轻重分为4级:无症状(0)、轻度(+)、中度(++)、重度(+++)分级情况参照卫生部2002版《中药新药临床研究指导原则》(见表1),每“+”记为2分。对治疗前后总积分进行比较,根据疗效指数判断疗效,S1(显效),积分减少≥70%;S2(有效),积分减少≥30%;S3(无效),积分减少<30%。计算公式(尼莫地平法):[(治疗前积分-治疗后积分)÷治疗前积分]×100%。

表1 胰腺癌症状分度表
1.3.2瘤体大小(T)根据治疗前后CT片测量瘤体大小并进行比较。疗效标准分为完全缓解(CR):所有可见病灶完全消失,至少维持4周以上;部分缓解(PR):肿瘤病灶的最大横径及最大垂直径的乘积缩小50%以上,并维持4周以上,无新病灶出现或任何病灶增大;稳定(SD):肿瘤病灶的两径乘积缩小<50%,或增大<25%,无新病灶出现;进展(PD):一个或多个病灶的两径乘积增大>25%,或出现新病灶。CR+PR为有效(T1), SD为稳定(T2),PD为进展(T3)。
1.3.3生存质量(K)采用Karnofsky评分标准对治疗前后患者的生存质量进行判定。K1(显效):治疗后比治疗前提高≥20分;K2(有效):治疗后比治疗前提高≥10分;K3(无效):治疗后比治疗前无提高。
1.3.4体重(G)治疗前后均测体重2次(连续2天)取平均值。G1(显效):治疗后较治疗前体重增加≥1.5 kg;G2(有效):治疗后较治疗前体重增加≥1.0 kg;G3(无效):治疗后较治疗前体重无增加或增加不足1 kg。所有患者均无胸腔或腹腔积液等。
1.3.5肿瘤放免(I)治疗前后均行CEA检测,并进行比较。I1(显效):治疗后较治疗前降低≥50%或降到正常范围内,I2(有效):治疗后较治疗前降低≥25%,I3(无效):治疗后较治疗前降低<25%甚或升高。
1.3.6整体疗效[2]明显收益:S1,T1-T2,K、G、I中一项或一项以上为1,或三项均为2;收益:(1)S1,T2,K、G、I中两项≤2;(2)S2,T2,K、G、I≤2;不收益:未达上述指标。
1.3.7生存率对比(寿命表法)
研究各项指标的变化,最后进行治疗前后对比统计学处理。记量资料以均数±标准差表示,治疗前后均数用配对t检验。所有数据采用SPSS13.0软件包处理。P<0.05为有统计学意义。
2 结果
治疗后临床主要症状、瘤体大小、Karnofsky分、生存质量、体重、CEA检查等变化以及疗效评判等详见表2~9。

表2 治疗后临床主要症状(S)变化 [n(%)]
* 总有效率为88.46%
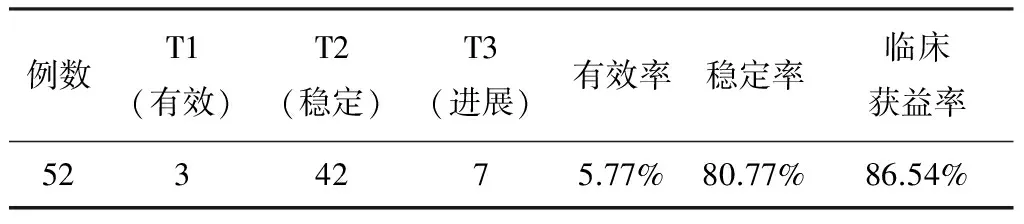
表3 治疗后瘤体(T)变化[n(%)]
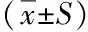
表3 治疗前后Karnofsky分对比
* 治疗前后比较,P<0.05

表5 治疗后生存质量(K)变化 [n(%)]
* 总有效率为82.69%。

表6 治疗后体重(G)变化 [n(%)]
* 总有效率为86.54%。

表7 治疗后肿瘤放免(I)变化 [n(%)]
* 总有效率为76.92%。

表8 治疗后整体疗效[n(%)]
* 总收益率为75.00%。

表9 3年生存率对比[n(%)]
* 中位生存期为15.8个月。
3 讨论
中医的古典医籍中并无胰腺癌的确切称谓,但有与其症状相类似的记述,如 “伏梁”、“积聚”、“腹痛”、“黄疸”等。近年来,胰腺癌的发病率在世界范围内呈逐渐上升的趋势,发病率位居恶性肿瘤第10位,死亡率为第4位,5年生存率仅为5%[3]。在中国,据北京、上海的统计数据,胰腺癌在全身恶性肿瘤中发病率已由第20位上升到第8位,死亡率居恶性肿瘤第5位[4]。目前手术仍是胰腺癌首选治疗手段,然而由于受胰腺解剖学和胰腺生物学特征等因素的影响,胰腺癌早期即易侵犯周围组织器官和发生转移,加之早期缺乏明显的症状、体征,早期诊断比较困难,确诊时多属中晚期,手术切除的机会只有5%~25%,大多数患者失去了手术根治的机会。即使病变局限,行根治性切除,仍会复发和转移,5年生存率不足25%。晚期胰腺癌患者1年生存率不足10%,中位生存时间仅3个月[5]。化疗是胰腺癌内科治疗的重要手段,但是由于肿瘤细胞的耐药性,使化疗的有效率较低,吉西他滨具有中度抗胰腺癌作用,可以明显改善晚期胰腺癌患者的疾病相关症状和生活质量,于1996年被美国食品与药品监督管理局(FDA)批准取代5-FU作为抗胰腺癌一线药物,并被视作临床研究的“金标准”。大量临床实验均证实吉西他滨在改善胰腺癌患者临床获益反应(CBR)方面显著优于5-FU,对5-FU治疗失败者仍有27%的有效率。2003年Louvet等[6]报道了吉西他滨单药与GEMOX方案(吉西他滨+奥沙利铂)比较的Ⅲ期随机临床试验,共有36个中心的326例胰腺癌患者参加,研究表明,尽管吉西他滨是当前治疗胰腺癌的标准方案,但在此基础上增加奥沙利铂而组成的GEMOX联合方案,无论在肿瘤缓解率、无进展生存期、临床受益率等方面与单用吉西他滨相比均有进一步提高,并且耐受性良好,甚至最终可能会使生存期有所改善,因而评价GEMOX似乎是改善晚期胰腺癌患者预后的最有活性和最具潜力的方案。近10年来,中医药治疗胰腺癌显示有其独到之处,对于控制肿瘤发展、延长生存期、缓解症状、改善生活质量有一定疗效。中西医结合治疗为胰腺癌的治疗开拓了更为广阔的思路[7]。
中医古典文献中有关胰腺癌病证病因病机的论述归纳在“伏梁”、“癥瘕”、“黄疸”、“腹痛”等病名中。气机不畅,脾湿困郁是本病首要病因,正气虚弱、脏腑失调是发病的内在条件,而中焦脾胃功能失调是病机的关键。
著名中医肿瘤专家赵景芳集40多年治癌经验,创立赵氏微调平衡法,扶正和胃合剂为微调平衡法之基本方,该方抓住胰腺癌内在失衡的“关节点”在于中焦,只有微微调控后天脾胃之枢纽,以后天促先天,调气以调瘀,力避滋腻伤中、攻伐伤正、行血转移之弊。充分扩增患者自身平衡调控之潜能,通过调动机体自身的免疫、康复功能,来达到控制胰腺癌病情发展、延长生存期、提高生活质量,最终达到抑制癌转移,甚至治愈肿瘤的目的。
中药扶正和胃合剂中,党参益气固本,增强机体免疫力;猪苓育阴利湿,激发潜能;茯苓神宁养神明,以主调控;薏苡仁、谷芽、麦芽养胃醒中;炒白术、茯苓、制半夏健脾化湿;陈皮理气、枇杷叶降气畅中;炙甘草调和众药。诸药合用扶助正气,调和肠胃,微调平衡,激发潜能,调控岩邪。能激活患者自身康复系统,使其处在最佳运行状态,自主兴奋地投入调控状态,并可减轻GEMOX方案化疗的副反应。
我们前期的抑瘤实验[8]证实:扶正和胃合剂26.6 mL/kg/d 剂量时,具有抑制小鼠S-180肉瘤生长的作用,抑瘤率达29%,与对照组比较有显著性差异。实验还显示扶正和胃合剂能显著提高细胞因子IL-2、IL-4、IFN-r的水平,与对照组比较有显著性差异。而IFN-r等细胞因子通过激发机体免疫功能及明显地抑制肿瘤血管内皮因子而具有可靠的抑制癌转移作用。本研究显示:中药扶正和胃合剂配合GEMOX方案治疗中晚期胰腺癌患者,可以改善临床症状(总有效率为88.46%),稳定肿瘤(临床获益率为86.54%),提高生存质量(总有效率为82.69%),增加体重(总有效率为86.54%),降低肿瘤放免(总有效率为76.92%),获得较高的整体疗效(总收益率为75.00%),1年生存率为55.77%,中位生存期为15.8个月。中药扶正和胃合剂无肝、肾损害,无骨髓抑制等毒副作用,可增强免疫功能,改善临床症状,提高生活质量,降低化疗药物的毒性反应,维护患者的造血功能及免疫功能,从而使化疗可顺利进行,达到较为满意的治疗效果。
参考文献:
[1]孙燕,石远凯. 临床肿瘤内科手册[M].北京:人民卫生出版社,2007,537.
[2]林洪生,李树奇,朴炳奎.中医治疗晚期肺癌的疗效评价方法[J].中国肿瘤,2000,9(8):354-355.
[3]Jemal A,Siegel R,Ward E,et al. Cancer statistics,2007[J].CA cancer J Clin,2007,57(1):43-66.
[4]姜青峰,薛涣洲,申权,等.老年进展期胰腺癌98例临床研究[J].实用老年医学,2008,22(1):57-59.
[5]Rubin P,William JP.Clinical Oncology[M].北京:人民卫生出版社,2002.768.
[6]Walker L,Schalch H,King DM,et al. Phase II trial of weekly paclitaxel in patients with advanced melanoma[J].Melanoma Res,2005,15(5): 453-459.
[7]沈晔华,刘鲁明.中晚期胰腺癌的化学药物治疗[J].世界临床药物,2004,25 (5):279-282.
[8]尤建良,徐明.中药WD-3合剂对细胞因子影响的实验研究[J] .中国医学理论与实践,2002,20(6):661.
