对镉高抗性及吸附性的鲁氏酵母突变株的选育*
2011-01-12李春生徐莹姜维刘文磊汪东风
李春生,徐莹,姜维,刘文磊,汪东风
(中国海洋大学食品科学与工程学院,山东青岛,266003)
水体中的重金属污染主要源于采矿、冶炼、电镀、印染等行业的工业废水及生化污水的随意排放[1-2]。这些重金属污染物可以通过食物链富集并传递,从而对人类饮食安全和身体健康构成了严重威胁。目前,常用的水体重金属污染物处理方法主要有絮凝沉淀法、吸附法、离子交换法及生物法等。其中,微生物吸附法因具有细胞生长繁殖快、吸附能力强且比表面积大等特点,已成为当前一个重要的研究方向[3-4]。微生物吸附主要是通过选择优良的微生物作为吸附剂,直接或与固定化等其他技术结合脱除重金属。目前,国内外学者在这方面已做了大量工作,如通过筛选或构建吸附能力强的微生物菌种,改善培养基组成,以及细胞经酸、碱、有机溶剂处理或化学修饰、通过基因工程改造菌株等手段来提高微生物吸附能力[5-8]。但筛选出在污染环境中既能大量生长又有较高重金属吸附能力的微生物是相当艰难的工作。通过诱导育种构建在逆境中既能良好地生长又能具备重金属处理性能,并对环境无害的工程菌是实现该工艺实际应用的关键因素之一[9]。
酵母菌用于处理水体重金属污染的研究工作较多,但多数都集中在采用酿酒酵母这种模式菌来进行的。鲁氏酵母是酱油等酿造生产过程中的常用菌株,其耐盐性比酿酒酵母的更强。本课题组前期研究发现,耐盐鲁氏酵母对 Cd2+有一定的吸附能力[10-11]。但是,为了提高其吸附效率和实际应用,其重金属镉脱除能力还需进一步提高。本研究旨在以工业用鲁氏酵母为出发菌株,通过紫外诱变,选育出对Cd2+具有更高抗性的菌株;同时对所得菌株进行镉生物吸附能力分析,以期选育出对Cd2+具有更高吸附能力的菌株,为采用微生物法脱除食品及水环境的重金属镉的研究提供有用菌株。
1 材料与方法
1.1 出发菌株
亲株采用鲁氏酵母菌(Zygosaccharomyces rouxii)CICC1379,购自中国工业微生物菌种保藏中心。
1.2 培养基与Cd2+溶液
麦芽汁固体斜面培养基:6~7°Bé的麦芽汁琼脂培养基。
YEPD固体平板培养基:蛋白胨20 g,酵母膏10 g,葡萄糖 20 g,琼脂 20 g,自来水 1 000 mL,pH 6.0。不加入琼脂时即为YEPD液体培养基。
Cd2+溶液:称取适量的CdCl2·2.5H2O(AR,中国医药集团上海化学试剂公司),用超纯水溶解,配成Cd2+含量为1 000 mg/L的溶液,使用时用超纯水稀释到所需浓度。
1.3 Z.rouxii CICC1379镉抗性水平检测
采用最低抑菌浓度(MIC)法,参照文献[12]。
1.4 紫外线诱变
1.4.1 诱变致死曲线的绘制
参照文献[13]。
1.4.2 紫外线诱变及筛选
(5)缸筒表面外观质量 激光淬火后,缸筒淬火区无明显的氧化脱碳现象,表面粗糙度值较低,经磁粉无损检测后表面无微小裂纹现象。并经专业的检测手段检测缸筒淬火区没有变形缺陷产生。
取对数期Z.rouxiiCICC1379酵母菌悬液移入带有磁力搅拌棒的无菌平板中,选择合适的紫外线(15 W)照射时间(致死率为70% ~80%)进行紫外诱变。将所得的菌悬液加入到YEPD液体培养基,28℃、180 r/min,培养24h。所得的菌体离心(4 000 r/min,10 min)用0.85%无菌生理盐水洗涤2次并收集菌体,再将所得菌体用0.85%无菌生理盐水梯度稀释至浓度约为103个/mL后涂布到含Cd2+的YEPD固体平板培养基,28℃恒温培养,挑出优势菌落。将初筛选出的菌株分别进行镉抗性水平检测和生物量的测定,并与亲株进行比较。根据以上2个指标筛选出比较理想的菌株。
1.4.3 遗传稳定性检测
测定复筛选出的菌株的MIC,与培养前菌株的MIC比较后即得到10个世代的稳定性。20世代的稳定性测定,则以24h的培养液作为种子液,以此类推,直至50个世代。
1.5 酵母冻干粉吸附实验
1.5.1 酵母冻干粉吸附实验
分别称取0.1 gZ.rouxiiCICC1379和突变株的冻干粉(制备方法参见文献[10]),投到装有20 mL不同镉浓度梯度的三角瓶中,置于转速为100 r/min的摇床中振荡吸附30 min。迅速取出并经4 000 r/min离心10 min,取上清液,适当稀释后测定Cd2+浓度。以上清液中Cd2+浓度降低的百分比为Cd2+脱除率(Q),即:

式中:c0,吸附前溶液中Cd2+浓度,mg/L;ce,吸附后溶液中Cd2+浓度,mg/L。
1.5.2 Cd2+测定方法
1.6 统计分析
每个实验处理重复3次,实验所获得的值用平均值±标准偏差(M±SD)的形式表示。
2 结果与讨论
2.1 最低抑菌浓度(MIC)的确定及 Z.rouxii CICC1379镉抗性水平分析
培养时间与Z.rouxiiCICC1379的MIC之间的关系如图1所示。结果表明,同样的处理但是经过不同的培养时间,MIC值明显地不同。这是因为在低Cd2+浓度条件下,Cd2+只有明显的抑菌作用,而无明显的致死作用,经过适应性调整后仍能够生长。
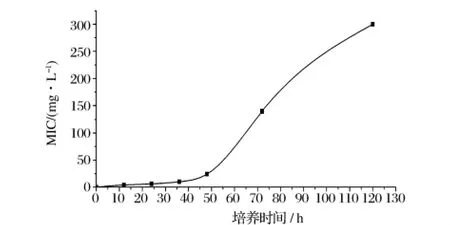
图1 培养时间对Z.rouxii CICC1379 MIC的影响
培养时间为24h时,对Z.rouxiiCICC1379的MIC进行测试,结果如表1所示,Z.rouxiiCICC1379的MIC约为6 mg/L,即Z.rouxiiCICC1379的镉抗性约为6 mg/L。

表1 Z.rouxii CICC1379在含镉YEPD固体平板培养基培养24h的菌落数
2.2 Z.rouxii CICC1379的生长曲线
供诱变处理的酵母菌一般要求处于对数生长期,此时群体生长状况比较同步,易变异,重复性较好,故选用对数期的细胞进行处理。以培养时间(t)为横坐标,以每毫升酵母菌个数(N)为纵坐标,绘制出Z.rouxiiCICC1379的生长曲线如图2所示。由图2可知,对数生长时期为4~12 h,为了保证处理时具有一定的细胞浓度,以增加可变异的细胞总数,故选择已培养了10 h的菌液进行诱变处理。
2.3 紫外线诱变及镉抗性菌株的筛选
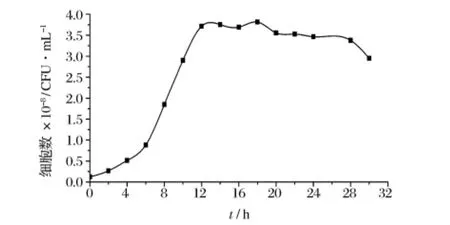
图2 Z.rouxii CICC1379生长曲线
2.3.1 紫外诱变致死时间的确定
紫外诱变处理剂量的选择是一个比较复杂的问题,一般正突变较多出现在偏低剂量中,而负突变则较多出现于偏高剂量中。因此,目前已倾向于低剂量处理细胞,致死率一般控制在70% ~80%。Z.rouxiiCICC1379紫外诱变致死曲线如图3所示,紫外线处理时间为30s时,致死率为78.85%,故选用紫外线处理时间30s来进行诱变处理。
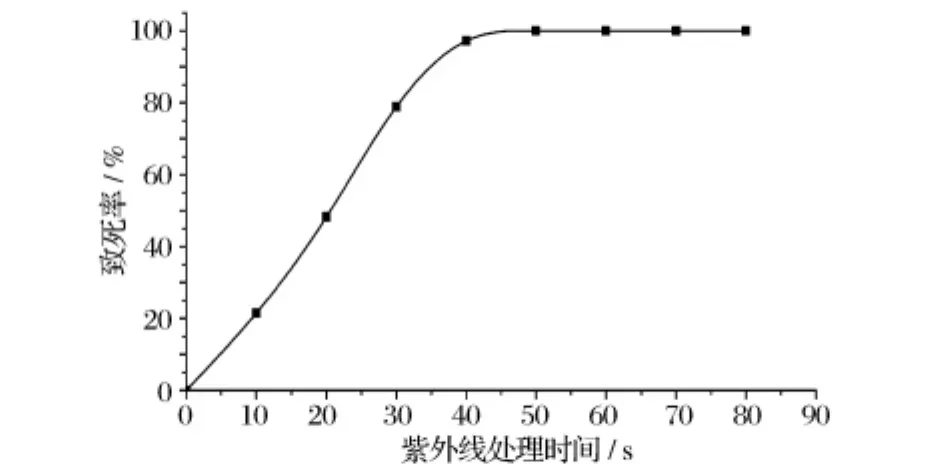
图3 紫外诱变致死曲线
2.3.2 抗性突变株的筛选
为了从紫外诱变所得的菌悬液筛选出较理想的菌株,经过初筛后,挑选出 3株较优突变体,即Cd102,Cd103,Cd104,再分别以突变株的生物量及镉抗性两个指标进行复筛。初筛获得的各突变株与Z.rouxii CICC1379的生物量如表2所示。从表2可以看出各突变株的生物量与亲株的生物量相比没有太大的差异,表明突变过程对这些菌株的生长繁殖影响较小,各突变株生长繁殖正常。
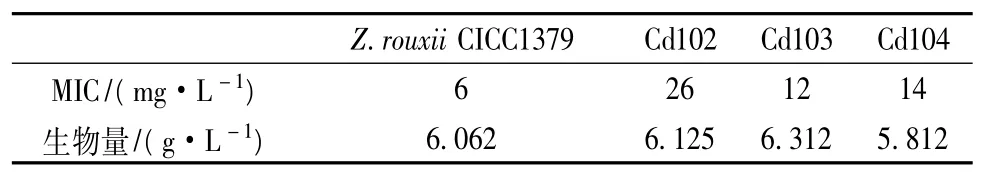
表2 Z.rouxii CICC1379和诱变菌株生物量及镉抗性比较
采用MIC法测定各突变株的镉抗性水平,由表2可知,突变株Cd102,Cd103,Cd104的镉抗性较亲株分别提高了3.3倍、1.0倍和1.3倍。
由以上两个指标可以看出,与出发菌株相比,突变株Cd102镉抗性提高较明显,且生长繁殖正常,因此继续对此菌进行遗传稳定性检测及镉吸附能力研究。
2.3.3 突变株Cd102的遗传稳定性
采用MIC法对Z.rouxiiCICC1379及突变株Cd102进行50世代的遗传稳定性检测,结果见图4。
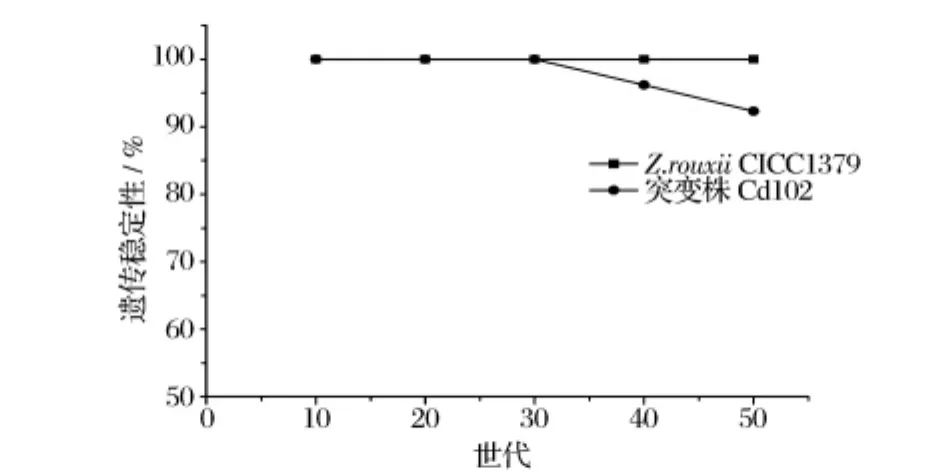
图4 Z.rouxii CICC1379及其突变株Cd102的遗传稳定性
突变株Cd102前30代 Cd2+抗性均保持在100%,第40代遗传稳定性开始下降,但下降幅度不大,在第50代其遗传稳定性仍保持在92.3%。由图4可以看出鲁氏酵母突变株Cd102对Cd2+抗性,具有较高的遗传稳定性,在非选择性培养基中培养50世代,其稳定性保持在90%以上。
2.4 突变株的镉生物吸附能力分析
Z.rouxiiCICC1379与突变株Cd102对不同初始Cd2+浓度溶液的吸附实验结果如图5所示,突变株Cd102的吸附能力明显地较原始菌株有所提高,即对于该突变株而言,镉抗性增强其吸附能力也增强。随着初始Cd2+浓度的增加,Cd2+脱除率呈现下降趋势。这是因为高初始浓度增加了克服水相与固相之间重金属传质阻力所需的驱动力,导致了Cd2+与吸附剂的高碰撞几率,这大大增加了溶液中单位生物量的重金属吸附数量,直至达到饱和,但是由于Cd2+的初始浓度过高,镉脱除率却下降[14]。
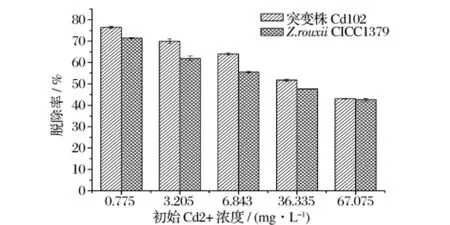
图5 Z.rouxii CICC1379与突变株Cd102冻干粉的Cd2+吸附性能比较
微生物突变体的重金属抗性与吸附性存在两种关系:一种为重金属的抗性增加但其吸附能力下降,这主要是由于排斥机制导致其抗性增加[14-15]。另一种为重金属的抗性与吸附性同时增加,其机理主要有两方面:一方面是由于微生物的表面吸附作用,经过诱导后,微生物的细胞壁、细胞膜成分改变,在细胞表面产生能与重金属形成晶体的大分子物质,吸附重金属时,这些大分子物质与其螯合,从而增加其吸附能力;另一方面主要是指能进行新陈代谢的活细胞而言,由于微生物细胞内的累积作用,诱变调动了微生物体内的抗性基因,在细胞内形成能大量容纳重金属离子的生物大分子,如金属硫蛋白、操纵子、金属运输酶和透性酶等,这些物质与重金属离子结合,形成稳定的重金属离子-生物大分子的结合态,从而降低了重金属对菌体内其他生物物质的破坏,增强了突变株对镉的抗性和吸附能力[9]。本研究获得的突变株Cd102的重金属的抗性与吸附性同时增加。MIC法测定其Cd2+抗性为26 mg/L,明显高于亲株(6 mg/L),相应的其Cd2+吸附性能提高较为明显。初始Cd2+浓 度 分 别 为 0.775、3.205、6.843、36.335、67.075 mg/L时,突变株Cd102的Cd2+脱除率分别较亲株提高了 7.01%、12.85%、15.3%、8.65%、1.07%。可见,突变株Cd102在中低浓度Cd2+脱除方面较亲株表现了更强的吸附能力,而在初始Cd2+浓度为67.075 mg/L时,突变株Cd102的Cd2+脱除率与亲株相近,表明Cd102在脱除高浓度Cd2+方面,其吸附能力并没有太大提高。由于本研究采用的是酵母冻干粉吸附实验,酵母菌处于休眠体状态,其吸附机制主要是由于细胞的表面吸附作用,由此可以推测,紫外诱变更多的是导致Cd102细胞表面结构上的变化,使其对Cd2+的选择性吸附能力增强,而总的吸附位点并没有太多增加,表现为其对高Cd2+下脱除率没有太大的变化,其机理有待进一步研究。
3 结论
筛选出遗传稳定的突变株Cd102,其镉抗性为26 mg/L,较Z.rouxiiCICC1379提高了3.3倍。突变株Cd102的Cd2+吸附性也相应的提高,突变株Cd102在中低浓度Cd2+脱除方面较Z.rouxiiCICC1379表现了更强的吸附能力。
[1] Celik A,Demirbas A.Removal of heavy metal ions from aqueous solutions via adsorption onto modified lignin from pulping wastes[J].Energy Source,2005,27(12):1 167-1 177.
[2] Demirbas A.Heavy metal adsorption onto agro-based waste materials:A review[J].Journal of Hazardous Materials,
2008,157(2-3):220-229.
[3] Wang J L,Han Y J,Qian Y.Progress on biosorption of heavy metal ions[J].Microbiology,2000,15(2):26 -29.
[4] 李中华,尹华,叶锦韶,等.固定化菌体吸附矿山废水中重金属的研究[J].环境科学学报,2007,27(8):1 245-1 250.
[5] Ahluwalia S S,Goyal D.Microbial and plant derived biomass for removal of heavy metals from wastewater[J].Bioresource Technology,2007,98(12):2 243-2 257.
[6] GhorbanI F,Younesi H,Ghasempouri S M,et al.Application of response surface methodology for optimization of cadmium biosorption in an aqueous solution bySaccharomyces cerevisiae[J].Chemical Engineering Journal,2008,145(2):267-275.
[7] Yu J,Tong M,Sun X,et al.Enhanced and selective adsorption of Pb2+and Cu2+by EDTAD-modified biomass of baker's yeast[J].Bioresource Technology,2008,99(7):2 588-2 593.
[8] 徐雪芹,李小明,杨麒,等.丝瓜瓤固定简青霉吸附废水中Pb2+和Cu2+的机理[J].环境科学学报,2008,28(1):95-100.
[9] 尹华,卢显妍,彭辉,等.复合诱变原生质选育重金属去除菌[J].环境科学,2005,26(4):147-151.
[10] 徐莹,刘婍,李春生,等.鲁氏酵母脱除水溶液中Cd2+的研究[J].食品与发酵工业,2009,35(5):54-56.
[11] 徐莹,刘婍,李春生,等.氯化钠胁迫培养对鲁氏酵母镉吸附能力的影响[J].食品与发酵工业,2009,35(8):11-14.
[12] Zafar S,Aqil F,Ahmad L.Metal tolerance and biosorption potential of filamentous fungi isolated from metal contaminated agricultural soil[J].Bioresource Technology,2007,98(13):2 557-2 561.
[13] 王乃富.重金属抗性菌株的选育及其生物学功能研究[D].泰安:山东农业大学,2002.
[14] Yin H,He B Y,Peng H,et al.Improvement of chromium biosorption by UV–HNO2cooperative mutagenesis in Candida utilis[J].Water Research,2008,42(14):3 981-3 989.
[15] Ansari M I,Malik A.Biosorption of nickel and cadmium by metal resistant bacterial isolates from agricultural soil irrigated with industrial wastewater[J].Bioresource Technology,2007,98(16):3 149-3 153.
