异型流感病毒感染小鼠肺细胞因子水平变化
2011-01-12郭志华牛术孟
郭志华,牛术孟,金 红
(中国医科大学基础医学院病原生物学教研室,辽宁沈阳 110001)
流行性感冒(简称流感)病毒是一种能引起急性呼吸道疾病的病毒,流感传播快、潜伏期短、发病率高,引起人和动物高的发病率和病死率[1],尤其是2009年发生的甲型H1N1流感再次引起全球关注[2-3]。目前,流感尚无特效治疗方法,安全有效的疫苗是降低流感发病率和病死率,减少大规模流行的最重要的方法之一[4]。所有目前使用疫苗的共同特点之一是直接诱导针对病毒膜蛋白血凝素(hemagglutinin,HA)产生中和抗体,达到预防同型流感病毒的目的。虽然这些疫苗的应用对人群起到保护作用,但是由于HA经常发生抗原变异,此类疫苗不能防御变异株感染。到目前为止尚无有效的抗异型流感病毒感染疫苗。有研究人员已开始考虑通过提高适应性细胞免疫应答的方法,达到预防异型流感病毒感染的目的,但首先应弄清其防御机制,对此目前尚无统一结论。本研究首先用一种流感病毒疫苗免疫小鼠,然后分别感染同型、异型流感病毒,研究异型病毒感染前后小鼠肺组织内IFN-γ、 IL-2、 IL-4、 IL-10细胞因子水平变化,研究机体对异型流感病毒感染交叉免疫保护作用的机制,为制备能够抵御不同型别流感病毒感染的疫苗奠定基础。
1 材料与方法
1.1 材料
1.1.1 动物 6~8周龄SPF级BALB/c小鼠,雌性,由中国医科大学实验动物部提供。
1.1.2 病毒 A/FM/47(H1N1)流感病毒株,由中国医科大学病原生物学实验室提供,用前进行病毒滴定。
1.1.3 主要试剂 水合氯醛、PBS(中国医科大学病原生物学教研室提供);H5N1流感病毒疫苗(哈尔滨维科生物技术开发公司),重组鼠 IL-2(Pepro-Tech);细胞因子Elisa试剂盒(武汉博士德生物工程有限公司,凯基生物科技发展有限公司)。
1.1.4 主要仪器 CO2培养箱(香港力康发展有限公司,型号HF90);酶标仪(Inte rMed NJ-2100)。
1.2 方法
1.2.1 感染病毒滴度测定 将H1N1病毒储存液用PBS溶液进行10倍等比稀释(10-1~10-10),把各稀释液分别接种于9日龄鸡胚尿囊腔中,每个稀释度需要4枚鸡胚,37℃5%CO2培养箱培养2~3 d,每天检查鸡胚生长情况,24 h内死亡的鸡胚,认为是非特异死亡应弃去。根据Reed-Muench方法,计算鸡胚半数感染量(50%egg infectious dose,E ID50),E ID50为104.8。
1.2.2 动物分组 取上述小鼠50只,随机分为实验组和对照组,实验1组(异型免疫组):用H5N1免疫,H1N1感染;实验2组(异型免疫加强组):用H5N1免疫, IL-2加强免疫,H1N1感染;对照1组(同型免疫组):用H1N1免疫,H1N1感染;对照2组(病毒感染对照组):用PBS缓冲液免疫,H1N1感染;对照3组(空白对照组):正常饲养,不做任何处置。各组标记后分别称重,正常饮水食物喂养,每日观察记录小鼠的活动状态及临床表现、称量体重。
1.2.3 免疫动物 将各组小鼠用水合氯醛轻度麻醉,选用H5N1、H1N1疫苗或PBS液按上述分组免疫动物,疫苗接种按说明书进行,每只小鼠鼻腔接种50μL。首次免疫3周后加强免疫1次,方法剂量同上,加强免疫的同时根据文献[5]及试剂说明书,实验2组小鼠分别经腹腔注射活性为5×107U/mg重组鼠 IL-2 1 mL,浓度为160 U/mL。
1.2.4 感染动物 加强免疫2周后,各组小鼠用水合氯醛轻度麻醉,按上述分组每只小鼠经鼻腔感染E ID50为104.8的H1N1流感病毒100μL,正常饮食饮水饲养,感染病毒后每天准确称量小鼠体重,观察饮食饮水及精神状态。
1.2.5 存活率和肺指数 小鼠感染流感病毒后观察其存活情况,记录每组死亡数,计算各组存活率(感染后各组小鼠存活数目/感染前各组小鼠总数×100%);无菌解剖取小鼠全肺称重,并计算肺指数(肺脏湿重/小鼠体重×100%)。
1.2.6 细胞因子测定 分别于感染前、感染7 d后无菌解剖取小鼠全肺(每组3只),按常规方法制作肺组织匀浆,4℃离心机,3 000 r/min,离心10 min,取上清分装,做好标记,-20℃保存待测。EL ISA试剂盒测定感染前后细胞因子 IL-2、IL-4、 IL-10、IFN-γ含量,具体操作按试剂盒说明书进行,酶标仪测OD450值,保存结果,计算细胞因子含量(pg/mL)。
1.2.7 统计学方法处理 采用SPSS 17.0软件进行统计分析,各组数据以均数±标准差(¯χ±S)表示,用t检验进行两两比较,以P<0.05为差异具有统计学意义。
2 结果与分析
2.1 一般情况及肺指数
如图1、图2所示,实验1组(异型免疫组)感染H1N1病毒后存活率为30%~50%,体重较感染前下降,至第7天降低17.34%;实验2组(异型免疫加强组)感染病毒6 d后存活率为85.71%,至第7天体重下降15.16%;2组小鼠体温降低,食欲欠佳,精神状态差;对照1组(同型免疫组)全部存活,体重基本无变化;对照2组(病毒感染对照组)小鼠感染病毒1 d后全部死亡。肺指数值越大,表示肺重量增加,肺炎性病变程度严重;实验1组(异型免疫组)肺指数最大为3.29%,实验2组(异型免疫加强组)次之为2.53%,其余各组均差异不大(图3)。结果表明,经同型疫苗免疫的小鼠能抵抗同型流感病毒的感染,产生完全保护作用;对异型流感病毒感染可产生一定的交叉免疫保护作用,免疫增强剂可能起到增强疫苗效果的作用。
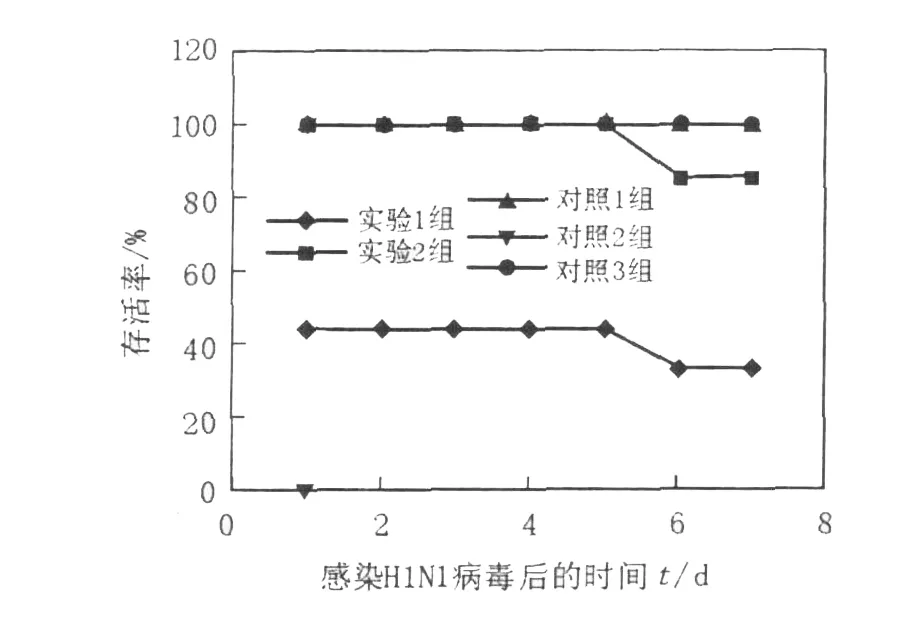
图1 小鼠感染流感病毒后的存活率Fig.1 Survival rates of the mice after influenza virus challenge

图2 小鼠感染流感病毒后的体重变化Fig.2 Bodyweight of the mice after influenza virus challenge
2.2 Elisa试剂盒检测细胞因子
细胞因子IFN-γ、 IL-2、 IL-4、 IL-10含量测定结果如下(图4~7,表1、表2)。实验1组(异型免疫组)和实验2组(异型免疫加强组)感染病毒后细胞因子IFN-γ、 IL-10含量明显高于感染前(P<0.05);感染病毒后实验1组(异型免疫组)IFN-γ、 IL-10含量高于对照1组(同型免疫组)(P<0.05),差异有统计学意义。
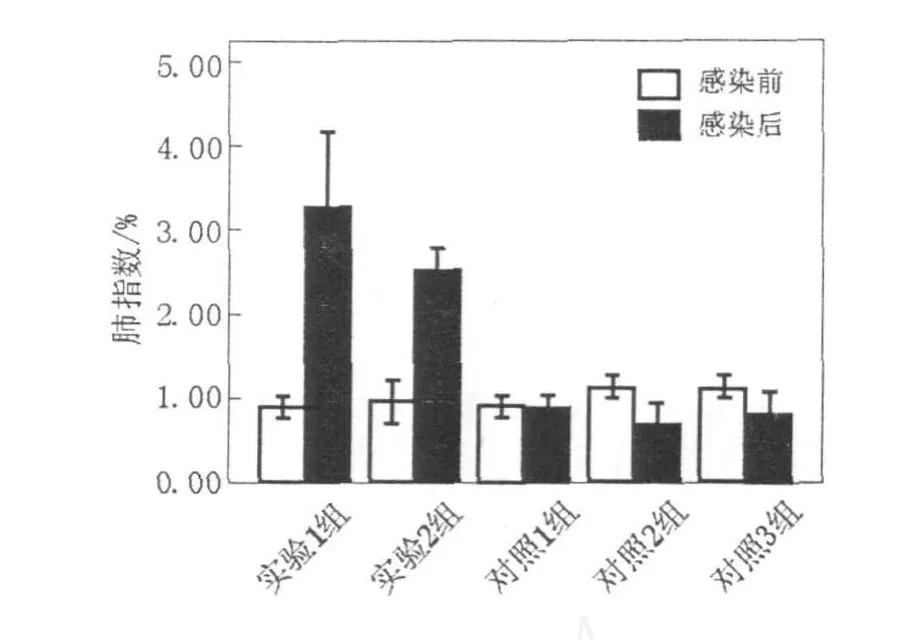
图3 小鼠感染流感病毒前后肺指数Fig.3 The lung index of the mice before and after influenza virus challenge

图4 EL ISA测定细胞因子IFN-γ的浓度值(pg/mL)Fig.4 The concentration of cytokines IFN-γassayed by EL ISA(pg/mL)
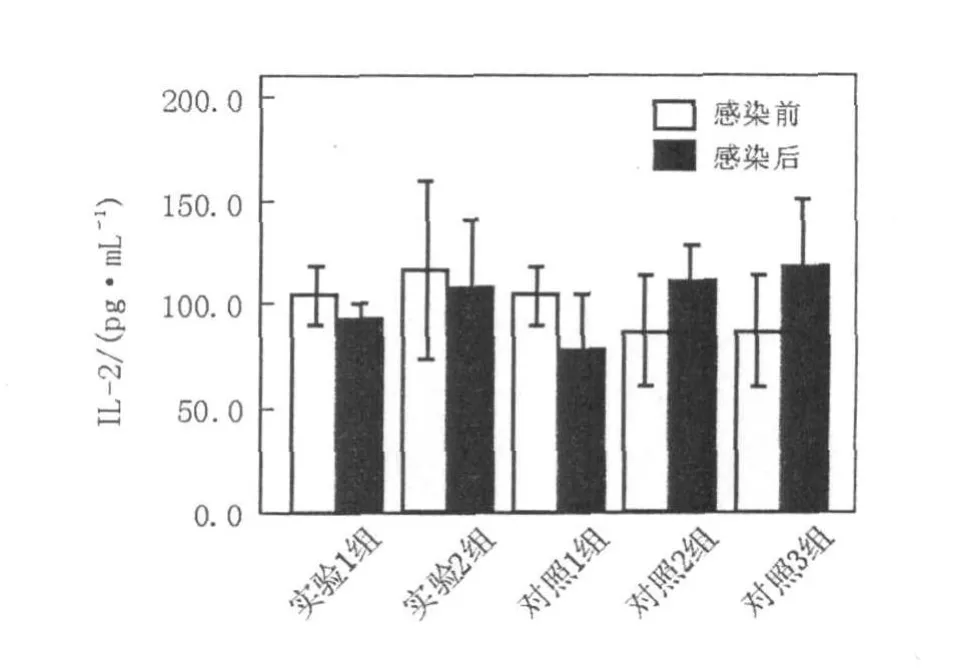
图5 EL ISA测定细胞因子I L-2的浓度值(pg/mL)Fig.5 The concentration of cytokines IL-2 assayed by EL ISA(pg/mL)
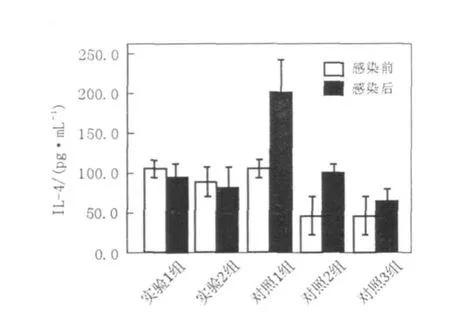
图6 EL ISA测定细胞因子 IL-4的浓度值(pg/mL)Fig.6 The concentration of cytokines IL-4 assayed by EL ISA(pg/mL)
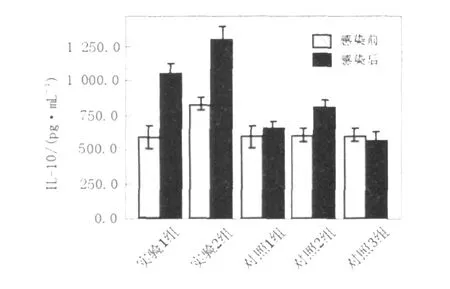
图7 EL ISA测定细胞因子 IL-10的浓度值(pg/mL)Fig.7 The concentration of cytokines IL-10 assayed by EL ISA(pg/mL)
3 讨 论
流感病毒特异性抗体,往往由流感病毒表面蛋白HA抗原刺激产生,特异性强,不能中和异型流感病毒;通过提高细胞免疫的方法,达到预防异型流感病毒感染的目的,已开始受到研究者广泛关注。目前认为抗流感病毒细胞免疫应答反应,是以流感病毒共有蛋白NP为主要抗原[6]。Boon等[7]认为细胞毒性T细胞(Cytotoxic T lymphocyte,CTL)反应在抗异型流感病毒感染中起重要作用。而Nguyen等[8]认为记忆性B淋巴细胞与流感病毒异型间交叉保护免疫反应密切相关。Droebner等[9]则认为CD4+淋巴细胞介导了这种交叉免疫作用。亦有学者[10]通过一些手段提高宿主抵抗异型流感病毒的能力。但目前有限的报道尚无统一结论。研究适应性细胞免疫应答反应在抗异型流感病毒感染方面的主要机制,是开发以细胞免疫机制为基础的抵抗异型流感病毒感染疫苗的前提,此类疫苗可以为机体提供交叉免疫保护。
感染流感病毒后,可刺激机体产生多种细胞因子,小鼠CD4+辅助性T淋巴细胞(helper T cell,Th细胞)可分为Th1和Th2型细胞。Th1细胞主要分泌IFN-γ、 IL-2等细胞因子,这些细胞因子多介导细胞免疫;Th2细胞主要分泌 IL-4、 IL-10等细胞因子,这些细胞因子则介导体液免疫。
本研究首先用流感病毒疫苗免疫小鼠,然后分别感染同型、异型流感病毒,从感染病毒后小鼠的一般情况及肺指数看,实验1组(异型免疫组)小鼠用H5N1疫苗免疫,H1N1病毒感染6 d后存活率为33.33%,第7天体重下降17.34%,肺指数为3.29%,细胞因子IFN-γ、 IL-10含量感染病毒后明显高于感染前(P<0.05),差异有统计学意义。实验2组(异型免疫加强组)小鼠用H5N1疫苗免疫,同时使用免疫增强剂 IL-2后感染H1N1病毒6 d后存活率为85.71%,至第7天体重下降15.16%,肺指数为2.53%,细胞因子IFN-γ、I
L-10含量感染病毒后明显高于感染前(P<0.05),差异有统计学意义。对照1组(同型免疫组)小鼠用H1N1疫苗免疫,H1N1病毒感染后全部存活。结果表明,如果小鼠感染与疫苗同一型别的流感病毒,则可得到完全保护;而如果感染与疫苗不同型流感病毒,感染小鼠部分生存,说明异型流感病毒间存在部分交叉免疫。另一结论为,应用免疫增强剂的应用,可以提高这种交叉免疫作用。免疫增强剂 IL-2是通过怎样的机制对小鼠起到交叉保护作用,须进一步研究确定。关于各种细胞因子的检测结果,尤为突出的是异型免疫组和异型免疫加强组病毒感染后细胞因子IFN-γ含量明显高于感染前,说明此细胞因子可能在流感病毒异型间交叉保护免疫反应中起重要作用。在小鼠感染模型中发现,CD4+和CD8+T细胞在控制流感病毒感染中的作用至关重要[11]。IFN-γ属于Th1类细胞因子,主要参与细胞免疫反应。记忆性CD8+T细胞以表达IFN-γ为主[12],Seo等[13]证实记忆性CD8+T细胞是高致病性流感病毒交叉免疫保护作用的关键因素,而这种交叉免疫保护作用与肺组织中表达IFN-γ的记忆性CD8+T细胞的含量有关。在异型流感病毒感染后IFN-γ水平升高的确切机制有待深入研究。本研究还发现感染异型病毒后小鼠肺组织中IL-10含量亦升高, IL-10虽然属于Th2类细胞因子,但可介导炎性反应,研究表明[14], IL-10作为一种重要的抗炎性细胞因子,能广泛抑制促炎介质生成,防止促炎反应失控。
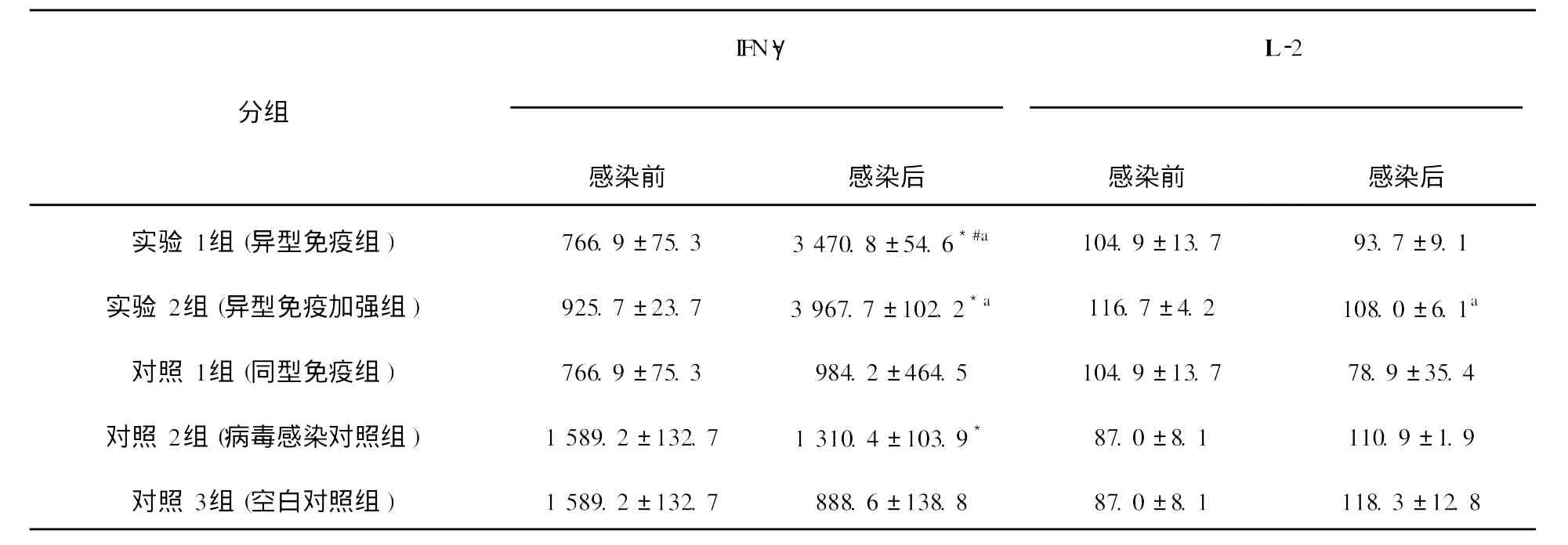
表1 EL ISA测定细胞因子IFN-γ、I L-2的浓度值(¯χ±S,pg/mL)Table 1 The concentration of cytokines IFN-γand IL-2 assayed by EL ISA(mean±s,pg/mL)
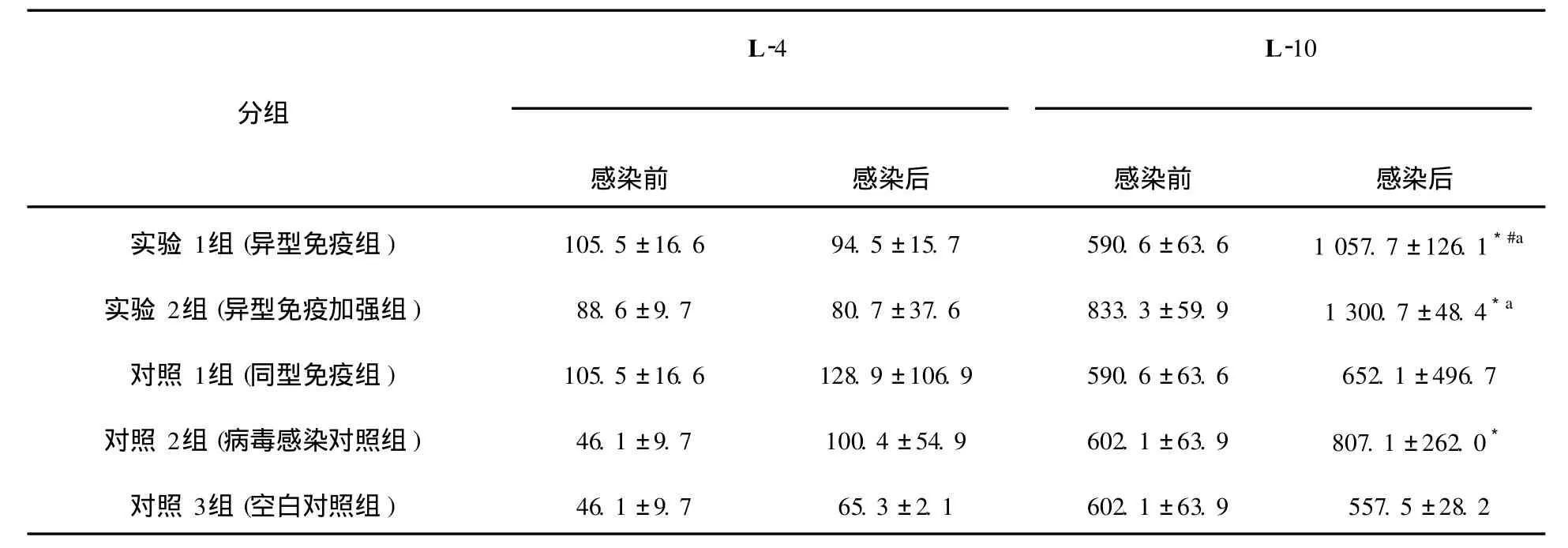
表2 EL ISA测定细胞因子I L-4、I L-10的浓度值(¯χ±S,pg/mL)Table 2 The concentration of cytokines IL-4 and I L-10 assayed by EL ISA(mean±s,pg/mL)
[1] Hsieh YC,Wu TZ,Liu DP,et al.Influenza pandemics:past,present and future[J].J Formos Med Assoc,2006,105(1):1-6.
[2] FlahaultA,Vergu E,Boelle PY.Potential for a global dynamic of influenzaA(H1N1)[J].BMC InfectDis,2009,9(1):129.
[3] Sorianov,Gonzalez-Lahoz J.The challenge of the new H1N1 influenza A[J].Med Clin(Barc),2009,133(18):708-709.
[4] De JongMD,Tran TR,Tmong HK,et a1.Oseltamivir resistance during treatment of influenza A(H1N1)infection[J].N EllgI J Med,2005,353(25):2667-2672.
[5] 姚春艳,姜丽娜,等.腹腔注射 IL-2对小鼠单核吞噬细胞吞噬功能的影响[J].山西医科大学学报,2007,38(3):202-203.
[6] Tamura SI,Tanimoto T,Kurata T.Mechanisms of broad crossprotection provided by influenza virus infection and their application to vaccines[J].InfectDis,2005,58:195-207.
[7] Boon AC,de Mutsert G,van Baarle D,et al.Recognition of hemo-and heterosubtypic variants of influenza A viruses by human CD8+T lymphocytes[J]. Immunol,2004,172(4):2453-2460.
[8] Nguyen HH,Ginkel FW,Vu HL,et al.Heterosubtypic immunity to influenza A virus infection requires B cells but not CD8+cytotoxic T lymphocytes[J].J Infect Dis,2001,183(3):368-376.
[9] Droebner K,Haasbach E,Fuchs C,et al.Antibodies and CD4+-cells mediate cross-protection against H5N1 influenza virus infection in mice after vaccination with a low pathogenic H5N2 strain[J].Vaccine,2008,26(52):6965-6974.
[10] Ichinohe T,AinaiA,Nakamura T,et al.Induction of cross-protective immunity against influenza A virus H5N1 by an intranasal vaccine with extracts of mushroom mycelia[J].Med Virol,2010,82(1):128-137.
[11] Epstein SL,Lo CY,Misplon JA,et al.Mechanis m of protective immunity against influenza virus infection in mice without antibodies[J].I mmunol,1998,160(1):322-327.
[12] Lowin B,HahneM,Mattmann C,et al.Cytolytic T-cell cytotoxicity ismediated through perforin and Fas lytic pathways[J].Nature,1994,370:650-652.
[13] Seo SH,PeirisM,Webster RG.Protective cross-reactive cellular immunitytolethalA/Goose/Guangdong/1/96-like H5N1influenza virus is correlated with the proportion of pulmonary CD8+T cells expressing gamma interferon[J].JV I,2002,76(10):4886-4890.
[14] SeitzMLP,Dewald B,Towbln H,et al. IL-10 differentially regulates cytokine inhibitor and chemokine release from bloodmononuclear cells and fibroblasts[J].EJI,1995,25(4):1129-1132.
