1株罗汉杉内生放线菌的鉴定、活性分析及抗生素生物合成基因的筛查
2011-01-12郭泽经冯治翔吴华动何艳叶仁元褚以文田永强
郭泽经,冯治翔,吴华动,何艳,叶仁元,褚以文,田永强*
(1.中国医药集团四川抗菌素工业研究所,四川成都610052;2.四川大学化学工程学院,四川成都610065)
植物内生放线菌是指在生活史的一定阶段或全部阶段,生活于健康植物的各种组织或器官内部的放线菌[1-2]。近年来,已知化合物重复发现的概率越来越高[3],而且致病菌对现有药物的抗药性不断增强,促使人们必须寻找更为有效的、新的抗生素。植物内生放线菌是一类相对未开发的微生物资源,受到越来越多研究者的关注。大量的研究表明,植物内生放线菌能产生一系列有生物活性的次级代谢产物,如抗生素、抗肿瘤和抗感染药物、植物生长促进剂和酶[4]。Ezra等[5]从蓬莱蕉植物中分出内生放线菌Streptomyces sp.MSU-2110,能产生一种多肽类抗生素Coronamycins;Igarashi等[6]从蕨类植物分离出1株吸水链霉菌Streptomyces hygroscopicus TP-A0451,能产生较强的抗癌抗生素Pterocidin。Yan LL等[7]从红树林植物中分离出1株链霉菌Streptomyces albidoflavus,能产生抗真菌的大环内酯类抗霉素Antimycin A18。天然活性化合物的筛选,包括分离纯化和结构解析通常要投入大量时间及资金,往往伴随着巨大的风险。现代分子生物学的飞速发展,已出现许多新的检测活性物质的方法[8]。从微生物基因组的角度出发,筛查抗生素生物合成酶基因,可以极大的减少候选菌株的筛选量;而且具有活性的抗生素合成酶基因的候选菌株,其产物结构类型可以作大致推测,便于进一步分离解析。如一些常见的化合物及对应的基因:KS-AT基因对应PKS-I化合物,actⅠORF1-actⅠORF2,KSα-KSβ基因对应PKS-Ⅱ化合物,3,5-AHBA合酶基因对应安莎类抗生素,P450单加氧酶基因oxyB对应糖肽类抗生素[9-11]。本实验对1株分离自药用植物罗汉杉的内生放线菌LCB-0297进行鉴定,通过其形态特征、培养特征、生理生化活性及抗生素生物合成基因筛查的研究,初步考察此株内生放线菌的形态特征、生理生化特性及药用价值,为进一步的开发利用提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 菌种内生放线菌LCB-0297由本实验室菌种库分离并保存。
1.1.2 测试菌株、细胞株抗菌活性测试菌株:大肠埃希菌(Escherichia coli)、肺炎克雷伯菌(Klebsiella pneumoniae)、铜绿假单孢菌(Pseudomonas aeruginosa)、金黄色葡萄球菌(Staphylococcus aureus)、表皮葡萄球菌(Staphylococcus epidermidis)、枯草芽胞杆菌(Bacillus subtilis)、烟曲霉(Aspergillus fumigatus)、白色念珠菌(Candida albicans)、黑曲霉(Aspergillus niger),由四川抗菌素工业研究所(SIIA)抗菌素菌种中心提供。抗癌抗糖尿病活性测试细胞株:人肝癌细胞株HepG2由成都地奥集团药物筛选中心提供。
1.1.3 培养基及主要试剂纯化及鉴定培养基:燕麦琼脂(ISP3)、高氏一号(G1)、燕麦琼脂(ISP2);发酵培养基:葡萄糖10 g,燕麦粉20 g,蛋白胨10 g,酵母粉2 g,CaCO33 g,水1 000 mL;抗菌测试培养基:LB、PDA;PCR试剂购于北京天根生化科技有限公司,PCR回收试剂盒、合成引物购于上海生工生物工程技术服务有限公司,序列测定于英俊生物科技有限公司。
1.2 方法
1.2.1 菌丝形态观察电镜样品采用埋片法制备[12],将菌株于28℃恒温培养10~14 d,取出玻片送分析测试中心拍扫描电镜。
1.2.2 菌落培养特征将LCB-0297菌株接种于燕麦片ISP3培养基、LB培养基、蔗糖察氏培养基、TSB培养基、无机盐-淀粉琼脂培养基、酵母膏-麦芽汁培养基、葡萄糖酵母琼脂培养基、PDA培养基、G1培养基及基本培养基上,28℃恒温培养,在2、4、7和14 d观察并记录气生菌丝,基内菌丝的生长情况及色素的有无和颜色等。
1.2.3 生理生化特性生理生化实验:对菌株的生长温度、pH值、NaCl浓度、酯酶分解、淀粉水解、明胶液化、牛奶凝固及冻化、纤维素分解、硝酸盐还原、MR实验、色氨酸分解、H2S产生等生理生化实验进行了考察,参照文献[12]进行。
1.2.4 16S rRNA基因的PCR扩增及测序PCR扩增16S rRNA基因序列,选用通用引物PA8:5'-CCGTCGACGAGCTCAGAGTTTGATCCTGGCTCAG-3',PB1:5'-CCCGGGTACCAAGCTTAAGGAGGTGATCCAGCCGCA-3'。PCR扩增25 μL反应体系:2.5 μL 10×Taq酶缓冲液,2.5 μL 25 mmol/L Mg2+,2.5 μL 10 μmol/L引物,0.75 μL 10 mmol/L dNTP,20 ng DNA模板,0.25μL 2.5 U/μL Taq酶,14 μL ddH2O。PCR反应按下述程序进行:94℃预变性5 min,94℃变性30 s,55℃复性45 s,72℃延伸1 min,35个循环,72℃延伸5 min。利用上海生工生物工程公司SanPrep DNA胶回收试剂盒对扩增产物进行回收,送样、测序。
1.2.5 系统发育分析将菌株的16S rRNA基因序列在NCBI上Blast比对,再用Eztaxon数据库对序列进行在线分析[13],把相近的模式菌的16S rRNA基因序列放在一起做Clustal W(Bioedit)序列比对,最后利用MEGA4进行系统发育分析,构建Neighbor-Joining(N-J tree)系统发育树[14]。测得序列提交GenBank注册。
1.2.6 发酵培养及产物抽提活化菌种,制备种子培养液(28℃、180 r/min振荡培养48 h)。按10%接种量将种子培养液接种到50 mL体系的发酵培养基摇瓶中,28℃,200 r/min摇床培养7 d。25 mL乙酸乙酯震荡抽提发酵液30 min,4 000 r/min离心10 min。分层后移取上层抽提液,使用旋转蒸发仪浓缩,转移至2 mL EP管中,最后冷冻干燥至干品,称量并记录干品净重。
1.2.7 发酵产物的抗菌活性测试抗菌测试采用滤纸片法。发酵产物浓缩样品用DMSO溶解,配制成100 mg/mL使用液,取适量加蒸馏水稀释至100 μg/mL测试液,滤纸片上滴加量为10 μL。测量并记录抑菌圈直径Φ,Φ≥10 mm,则认为抑菌活性极强。
1.2.8 细胞毒及抗糖尿病活性测试细胞毒活性测试采用SRB法[15]。HepG2细胞接种于96孔板,培养过夜,加入样品(T),同时做不加样品对照(C)和加药前对照(T0)。根据生长率判断细胞毒活性强度。
抗糖尿病测试:常规方法构建稳定转染pPPRE-Luc(PPAR反应元件萤火虫荧光素酶报告基因质粒)的HepG2细胞,将稳转细胞常规培养于37℃,5%CO2,含100 U/mL链霉素和青霉素的低糖DMEM中。1.5×104个/孔接种于96孔板后培养过夜,换用含待测样品的低糖DMEM培养基,同时设立空白对照(未转染的细胞)和阴性对照(转染的细胞)不加样品。继续培养24 h后检测荧光素酶活性。根据检测到的化学发光强度L值计算激动率,激动率(%)=((L样品-L空白)/(L阴性-L空白)-1)×100%。初筛时每个样品单个浓度设双复孔,重复2次,激动率大于50%的样品测定EC50值,测定时每个样品梯度稀释6个浓度,每个浓度设双复孔。根据激动率,应用Xlfit软件中的4 Parameter Logistic Model计算EC50。
1.2.9 抗生素生物合成途径关键酶基因的筛查
根据文献[9-11]对菌株LCB-0297进行5类抗生素合成关键酶基因的PCR扩增筛查,其中PKS-Ⅰ、NRPS引物为K1F/M6R、A3F/A7R;PKS-Ⅱ、3,5-AHBA合酶基因(rifK)、糖肽类抗生素合成相关基因(oxyB)引物为ARO-PKS-F/ARO-PKS-R、ANSA-F/ANSA-R、Foxy/Roxy。所用引物及其扩增片段见表1。

表1 PCR筛查所用引物及其匹配生物合成基因Table 1 Primers and relevant biosynthesis genes for PCR screening
2 结果与分析
2.1 形态特征
菌株LCB-0297在ISP3培养基上形成具高度分支的基内菌丝和气生菌丝,菌丝无横隔,不断裂。菌落表面呈皱褶状,颜色呈烬灰色;基内菌丝呈深黄色,产生粉褐色可溶性色素。孢子丝呈螺旋状,孢子丝成熟后形成的孢子链呈串珠状,孢子椭球形,孢子表面多刺,孢子大小0.74~0.85 μm×1.11~1.26 μm(图1)。

图1 LCB-0297在ISP3培养基上12 d的扫描电镜照片Fig.1 SEM photograph of strain LCB-0297 on ISP3 medium for 12 days
2.2 培养特征
菌株LCB-0297在基本培养基上不长,在蔗糖察氏琼脂培养基上生长较差,ISP3、LB、TSB培养基上生长中等,在其他培养基上生长良好,并在培养基(LB、蔗糖察氏除外)上均有色素产生。在10种培养基上气生菌丝、基内菌丝及可溶性色素颜色变化较大,见表2。

表2 LCB-0297在不同培养基上的特征Table 2 Characteristics of LCB-0297 on different medium
2.3 碳氮源利用及生理生化特征
菌株LCB-0297为革兰阳性菌,可以在10~40℃、pH 5~12条件下生长,能耐受60 g/L NaCl,该菌能利用葡糖糖、D-阿拉伯糖、D-果糖、D-甘露醇、肌醇、鼠李糖、甘油、D-木糖,不能利用山梨醇、山梨糖作为唯一碳源;能较好地利用L-缬氨酸、L-谷氨酸、L-酪氨酸,微利用L-赖氨酸,不利用L-色氨酸、尿素、甘氨酸、组氨酸。菌株能水解淀粉,可使明胶液化,使牛奶凝固但不冻化,不能水解Tween 80、纤维素;能使甲基红变红,产生硫化氢,无法还原硝酸盐,不产生色氨酸酶。碳氮源利用及生理生化特征见表3。
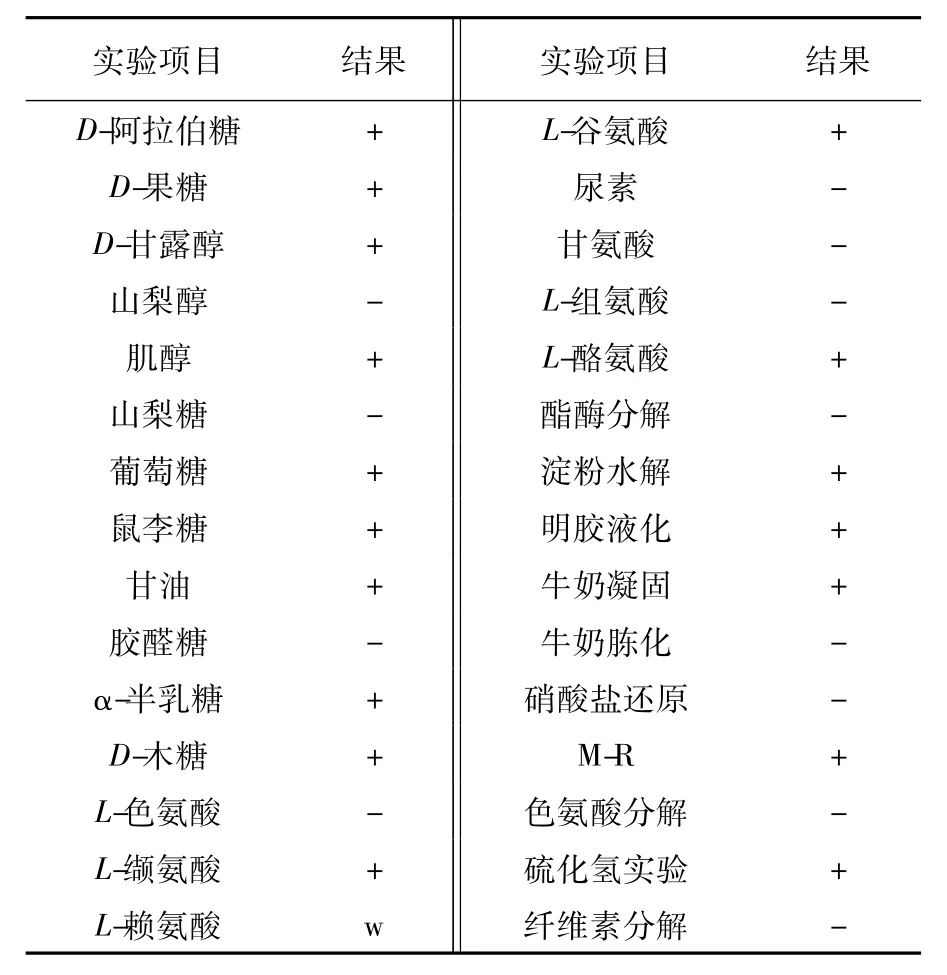
表3 菌株LCB-0297的生理生化特征Table 3 Physiological and biochemical characters of strain LCB-0297
2.4 16SrDNA基因的序列分析及构建系统发育N-J树
以菌株总DNA为模板,进行目的片段扩增,回收、测序。测序结果(1 430 bp 16S rDNA基因)提交至NCBI GenBank,获得登录号:JF922881。将菌株16S rDNA基因与相近模式菌比对,构建进化树。结果显示,菌株与Streptomyces lanatus NBRC 12787T(AB184845)、Streptomyces africanus CPJVR-HT(AY208912)较为接近,相似度分别为98.531%、97.762%;但在进化树上单独呈1枝,为链霉菌的疑似新种,确定为Streptomyce sp.,有待于与模式菌做进一步的对比实验确定。系统进化树见图2。
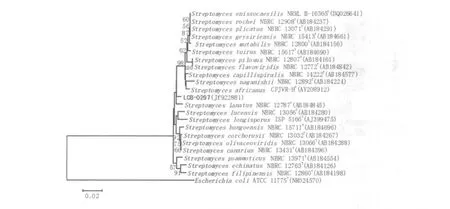
图2 基于16S rRNA基因序列构建的NJ系统发育树Fig.2 Phylogenetic neighbour-joining tree based on the 16S rRNA gene sequences of strain LCB-0297 and related Streptomyces species
2.5 抗菌活性及细胞毒活性
对分离菌株的发酵代谢产物进行抗菌、细胞毒及抗糖尿病活性检测的实验结果见表4。

表4 菌株LCB-0297的抑菌及抗肿瘤活性Table 4 Antimicrobial and anticancer activity of strain LCB-0297
由表4结果可看出:该菌株对肺炎克雷伯菌及巨大芽胞杆菌具有极强的抑菌活性,抑菌圈直径均超过10 mm,对铜绿假单孢菌、金黄色葡萄球菌、表皮葡萄球菌也有较强的抑菌活性。对烟曲霉没有观察到抑菌圈。该菌株亦对人肝癌细胞株HepG2表现出极强的细胞毒活性,没有表现出抗糖尿病活性。
2.6 生物合成酶基因的筛查
PCR筛选结果见表5。该菌株含Ⅰ型聚酮合成酶(PKS-Ⅰ),非核糖体多肽合成酶(NRPS),Ⅱ型聚酮合成酶(PKS-Ⅱ)的基因,安莎类抗生素关键酶3,5-AHBA合成酶基因rifK,糖肽类抗生素合成关键酶P450单加氧酶基因oxyB未检测到。

表5 抗生素生物合成酶基因的PCR筛查Table 5 PCR screening of antibiotics biosynthesis genes of the isolates
3 结论
根据菌株LCB-0297形态观察,培养特征,生理生化特征分析表现出典型的链霉菌特征,16S rRNA基因序列分析结果,确定放线菌LCB-0297为Streptomyces sp.。在16S rRNA基因进化树上单独呈1枝,再根据生理生化特征不完全同于其他种,有可能是1株链霉菌新种,需进一步与模式菌株对比验证。
抗菌抗癌等活性实验显示,菌株LCB-0297具有极强的抑革兰阴性菌及阳性菌,抗癌细胞作用也较强,但对真菌没有任何作用,也无抗糖尿病活性。可以分离纯化其活性化合物,进一步开发研究。抗生素生物合成基因的PCR筛查显示,该菌株具有PKS-Ⅰ、NRPS、PKS-Ⅱ的合成酶基因,具有合成多种抗生素的潜能,由于基因沉默等多种原因,产抗生素的种类及多少有待进一步研究。
罗汉杉,又名罗汉松、土杉,属红豆杉纲,罗汉松科,药用植物,根皮能活血止痛,杀虫,具假种皮的种子能益气补中,治心脾气痛。根据植物内生菌可产生与宿主植物相似的化合物[4],从药用植物中更有可能发现产抗生素等活性物质的化合物,加上其毒性较低,化合物较新颖,展示了药用植物内生放线菌的巨大潜能。菌株LCB-0297分离自药用植物罗汉杉,并显示出较强的抗细菌及抗癌活性,为寻找新的抗生素及其它活性先导化合物提供了菌种资源和实验依据。
致谢感谢中国医药集团四川抗菌素研究所菌种中心提供的细菌、真菌测试菌,感谢成都地奥集团药物研究所新药筛选中心提供抗肿瘤抗糖尿病活性筛选!
[1] Bacon CW,White JF Jr.Microbial Endophytes[M].New York,Marcel Dekker,2000,3:267-274.
[2] 邹文欣,谭仁祥.植物内生菌研究新进展[J].植物学报,2001,43(9):881-892.
[3] Fenical W,Baden D,Burg M.Marine derived pharmaceuticals and related bioactive compounds.In From Monsoons to Microbes:Understanding the Ocean’s Role in Human Health.Edited by Fenical W[M].National Academies Press,1999:71-86.
[4] QinS,XingK,Jiang JH,Xu LH,et al.Biodiversity,bioactive natural products and biotechnological potential of plant-associated endophytic actinobacteria[J].Appl Microbiol Biotechnol,2010,89(3):457-473.
[5] Ezra D,Castillo UF,Strobel GA,et al.Coronamycins,peptide antibiotics produced by a verticillate Streptomyces sp.(MSU-2110)endophytic on Monstera sp.[J].Microbiology,2004,150(4):785-793.
[6] Igarashi Y,Miura S,Fujita T,et al.Pterocidin,a cytotoxic compound from the endophytic Streptomyces hygroscopicus[J].J Antibiot,2006,59(3):193-195.
[7] Yan LL,Han NN,Zhang YQ,et al.Antimycin A18 produced by an endophytic Streptomyces albidoflavus isolated from a mangrove plant[J].J Antibiot,2010,63(5):259-261.
[8] SchirmerA,GadkariR,Reeves CD.Metagenomic analysis reveals diverse polyketide synthase gene clusters in microorganisms associated with the marine sponge Discodermia dissolute[J].Appl Environ Microbiol,2005,71(8):4840-4849.
[9] 徐平,李文均,张永光,等.产生大环聚酮类天然产物放线菌的分子筛选研究[J].中国抗生素杂志,2003,28(6):321-375.
[10] A.Ayuso-Sacido,O.Genilloud.New PCR primers for the screening of NRPS and PKS-I systems in actinomycetes:detection and distribution of these biosynthetic gene sequences in major taxonomic groups[J].Microbial Ecol,2005,49(1):10-24.
[11] Wood SA,Kirby BM,Goodwin CM,et al.PCR screening reveals unexpected antibiotic biosynthetic potential in Amycolatopsis sp.strain UM16[J].J Appl Microbiol,2007,102(1):245-253.
[12] 徐丽华,李文均,刘志恒,等.放线菌系统学[M].北京:科学出版社,2007:40-47.
[13] ChunJ,Lee JH,JungY,et al.EzTaxon:a web-based tool for the identification of prokaryotes based on 16S ribosomal RNA gene sequences[J].Int J Syst Evol Microbiol,2007,57(10):2259-2261.
[14] Tamura K,Dudley J,Nei M,et al.MEGA4:Molecular Evolutionary Genetics Analysis(MEGA)software version 4.0[J].Mol Biol Evol,2007,24(8):1596-1599.
[15] Skehan P,Storeng R,Scudiero D,et al.New colorimetric cytotoxicity assay for anticancer-drug screening[J].J Natl Cancer Inst,1990,82(13):1107-1112.