毛细管电泳电化学法检测过氧化氢
2011-01-11董冉冉时克林马艳芳李玲君王晓蕾
董冉冉 张 燕 时克林 马艳芳 李玲君 王晓蕾
(1.山东师范大学化学化工与材料科学学院,济南 250014; 2.淄博六中,淄博 252300)
毛细管电泳电化学法检测过氧化氢
董冉冉1张 燕1时克林2马艳芳1李玲君1王晓蕾1
(1.山东师范大学化学化工与材料科学学院,济南 250014; 2.淄博六中,淄博 252300)
以金微盘电极和离子液体修饰单壁碳纳米管糊微盘电极分别作为毛细管电泳电化学检测器,试验了两种电极对过氧化氢的响应情况,将金微盘电极与毛细管电泳联用,对过氧化氢进行了定性和定量检测。探讨了分离电压、缓冲溶液pH值和工作电位等条件对H2O2检测的影响。实验结果表明,峰电流与H2O2浓度在1.0×10-6~1.0×10-5mol/L和3.0×10-5~1.0×10-3mol/L呈良好的线性,线性回归方程分别为y(nA)=0.041 78+0.015 5x (μmol/L),y(A)=-3.304 5×10-4+0.024 29x (mmol/L),相关系数分别为0.997 5和0.999 0,当信噪比S/N=3时,浓度检出限为5×10-7mol/L。实验中发现,样品中的多巴胺、抗坏血酸等对H2O2的测定无干扰。
金微盘电极 碳纳米管糊微盘电极 毛细管电泳 电化学检测 过氧化氢
自由基是近年来基础医学和生命科学领域的研究热点,在生命活动的代谢过程中不断产生各种活性氧自由基(ROS)。过氧化氢(H2O2)作为活性氧家族中的一员也是体内氧化代谢的产物,氧化作用很强,可由超氧阴离子自发岐化生成,并能进一步生成羟自由基;可直接作用于膜脂质,形成脂质过氧化物,导致细胞膜的损伤、DNA损伤及其它的生物疾病[1];还可通过脂质过氧化物分解代谢产物丙二醛(MDA),促使蛋白质交联聚合反应引起细胞损伤[2]。H2O2不仅能直接氧化细胞膜上的脂质及蛋白,而且能自由穿过细胞膜和细胞内的铁离子反应生成·OH等活性更强的自由基,引起一系列的损伤[3]。由于H2O2在生命体中发挥着重要的作用,设计一种有效、准确地检测H2O2的方法,可以提前诊断和预防某些氧化胁迫和损伤诱导的重要疾病[4]。
H2O2的检测方法主要有电化学检测法[5]、分光光度法[6]、化学发光法[7]、荧光法[8]。在这些方法中紫外检测法的样品用量大且检测灵敏度不高;荧光法灵敏度虽高但因仪器昂贵而不能得到广泛推广;电化学检测法因其灵敏度较高、仪器设备较廉价等优点而常见报道[9]。A lpat[10]用石墨粉、矿物油、H2O2酶、沸石混合制成碳糊电极,利用脉冲和循环伏安法检测了 H2O2,H2O2浓度在5×10-6~1×10-3mol/L范围内与循环伏安信号具有良好的线性关系,检出限为8×10-7mol/L,该方法成功地用于检测牛奶中的H2O2。毛细管电泳电化学检测法因样品用量小、灵敏度高、选择性好、分析时间短、仪器设备价格低而被广泛应用。
笔者自制了金微盘电极和离子液体修饰碳纳米管糊微盘电极作为毛细管电泳电化学检测器,通过实验比较了两种电极对H2O2的响应情况,选择了金微盘电极与毛细管电泳联用在正电位区检测H2O2,探讨了分离电压、缓冲溶液pH值和工作电位等条件对H2O2检测的影响,实现了H2O2的定性和定量分析。
1 实验部分
1.1 主要仪器与试剂
电化学工作站:CHI802b 型,上海辰华仪器公司;
高压电源:山东师范大学仪器厂;
毛细管:Ø25 μm×35 cm,河北永年瑞沣色谱器件有限公司;
H2O2:30%,国药集团化学试剂有限公司;
抗坏血酸(AA):纯度99%,美国Sigma公司;
多巴胺(DA):纯度98%,美国Sigma公司;
N-辛基吡啶六氟磷酸盐:上海成捷有限公司;
磷酸氢二钠、氢氧化钠等:分析纯,国药集团化学试剂有限公司;
实验中所用水均为石英亚沸高纯水,所用溶液使用前均用0.22 μm尼龙滤膜过滤。
1.2 离子液体修饰碳纳米管糊微盘电极和金微盘
电极的制备
(1)离子液体修饰碳纳米管糊微盘电极的制备
将单壁碳纳米管和离子液体以不同的质量比混合均匀,加热后装入内径200μm、外径375 μm、长约4 cm的石英毛细管中,用一铜丝在加热的情况下将单壁碳纳米管和离子液体压紧以保持良好导电性,将铜丝另一端缠绕到一直径0.4 mm,长5 cm的铜丝上,两铜丝接触部分涂上银导电胶,放在80℃ 烘箱中烘干。将石英毛细管和铜丝插入一长约3.0cm、外径约1 mm、内径约为0.3 mm的玻璃管,用GJ-301型环氧树脂胶将银导电胶所覆盖的部分封在玻璃管内,将电极晾干,在硫酸纸上打磨光滑待用。
(2)金微盘电极的制备
将一直径为200μm、长约4 cm金丝插入一段长约3 cm、内径250μm、外径375 μm的石英毛细管中,一端露出金丝,一端与石英毛细管末端对齐,用GJ-301型环氧树脂胶填满整个毛细管,将露在外面的金丝缠绕到一长约5 cm的铜丝(Ø0.4 mm×5 cm)上,并用银导电胶将缠绕部分覆盖,使其导电良好,将其放在80℃烘箱中烘1 h后,插入一段长约3.0cm、外径约1 mm、内径约为0.5 mm的玻璃管,用GJ-301型环氧树脂胶封住玻璃管的两端,将毛细管和铜丝接口处封在玻璃管内,用金相砂纸打磨使电极表面光滑,依次用二次水、乙醇、二次水各超声5 min,晾干待用。
1.3 H2O2的分析
毛细管电泳分离系统建立在自组装的电泳仪上,毛细管进样端与高压电源正极一起插入电泳缓冲液池中。毛细管出口端用固定在检测电解池上,高压电源负极与此检测池连通。充满电泳缓冲液的毛细管与高压电源形成回路,构成毛细管区带电泳的分离系统。工作前,利用三维显微操纵器调节工作电极的位置与毛细管的出口端紧密对接。调节高压电源电压为18 kV,当基线电流平稳后,电压调到5 kV电迁移进样10.0s,并开始记录电泳图。检测系统在CHI802b上利用三电极体系,以柱端安培检测法对H2O2进行检测。毛细管在使用前依次用0.1 mol/L NaOH、二次水、电泳缓冲液各清洗5 m in,工作电极电势均相对于饱和甘汞电极(SCE)。
2 结果与讨论
2.1 工作电极的筛选
根据文献[11]报道的以N-辛基吡啶六氟磷酸盐为粘合剂的CNTs电极对H2O2的电化学反应有明显的催化作用,笔者认为该类电极可以用作毛细管电泳检测器。实验中笔者以不同比例制备了离子液体修饰碳纳米管糊微盘电极和金微盘电极,分别试验了单壁碳纳米管和离子液体质量比为1∶9、2∶8、3∶7、4∶6、1∶1 时制成的离子液体修饰单壁碳纳米管糊微盘电极和金微盘电极对H2O2的响应情况。图1为H2O2在单壁碳纳米管与离子液体的质量比为3∶7的糊微盘电极和金微盘电极上的电泳图。分离电压:图1A为14 kV,图1B为18 kV;H2O2浓度:图1A为1 mmol/L,图1B为0.1 mmol/L;缓冲溶液:0.025 mol/L pH 7.4 PBS;5.0kV电迁移进样10.0s;检测电势:0.80V;毛细管:内径25 μm,外径 375 μm, 长 35 cm。

图1 H2O2在离子液体修饰碳纳米管糊微盘电极(A)和金微盘电极(B)上的电泳图
实验发现,单壁碳纳米管含量越大,基线则越高,噪音也越大,当质量比为3∶7时所制得的糊微盘电极信噪比较好,但这种离子液体修饰碳纳米管糊微盘电极检测H2O2时基线仍太高、噪音太大,信噪比很小,不适合用于毛细管电泳检测。因此实验选择了金微盘电极作为工作电极。
2.2 检测电势
在0.025 mol/L Na2HPO4-NaH2PO4缓冲液中,固定进样条件和分离条件,改变检测电势Ed,对H2O2进行检测。实验中发现,当检测电位在负电位区时,电流基线过高,且空白液出现峰电流(检测条件同图1),这是由于在负电位区时水中的溶解氧会在电极表面反应所致[5]。当检测电势在正电位区时,峰电流随着检测电位的增大而增大,信噪比增大,当高于0.9 V后,随检测电势增大,基线电流也显著增大,基线噪音也增大,信噪比明显减小,所以选择检测电势为0.8 V。
2.3 分离电压
分离电压对分离速度、分离度、半峰宽等均产生影响。实验在0.025 mol/L Na2HPO4-NaH2PO4缓冲液中,固定进样条件及检测条件,在10~20kV电压范围内选择不同的分离电压Vs进行H2O2检测(实验条件同图1)。表1列出了迁移时间tm、峰半宽W1/2、分离电压Vs与峰电流ip值。
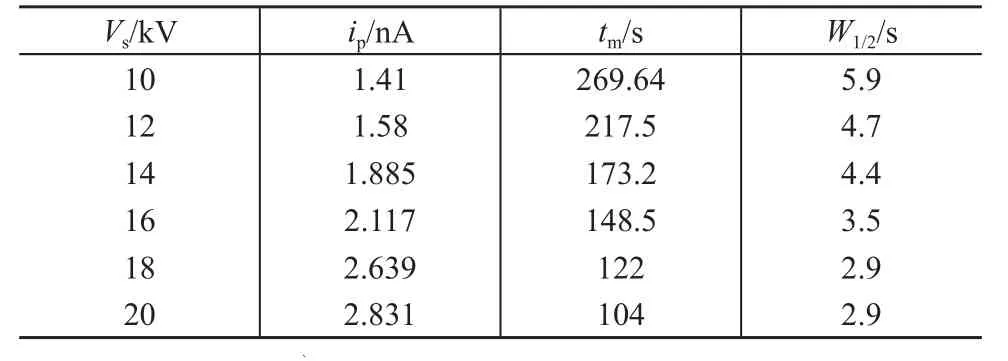
表1 分离电压与i p、t m、W1/2的关系
由表1可以看出,迁移时间随分离电压的增大而减少,峰电流随分离电压增大而增大,但是高电压也同时造成了基线噪音增大,从而降低了信噪比。因此实验中选择18 kV为分离电压。
2.4 缓冲溶液的pH值
试验了不同pH值的NaH2PO4-Na2HPO4缓冲液对H2O2测定的影响。实验发现,当pH值在6.8~9.0时,峰电流随着pH值的增大而增加,但变化幅度不大。由于H2O2在pH 3.5~4.5时最稳定,在碱性溶液中极易分解,本实验将用于检测生物样品,因此选择了缓冲溶液的pH值为7.4。
综合上述结果,毛细管电泳检测H2O2的最佳实验条件:缓冲液为0.025 mol/L Na2HPO4-NaH2PO4(pH 7.4),分离电压为18 kV,检测电势为0.8 V,进样时间为5 kV下进样10.0s。
2.5 工作曲线、精密度、检出限
在上述最佳实验条件下,对不同浓度的H2O2进行电泳分离,H2O2浓度在1.0×10-6~1.0×10-5mol/L和 3.0×10-5~1.0×10-3mol/L范围内与峰电流呈较好的线性关系,线性回归方程分别为y(nA)=0.041 78+0.015 5x (μmol/L),y(A)=-3.304 5×10-4+0.024 29x (mmol/L),相 关 系 数 分 别 为 0.997 5,0.999 0。当信噪比S/N=3时,H2O2的检出限为5×10-7mol/L。对1×10-4mol/L的H2O2进行7次平行测定,统计结果显示,tm与ip的相对标准偏差分别为2.2%、2.7%,表明这种测定H2O2的方法具有良好的重现性。
实验中,对其它常见的电活性物质进行了检测,结果如图2所示(分离电压:18 kV,其它检测条件同图1)。
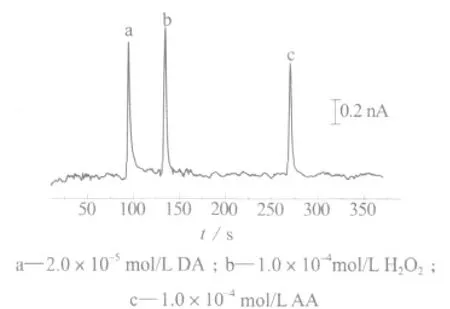
图2 H2O2、多巴胺、抗坏血酸混合液的电泳谱图
从图2中可以看出,抗坏血酸(AA)和多巴胺(DA)在毛细管电泳谱图上能够得到很好的分离,说明这些电活性物质不会干扰H2O2的测定。
2.6 样品检测
酶催化反应在生命的新陈代谢过程中具有重要的作用。酶作为具有高度专一性和高效性的特殊生物源催化剂, 在药物化学、食品检验、分析化学、生物化学等领域有着广泛的应用[12]。葡萄糖氧化酶(GOD)是一种需氧脱氢酶,对人体无毒、无副作用,广泛存在于动植物和微生物体内,是一种高效高度专一的生物催化剂,葡萄糖氧化酶的每个酶分子中含有两单位FAD(黄素腺嘌呤二核苷酸),在有氧条件下能专一性地催化β-D-葡萄糖生成葡萄糖酸,并产生H2O2。利用有氧催化葡萄糖生成葡萄糖酸这一性质可以有效除氧,例如果汁、啤酒、油脂罐头中除氧,金属器械防腐,并且广泛用于抗氧化剂、葡萄糖酸的生产[13]。
在最佳的实验条件下,向葡萄糖溶液中加入葡萄糖氧化酶,检测不同时间下催化反应生成的H2O2的量,每5 m in取样检测一次,得到催化反应中电流大小与催化时间的关系图(见图3,其中葡萄糖:1 mmol/L, GOD:43.6 U/L;其它检测条件同图1)。
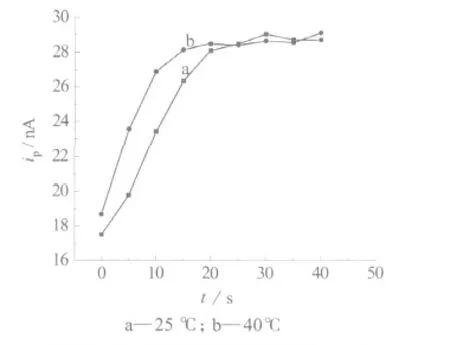
图3 催化反应中H2O2的峰电流与催化时间的关系
由图3可见,加入GOD后,立即有H2O2生成,由此说明,酶催化反应基本没有滞后期。在反应开始时,电流明显增大,电流与催化时间成正比,随酶催化反应的进行,反应速率逐渐变小,曲线弯曲;当催化时间继续延长,底物葡萄糖基本耗尽,反应达到终点,不再有H2O2生成,酶催化反应达到平衡,电流达到稳定。
研究了温度对酶活性的影响,当催化反应控制在25℃时,催化反应进行25 m in达到平衡,之后电流没有明显的变化,而当催化反应控制在40℃时,催化反应只需进行15 m in,反应很快达到平衡,并且电流增大的幅度比在25℃时明显大,说明随着温度的升高,葡萄糖氧化酶的活性提高,酶催化反应能更快地达到平衡。
3 结语
通过对金微盘电极与离子液体修饰碳纳米管糊微盘电极测定H2O2的响应情况的比较,选择了金微盘电极在正电位区不用除氧即可实现过H2O2的检测,在优化的实验条件下,H2O2的检出限为5×10-7mol/L。该法可用于葡萄糖氧化酶催化反应的研究。
[1]Inoue S, Kawanishi S. Hydroxyl radical production and human DNA damage induced by ferric nitrilotracetate and hydrogen peroxide [J]. Cancer Res, 1987, 47: 6 522-6 527.
[2]赵保路. 氧自由基和天然抗氧化剂[M].北京:科学出版社,1999: 9.
[3]叶锦霞,王岚,杨滨,等.红花水提物对乳鼠心肌细胞H2O2所致损伤的保护作用及ESR谱研究[J].中国实验方剂学杂志,2010,16(2): 56-59.
[4]Gong X C, Li Q L, Xu K H, et al. A new route for simple and rapid determ ination of hydrogen peroxide in RAW 264.7 macrophages by m icrochip electrophoresis[J]. Electrophoresis, 2009,30(11):1 983-1 990.
[5]Radschuw eit A, Rüttinger H H, Nuhn P. Capillary zone electrophoresis w ith electrochem ical detection-a sim ple and effective method to analyze oxygen-consum ing and peroxideforming processes[J]. J Chromatogr A, 2001, 937: 127-134.
[6]Schm itz O, Gab S. Separation of isomeric hydroperoxides of unsaturated fatty acids by CE [J]. J Chromatogr A, 1997, 767:249-253.
[7]Hu Y, Zhang Z, Yang C. The determ ination of peroxides generated from cigarette smoke w ith an ultrasensitive and highly selective chem ilum inescence method [J]. Anal Chim, 2007, 601(1): 95-100.
[8]Srikum D, M iller E W, Domaille D W, et al. An ICT-Based Approach to Ratiometric Fluorescence Imaging of hydrogen peroxide in Living Cells [J]. J Am Chem Soc, 2008, 130: 4 596-4 597.
[9]Toniolo R, Geatti P, Bontempelli G, et al. Amperometric monitoring of hydrogen peroxide in workplace atmospheres by electrodes supported on ion-exchange membranes [J]. Electroanal Chem,2001, 514: 123-128.
[10]A lpat S, A lpat S K, Dursun Z, et al. Development of a new biosensor for m ediatorless vo ltamm etric determ ination of hydrogen peroxide and its application in m ilk samples [J]. J Appl Electrochem, 2009, 39: 971-977.
[11]Kachoosangi R T, Musameh M M, Yousef I A, et al. Carbon Nanotube-Ionic Liquid Composite Sensors and Biosensors[J].Anal Chem, 2009, 81: 435-442.
[12]Liu C, Yuan J G , Wang Y X, et al. Progress on Glucose Oxidase[J].Food and Drug, 2010(7): 285-289.
[13]陈刚, 叶建农, 张剑霞, 等.新型葡萄糖氧化酶电极与毛细管电泳的联用[J].复旦学报,2002(4): 382-387.
DETERM INATION OF HYDROGEN PEROXIDE BY CAPILLARY ELECTROPHORESIS W ITH AMPEROMETRIC DETECTION
Dong Ranran1, Zhang Yan1, Shi Kelin2,Ma Yanfang1, Li Lingjun1, Wang Xiaolei1
(1.College of Chemistry Chemical Engineering and Materials Science, Shandong Normal University, Jinan 250014, China;2.Zibo No.6 High School of Shandong, Zibo 252300, China)
Gold m icroelectrode and ionic liquid modified-SWNTs paste m icroelectrode made by ourselves were used in capillary zone electrophoresis w ith electrochem ical end-column amperometric detection to determ ine hydrogen peroxide. Gold m icroelectrode showed higher sensitivity to H2O2was used as the detector of capillary electrophoresis. Factors influencing the performance, including separation voltage, detection potential and pH value of the buffer were studied. Under optim ized detection conditions, hydrogen peroxide responded linearly from 1.0×10-5-1×10-3mol/L and 3.0×10-5-1.0×10-3w ith a correlation coefficient of 0.997 5 and 0.999 0respectively. The concentration limit of detection of the method was 5×10-7mol/L(S/N=3). The experiment also showed that there was no electroactive interferences such as dopam ine and ascorbic acid.
gold m icroelectrode, SWNTs paste m icroelectrode, capillary electrophoresis, electrochemical detection,hydrogen peroxide
2011-09-19
