大菱鲆早期发育过程中免疫器官的发生
2011-01-11佟雪红徐世宏刘清华肖志忠马道远
佟雪红, 徐世宏, 刘清华, 李 军, 肖志忠, 马道远
(1. 中国科学院 海洋研究所, 山东 青岛 266071; 2. 盐城师范学院, 江苏 盐城 224002; 3. 中国科学院 研究生院, 北京 100039)
大菱鲆早期发育过程中免疫器官的发生
佟雪红1,2,3, 徐世宏1, 刘清华1, 李 军1, 肖志忠1, 马道远1
(1. 中国科学院 海洋研究所, 山东 青岛 266071; 2. 盐城师范学院, 江苏 盐城 224002; 3. 中国科学院 研究生院, 北京 100039)
应用组织切片研究了大菱鲆(Scophthalmus maximus)初孵仔鱼至 60日龄幼鱼免疫器官的发育过程。结果表明, 免疫器官原基出现的先后顺序是头肾、脾脏和胸腺。1日龄仔鱼可以观察到头肾原基, 包含未分化的造血干细胞。5日龄时, 脾脏原基出现, 其淋巴化开始于27日龄且发育速度较慢。13日龄时, 大菱鲆仔鱼胸腺原基出现, 且发育速度较快, 分为外区和内区。在大菱鲆早期发育过程中, 胸腺和头肾之间出现细胞迁移现象。免疫器官淋巴化的顺序是胸腺、头肾和脾脏。在免疫器官发育后期, 脾脏和头肾中均发现了黑色素-巨噬细胞中心(MMCs), 脾脏中较丰富, 但在胸腺中尚未发现。在大菱鲆仔鱼早期发育阶段, 免疫器官尚未发育完善, 非特异性防御机制起着重要的免疫作用。
大菱鲆(Scophthalmus maximus); 早期发育阶段; 免疫器官; 发生; 组织学
鱼类免疫系统是机体识别和消除“异物”的防卫系统, 是鱼类防止病原入侵的第一防线[1]2,[2]649。参与鱼类免疫应答的免疫器官主要是肾脏、脾脏、胸腺, 它们是鱼类免疫细胞发生、分化、成熟和增殖的主要场所。因此, 研究鱼体免疫器官的个体发生, 是深入认识鱼体免疫机制建立的基础, 对提高鱼苗的培育技术有重要的应用价值。目前, 国内对鲇鱼(Silurus asotus)[3], 斜带石斑鱼(Epinephelus coioides)[4]和大黄鱼(Pseudosciaena crocea)[5]等免疫器官的发生发育规律进行了探讨。而对于鲆鲽鱼类免疫系统的研究, 主要见于Chantanachookhin等[6]146和 Liu等[7]对牙鲆(Paralichthys olivaceus)的研究、Padrós 等[1]2对大菱鲆(Scophthalmus maximus)的研究、Bowden等[8]对大西洋庸鲽(Hippoglossus hippoglossus)的报道及肖志忠等[9]88对条斑星鲽(Veras per moseri)的研究。
大菱鲆属鲆科(Bothidae)、菱鲆属(Scophthalmus),自然分布于东北大西洋沿岸, 其生长迅速、适应低水温生活, 市场潜力巨大。中国自1992年首次引入以来, 经过十几年的发展, 大菱鲆的工厂化养殖已成为中国一项新兴养殖产业, 有效推动了中国海水养殖第四次浪潮的形成和发展[10-12]。然而, 大菱鲆养殖产业也面临诸多挑战, 鱼苗的高畸形率和低成活率仍然是生产实践中的难点问题, 推测部分原因可能与其免疫组织尚未完善以及其免疫功能相对滞后有关。要解决这一问题, 需要研究鱼类免疫系统的早期发生, 搞清楚鱼类胚胎、仔稚鱼和幼鱼免疫能力及其免疫系统成熟机制[13]。作者从免疫器官发育方面寻找产生这些问题的可能性因素, 旨在为促进大菱鲆养殖业的健康发展提供理论指导。1
1 材料与方法
实验中大菱鲆鱼苗取自山东烟台东方海洋科技股份有限公司。仔鱼的培育密度是125 尾/升。培育时的水质条件是: 水温18-19 °C, 溶氧7.0-8.5 mg/L,盐度30-32, pH 7.7-8.0。鱼苗孵化出膜后至40日龄,每天取样1次; 40日龄以后每2 d 取样1次, 连续取样60 d, 取样在早晨投喂之前进行。样品用Bouin’s液固定, 石蜡包埋, 用KD1508A轮转式切片机(浙江金华仪器有限公司生产)连续切片, 分别进行横切(从头到尾)、纵切(从体左侧到右侧)和水平切(从背到腹)方向连续切片, 切片厚度为4-7 μm, H. E染色, 中性树胶封片, NIKON SMZ-800显微镜下观察, 照像。
2 结果
2.1 肾脏的发生
1日龄仔鱼(2.82 mm), 肾为1对简单的直肾管,位于卵黄囊和脊索之间, 头肾间组织出现未分化的干细胞(图 1-1)。2日龄仔鱼(2.90 mm), 肾脏向前延伸, 肾管分支形成前肾管; 向后肾管沿着脊椎直抵躯干后部, 开口于肛门。3日龄仔鱼(3.29 mm), 前肾管区间开始出现前肾小管, 但不发达。5日龄仔鱼(3.62 mm), 前肾小管增多, 管壁内可见一些被伊红染成粉红色的分泌细胞, 在前肾管之间可见干细胞。7日龄时(3.91 mm), 前肾小管中出现分泌细胞, 肾间组织出现许多血细胞, 同时干细胞也增多(图1-2)。8日龄时(4.1 mm)肾间组织出现淋巴母细胞。14日龄时(5.46 mm), 在头肾部位的肾管区可见活跃的淋巴细胞生成(图1-3)。
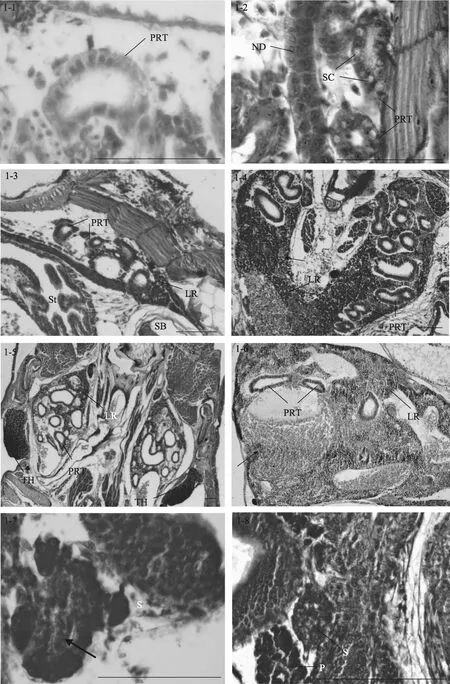
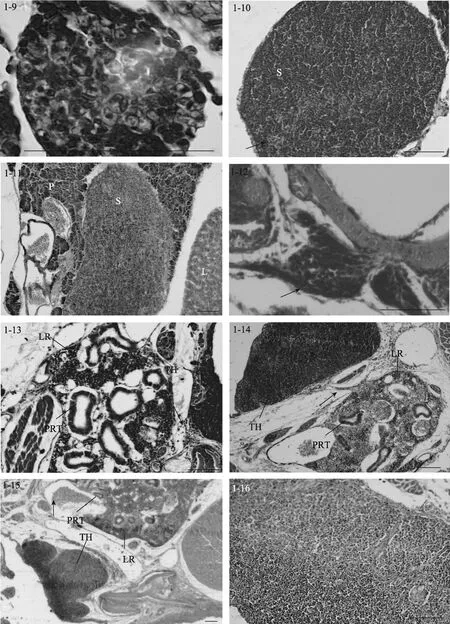
图1 大菱鲆免疫器官的发育Fig. 1 Development of immune organs in turbot
19日龄时(7.17 mm), 淋巴细胞体积变小, 染色变深, 预示着头肾淋巴化的开始。22日龄时(8.62 mm), 头肾组织体积变大, 前肾小管数量较多, 管间组织包含大量已淋巴化的小淋巴细胞和红细胞, 同时出现许多血窦(图 1-4)。27日龄时(14.05 mm), 肾管区间有发达的血管, 血管内有丰富的红细胞(图1-5)。32日龄时(17.22 mm), 头肾淋巴造血组织比率增加, 前肾小管数量减少, 肾小管上皮细胞开始退化, 有的细胞轮廓和界限不清晰, 细胞的嗜酸性大为增加, 为伊红深染。此时体肾组织由大量的肾管、淋巴细胞和红细胞占据, 头肾在结构上与体肾不同。
随着生长发育的进行, 37日龄时(20.59 mm)头肾组织的血管周围出现黑色素细胞, 并形成黑色素-巨噬细胞中心(melano-macrophage centers,简称MMCs)。50日龄时(24.76 mm), 头肾组织可见大量的血窦和血细胞, 肾小管数量明显减少(图1-6); 体肾中红细胞密集, 所占比例增大。60日龄时(31.71 mm),除了红细胞生成集落和各种淋巴细胞外, 头肾组织中仍然可见残存的前肾小管, 但结构退化, 此后头肾逐渐失去了分泌和排泄的功能, 而成为具有免疫机能和造血功能的淋巴样组织。体肾逐步成熟, 作为排泄器官, 体肾组织中出现大量的肾小管, 同时还存在丰富的血细胞和淋巴细胞, 说明体肾在造血和免疫方面也有一定的作用。
2.2 脾脏的发生
5日龄时(3.62 mm), 脾脏原基出现, 位于前肠和鳔之间, 呈椭圆形, 被胰脏组织包围(图1-7), 由疏松的间充质细胞索和毛细血管组成, 内含少量微嗜碱性细胞或造血干细胞。随着仔鱼的生长发育, 脾脏逐渐向腹部移动, 在 9日龄时(4.47 mm), 脱离胰脏的包围(图 1-8)。15日龄时(5.8 mm), 脾脏体积变大, 此时可见活跃的红细胞生成, 嗜碱性细胞和红细胞数量增多。同时成纤维细胞、嗜碱性细胞和红细胞形成了疏松的细胞索(图1-9)。
27日龄时(14.05 mm), 脾脏体积显著增大, 嗜碱性细胞明显增多且进一步分化, 体积变小, 预示了脾脏的淋巴化。同时可见许多微血管, 内含丰富的红细胞, 并形成原始的脾窦(图 1-10)。34日龄时(17.97 mm), 脾脏结构紧密, 脾窦数量增加。网状细胞通过胞质扩张形成网状组织。微血管发达, 淋巴细胞和红细胞更为丰富, 此时红细胞数量明显占优势,为优势细胞。40日龄时(21.4 mm), 红细胞和类红细胞进一步增多, 血管密集。50至60日龄(24.76-31.71 mm), 脾脏的结构与成体类似, 脾脏的网状内皮系统十分发达, 表明其具有造血和免疫功能。在脾窦附近可见大量含黑色素的巨噬细胞并形成 MMCs (图1-11)。随着鱼体的生长发育, 脾脏的组织学变化很少,主要是细胞组织的进一步生长和脾脏体积的增大。
2.3 胸腺的发生
13日龄时(5.4 mm), 大菱鲆仔鱼中胸腺原基出现, 为两侧对称的1对器官, 位于鳃腔上角背侧, 靠近鳃盖骨的背关节(图1-12)。胸腺腹面为一层扁平上皮与鳃腔分隔。胸腺由未分化的嗜碱性淋巴母细胞组成, 染色较深。17日龄时(6.7 mm), 胸腺明显, 开始出现小淋巴细胞, 此时尚无内区(髓质)和外区(皮质)之分。23日龄时(9.2 mm), 胸腺和头肾位置较近,可见细胞迁移现象, 胸腺结构变得紧密(图1-13)。
随着生长发育的进行, 在27日龄时(14.05 mm),胸腺外被一层较薄的、含分泌样细胞的上皮, 并初步分区为内区和外区, 但此时内区和外区之间没有明显的界限。在31日龄时(16.92 mm), 胸腺中出现血管, 内含血细胞。内区和外区主要由淋巴细胞和网状上皮细胞构成。内区部分染色较浅, 网状上皮细胞和类肌细胞相对较多, 淋巴细胞大而染色浅、数量少且排列松散; 外区部分染色深, 淋巴细胞小而染色深、数量多且排列密集, 无结缔组织。35日龄时(18.73 mm), 胸腺中出现许多血管, 包含血细胞, 内区和外区分区逐渐明显。同时可见胸腺和头肾组织间明显的细胞迁移现象, 即连接头肾与胸腺的细胞“桥”(图 1-14)。40 日龄时(21.4 mm), 外区和内区的淋巴细胞分布密集, 内区之下主要由一些稀疏的结缔组织构成, 结缔组织形成被膜将胸腺分割成许多不完全的胸腺小叶, 每个小叶可分为外区和内区, 小叶间的外区组织互相连接(图 1-15)。50-60日龄(24.76 mm-31.71 mm), 幼鱼的胸腺与成鱼相似, 外区主要由淋巴细胞和上皮细胞构成, 外被一层黏膜分泌样细胞上皮层; 内区部分淋巴细胞稀疏而网状上皮细胞较多, 同时可见大量的血管和血细胞延伸在胸腺实质中(图1-16)。
3 讨论
本实验中, 大菱鲆淋巴器官原基出现的顺序是头肾、脾脏和胸腺, 这跟Padrós等[1]12在大菱鲆中得出的试验结果一致, 也跟已报道的大多数海水鱼类如金鲷(Sparus aurata)[14]40、鲈鱼(Dicentrarchus labrax)[15,16]和大西洋鳕鱼(Gadus morhua)[17]512等类似; 但与罗非鱼(Apistogramma alacrina)[18]和鲤鱼(Cyprimus carpio)[19]等淡水鱼不同, 其免疫器官原基的出现顺序为胸腺、头肾和脾脏。大菱鲆免疫器官淋巴化的顺序是胸腺、头肾和脾脏, 这跟大多数硬骨鱼类免疫器官淋巴化的顺序一致。但比较特殊的是大西洋鳕鱼, 其免疫器官淋巴化的顺序是头肾、脾脏、胸腺; 而条斑星鲽, 其首先淋巴化的器官是头肾,然后是胸腺, 最后是脾脏; 推测原因可能是大西洋鳕鱼(Gadus morhuaL)和条斑星鲽对冷水温养殖环境长期适应的结果, 即水温影响了免疫器官的发生和分化[9]90, [17]515。
本实验中组织学试验数据显示, 在 23日龄时,大菱鲆胸腺和头肾之间可见细胞迁移现象, 即连接头肾与胸腺的细胞“桥”, 在金鲷等硬骨鱼中也发现了类似现象[14]45。另外, 本研究中大菱鲆头肾组织在1日龄的仔鱼中就存在未分化的造血干细胞, 而胸腺在13日龄时出现, 说明头肾的干细胞并非来自于胸腺; 而且细胞桥的存在证实了大菱鲆在早期发育过程中, 头肾的造血干细胞会迁移到胸腺中, 控制胸腺的分化, 这跟Padrós等[1]12在大菱鲆中得出的试验结果一致, 同时也支持了“头肾和胸腺是同一种干细胞分化出的不同器官”的观点[20]140,[21]78。
黑色素-巨噬细胞中心是存在于真骨鱼类免疫器官如肾脏、脾脏及软骨鱼类肝脏中的一种结构[22]。研究表明, MMCs有储存铁血黄素的作用并参与了红细胞的凋亡过程[23,24]。本试验中, 大菱鲆在脾脏和头肾中均发现 MMCs, 以脾脏中较为丰富, 但在胸腺中尚未发现此类细胞。但牙鲆和真鲷(Pagrosomus major)与此不同, 两者肾脏中 MMCs比脾脏中丰富[6]147。造成MMCs形态和数量差异的原因, 可能跟物种和鱼类的养殖环境及生态习性有关。另外, 鱼类中MMCs通常在淋巴器官发育成熟后的幼鱼阶段出现, 本实验的结果与此相类似; 但鲑鳟鱼通常在仔鱼开口时出现MMCs[25]。
大菱鲆在早期生活阶段要经历变态期, 鱼苗的形态结构发生显著改变, 器官发育尚未完善, 此时鱼苗很脆弱、死亡率较高。组织学显示, 大菱鲆淋巴器官的成熟要在变态完成后, 而免疫功能的发育完善要在幼鱼阶段。因此, 作者认为大菱鲆仔稚鱼阶段出现的较低成活率可能与其免疫器官尚未发育完善以及免疫功能相对滞后有关。在早期生活阶段, 鱼苗特异性免疫受到限制, 因此, 非特异性防御机制起着重要的免疫作用, 如: 巨噬细胞、粒细胞、溶菌酶以及网状内皮系统等[6]145。上述非特异性细胞不仅对抗原有吞噬作用, 还具有处理抗原和将抗原决定簇呈递给淋巴细胞的潜在功能, 对于早期阶段特异性免疫的缺乏起了一定的补偿作用[26-28]。另外, 母源性免疫因子在鱼类生活早期也起着同样重要的免疫保护作用[4]824,[20]136。通过母体免疫方法增强鱼体先天性的抵抗能力, 以及通过对鱼苗进行有效的免疫接种提高鱼体自身的免疫力才能从根本上减少发病率,实现健康养殖。
[1]Padrós F, Crespo S. Ontogeny of the lymphoid organs in the turbotScophthalmus maximus: a light and electron microscope study[J]. Aquaculture, 1996, 144 .
[2]张永安, 孙宝剑, 聂品. 鱼类免疫组织和细胞的研究概况[J]. 水生生物学报, 2000, 24(6) .
[3]钟明超, 黄浙. 鲇鱼淋巴样器官的发育[J]. 水产学报,1995, 3(3): 258-262.
[4]吴金英, 林浩然. 斜带石斑鱼淋巴器官个体发育的组织学[J]. 动物学报, 2003, 49(6).
[5]徐晓津, 翁朝红, 王军, 等. 大黄鱼早期发育过程中免疫器官的发生[J]. 海洋学报, 2007, 29(3): 105-113.
[6]Chantanachookhin C, Seikai T, Tanaka M. Comparative study of the ontogeny of the lymphoid organs in three species of marine fish[J]. Aquaculture, 1991, 99 .
[7]Liu Y, Zhang S C, J iang G L, et al . The development of the lymphoid organs of flounder,Paralichthys olivaceus, from hatching to 13 months [J]. Fish Shellfish Immun, 2004, 16: 621-632.
[8]Bowden T J, Cook P, Rombout J H. Development and function of the thymus in teleosts [J]. Fish Shellfish Immun, 2005, 19: 413-427.
[9]肖志忠, 于道德, 孙真真, 等. 条斑星鲽免疫器官个体发生的组织学观察[J]. 海洋科学, 2008, 32(7) .
[10]雷霁霖, 刘新富. 大菱鲆引进养殖的初步研究[J]. 现代渔业信息, 1995, 10(11): 1-3.
[11]雷霁霖, 刘新富, 马爱军. 大菱鲆的引进与驯养实验[M]. 北京: 中国林业出版社, 1998,: 408-413.
[12]雷霁霖, 马爱军, 刘新富, 等. 大菱鲆(Scophthalmus maximusL. )胚胎及仔稚幼鱼发育研究[J]. 海洋与湖沼, 2003, 34(1): 9-19.
[13]张士璀, 李欣, 汲广东. 鱼类免疫系统的早期发生[J].中国海洋大学学报, 2003, 37(4): 557-562.
[14]Josefsson S, Tatner M F. Histogenesis of the lymphoid organs in sea bream (Sparus aurata, L.)[J]. Fish Shellfish Immun, 1993, 3 .
[15]Quesada J, Villena M I, Navarro V. Ontogeny of the sea bass spleen (Dicentrarchus labrax): A light and electron microscopic study[J]. J Morphol, 1994, 221: 161-176.
[16]Abelli L, Picchietti S, Romano N. Immunocytochemical detection of thymocyte antigenic determinants in developing lymphoid organs of sea bassDicentrarchus labrax[J]. Fish Shellfish Immun, 1996, 6: 493-505.
[17]Schroder M B, Villena A J, Jorgensen T O. Ontogeny of lymphoid organs and immunoglobulin producing cells in Atlantic cod (Gadus morhuaL.)[J]. Dev Comp Immunol, 1998, 22 .
[18]Fishelson L. Cytological and morphological ontogenesis and involution of the thymus in cichlid fishes(Apistogramma alacrina) [J]. J Morphol, 1995, 223:175-190.
[19]Romano N, Taverne-Thiele A J, Fanelli M. Ontogeny of the thymus in a teleost fish,Cyprimus carpioL, Developing thymocytes in the epithelial microenvironment[J]. Dev Comp Immunol, 1999, 23: 123-127.
[20]Nakanishi T. Ontogeny of the immune system inSebasticus marmoratus: Histogenesis of the lymphoid organs and effect of theymectomy[J]. Environ Biol Fish, 1991,30 .
[21]Peterman A E, Petrie H L. Ontogeny of American paddlefish lymphoid tissues[J]. J Fish Biol, 2006, 69:72-81.
[22]Agius C, Roberts R J. Effect of starvation on the melano-macrophage centres of fish[J]. J Fish Biol,1981, 19: 161-169.
[23]Agius C. The role of melano-macrophage centres in iron storage in normal and diseased fish[J]. J Fish Dis,1979, 2: 337-343.
[24]Herraez M P. Structure and function of the melano-macrophage centres of the goldfishCarassius auratus[J]. Vet Immunol Immunop, 1986, 12:117-126.
[25]Agius C. Preliminary studies on the ontogeny of the melano-macrophages of teleost haemopoietic tissues and age-related changes[J]. Dev Comp Immunol, 1981,5: 597-606.
[26]Watts M, Kato K, Munday B I, et al. Ontogeny of immune system organs in northern bluefin tuna (Thunnus orientalis, Temminck and Schlegel 1844)[J]. Aquac Res,2003, 34: 13-21.
[27]苏友禄, 冯娟, 郭志勋, 等. 军曹鱼淋巴器官发育的形态学研究[J]. 海洋水产研究, 2008, 29(4): 7-15.
[28]肖克宇. 水产动物免疫与应用[M]. 北京: 科学出版社, 2007: 155-156.
Ontogeny of immune organs during early developmental stages of turbot
TONG Xue-hong1,2,3, XU Shi-hong1, LIU Qing-hua1, LI Jun1, XIAO Zhi-zhong1, MA Dao-yuan1
(1. Institute of Oceanology, the Chinese Academy of Sciences, Qingdao 266071, China; 2. Yancheng Teachers University, Yancheng 224002, China; 3. Graduate University of Chinese Academy of Sciences, Beijing 100039, China)
Jun., 14, 2010
turbot (Scophthalmus maximus); early developmental stage; immune organs; ontogeny; histology
A histological study was made for the development of immune organs in turbotScophthalmus maximusfrom hatching to 60 days after hatching (DAH). The sequence of immune organ anlages appearance were head kidney, spleen and thymus. At 1 DAH, head kidney anlage and primordial stem cells were observed. Spleen anlage was present at 5 DAH, it became lymphoid at 27 DAH and developed slowly. Progenitor thymus appeared at 13 DAH and grew quickly. An outer zone and an inner zone in the thymus were observed. Cell migration occurred between thymus and head kidney. The first functional lymphoid organ was thymus followed by head kidney and spleen.During the posterior developmental period of the immune organs, the melano-macrophage centers (MMCs) were found in spleen and head kidney, but not in thymus. The abundance in spleen was higher. During early developmental stages of turbot larvae, immune organs did not grow perfectly and non-specific systems may play an important role in the immunocompetence mechanisms.
S961.6
A
1000-3096(2011)01-0062-06
2010-06-14;
2010-11-15
现代农业产业技术体系建设专项资金资助项目(nycytx-50); 国家863“十一五”计划资助项目(2006AA10A404)
佟雪红(1979-), 女, 山东潍坊人, 博士, 主要从事海洋生物学研究, 电话: 0532-82898716, E-mail: txh113005@163.com; 李军,通信作者, 研究员, E-mail: junli@ms.qdio.ac.cn
谭雪静)
