化疗联合射频热疗治疗晚期大肠癌的临床观察
2011-01-10阮新建于忠和
阮新建 刘 畅 刘 兵 张 侠 于忠和
近年来,结肠癌、直肠癌等恶性消化道肿瘤患者日趋多见,由于其起病隐匿,早期缺乏特异的症状及体征,就诊时多属晚期,失去根治手术机会,预后不佳,而复发转移的晚期大肠癌则预后更差,化疗已成为主要的治疗手段。如何更好的提高化疗疗效,改善生活质量,我们自2005年4月至2010年10月对68例晚期大肠癌患者,进行常规全身化疗或化疗联合射频热疗,并行疗效分析对比,从而探索晚期大肠癌综合治疗的新途径,现将结果总结分析如下。
1 资料与方法
1.1 一般资料
全组68例患者,分为单纯化疗和化疗联合射频热疗两组。两组均有病理学诊断依据,依据临床资料进行分期,均为晚期大肠癌患者。患者均有可经CT或MRI等检查的客观可观察病灶。Karnofsky评分大于60分,预计生存时间大于3个月。治疗前行血常规、肝功能、肾功能、心电图等检查,明确无全身化疗禁忌症,签署化学治疗知情同意书,联合射频热疗者同时再签署热疗知情同意书。两组患者一般情况无统计学意义,见表1。

表1 两组患者的一般情况(例)
1.2 治疗方法
1.2.1 化疗方法 单纯化疗组患者仅接受化疗,均采用奥沙利铂或伊立替康联合5-Fu/LV化疗方案。化疗联合射频热疗组化疗方案同前,在化疗的同时联合射频热疗。两组化疗药物均按标准剂量计算给药,以21 d或28 d为1个周期。
1.2.2 热疗方法 化疗联合射频热疗组,化疗当天即开始使用南京恒埔7 000型射频肿瘤热疗机行局部射频热疗。该机采用可调电容式透热,上下、左右两对辐射器分时加热,电极直径为15~30 cm,工作频率为40.68 MHz,最大输出功率1 500 W,反射率<3%,依据CT或MRI等影像学资料,将热疗机辐射器定位于有客观观察的肿瘤病灶部位,辐射器与皮肤之间使用水袋使之充分耦合,采用四条高阻温度传感器估算靶区内肿瘤温度,控制体表温度在(40±1)℃,每周热疗2次,每次60 min,每热疗6~8次为1个疗程。
1.3 疗效评价
全部患者每行2个周期治疗进行1次疗效评价。治疗前、后采用相同的检查方法(主要是CT或MRI检查)观察客观可测量病灶变化情况。按照美国癌症研究所RECIST疗效评估方法(2000年)行客观疗效判定,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD),CR+PR为有效率。
1.4 毒副作用评价
毒性评价标准按照(美国)抗癌药物不良反应的分度标准(NCI-CTC)分为0~Ⅳ度。主要观察治疗过程中两组患者的消化道反应、骨髓抑制及周围神经毒性的发生率。
1.5 临床受益率
疾病缓解或稳定的患者自觉临床症状得以改善,包括疼痛评分或镇痛药物用量、Karnofsky评分、体重增加或体力改善3项指标,评价指标至少有1项改善持续时间>4周,其他的评估指标没有恶化,可判断为临床受益。
1.6 统计学处理
采用χ2检验,应用SPSS15.0版分析软件处理。
2 结果
2.1 近期疗效
单纯化疗组与化疗联合射频热疗组患者治疗后疗效比较见表2。单纯化疗组、化疗联合射频热疗组治疗有效率分别为35.29%、44.11%,化疗联合热疗组有效率高于单纯化疗组,但无统计学意义(P>0.05),两组患者均无完全缓解者。

表2 两组患者近期疗效比较(例,%)
2.2 不良反应
本组未出现化疗相关性死亡者。主要不良反应仍是与化疗相关的不良反应,如消化道反应(恶心、呕吐、腹泻等)、骨髓抑制及周围神经毒性,两组毒副作用发生情况见表3。两组治疗后主要毒副作用比较均无统计学意义(P>0.05)。另外化疗联合射频热疗组热疗后3例(8.82%)出现皮下脂肪硬结,但不影响生活质量,1~2个月后自行消退。
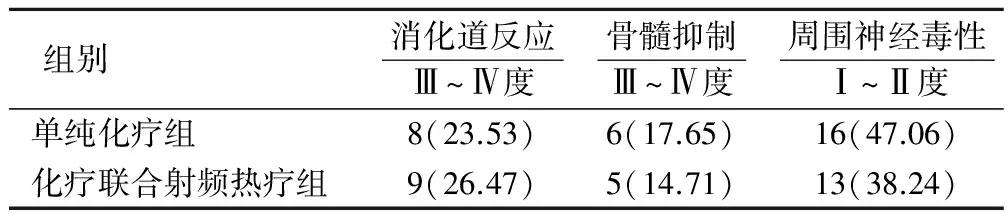
表3 两组毒副作用发生情况(例,%)
2.3 临床受益改善情况
单纯化疗组临床受益11例(32.35%);化疗联合射频热疗组临床受益20例(58.82%);两组差异有统计学意义(P<0.05)。
3 讨论
循证医学表明化疗已成为晚期大肠癌的主要治疗手段,虽然新的化疗药物如奥沙利铂、伊立替康等不断问世,疗效有所提高,但已达到一个平台。如何更好的提高疗效,减少不良反应,改善生活质量,已成为重点探讨的问题。近年来,合理运用各种手段进行综合治疗已成为发展趋势,射频热疗作为1种新的治疗手段发展迅速,热疗与化疗的联合治疗的研究不断深入。目前临床研究已表明:①热疗本身对肿瘤细胞有直接的杀伤作用,当组织受热达40℃,细胞稳定性降低,对放射线和化学药物的敏感性增加,当温度升至45℃并持续60 min,细胞将发生不可逆的损伤[1]。由于肿瘤组织内血管构造的异常,使肿瘤组织较正常组织散热能力减弱,热在肿瘤组织内积聚,导致肿瘤组织与正常组织之间有3℃~5℃的温度差,即人体温度达到40℃时,肿瘤组织内温度已达到43℃~45℃,这就使肿瘤组织发生热损伤时正常组织不受损害;②肿瘤热疗与化疗具有协同作用,热疗可使肿瘤局部血流量增多,从而使瘤体内的药物摄取增加,还可改变肿瘤细胞膜内脂质及蛋白质的结构,使细胞膜通透性增加,药物在瘤体内含量增加;热、化疗联合可促使癌细胞凋亡的发生[2];加温可抑制DNA多聚酶介导的DNA损伤修复作用,使某些蛋白质变性,故可能会逆转某些化疗药物的多药耐药[3];临床研究表明,肿瘤周边部位血供较多,化疗药物容易到达,化疗具有优势;而肿瘤中心血供较差,多为乏氧细胞,不易散热,对高热敏感,因此,热疗与化疗联合可覆盖肿瘤病灶的全部;热化疗能降低肿瘤VEGF合成与分泌,破坏与减少肿瘤血管再生[4];加温可使化疗药物细胞毒性增强,从而提高疗效,如草酸铂已被证实在加热条件下能提高治疗效果[5];③热疗可以干涉肿瘤侵袭转移的中间环节如细胞外基质降解酶、黏附分子等,影响肿瘤的侵袭转移;④热疗可以刺激机体的细胞免疫和体液免疫系统,产生大量的自然杀伤细胞、T细胞、巨噬细胞和抗体效价持续增高,增强机体免疫效应;加热后的肿瘤细胞还可以合成1种应激性蛋白,它具有抗原性,能刺激机体免疫系统,提高机体免疫功能[6]。
本组化疗联合射频热疗有效率(44.11%)较单用化疗有效率(35.29%)提高,但无统计学意义,分析可能与本试验病例数较少有关。不良反应两组间无统计学意义,表明联合射频热疗未增加化疗药物的不良反应,患者均能耐受。由于精心操作,未出现皮肤烫伤等热疗相关不良反应。化疗联合射频热疗组临床受益率(58.82%)明显高于单纯化疗组(32.35%),临床症状得到确实改善,与国内相关报道的相近[7]。
总之,对于无法根治的晚期大肠癌患者,目前较新的治疗理念是在不降低生活质量的前提下,尽可能的提高疗效。我们的体会是射频热疗联合化疗疗效有所提高,临床受益改善明显,患者耐受性好,生活质量得到明显提高。但是化疗联合射频热疗目前仍是肿瘤界研究的热点和难点,还没有固定的经验模式可遵循,如何准确把握热疗的各项参数,如最佳的温度和作用时间,如何选择最有效化疗药物,如何设法避开或减弱热耐受等问题仍需要进一步探讨,远期疗效也有待于扩大样本量并进行随防观察,进一步分析总结。
[1]徐中林.恶性肿瘤的热切除治疗〔J〕.国外医学肿瘤学分册,2002,29(4):277.
[2]Arends J.Effects of a combined thermochemothera-py on m-arkers of opoptosis,differentiation and ad-hesion in the human mammary carcinoma MX-1:Alight microscopic and immunohistochemical study〔J〕.Anat Anz,2000,182(4):339.
[3]Brozovic A,Simaga S,Osmak M.Induction of heatshock protein 70 in drug-resistant cells by anti-cancer drugs and hyperthermia〔J〕.Neoplasma,2001,48(2):99.
[4]Sawaji Y,Sato T,Takeuchi A,et al.Antiangiogenicaction of hyperthermia by suppressing gene expres-sion and production of tumour derived vascular en-dothelial growth factor in vivo and in vitro〔J〕.Br J Cancer,2002,86(10):1597.
[5]Mohamed F,Marchettini P,Stuart OA,et al.Ther-mal enhancement of new chemotherapeutic agents atmoderate hyperthermia〔J〕.Ann Surg Oncol,2003,10(4):463.
[6]李 梅,王 芳,魏万里.肿瘤热疗的研究进展〔J〕.现代肿瘤医学,2006,14(9):1169.
[7]张婷婷,白玉贤,韩 宇,等.射频热疗联合化疗治疗晚期胃肠道恶性肿瘤的近期疗效分析〔J〕.实用肿瘤学,2008,22(4):344.
