DR-nm23基因及其蛋白在大肠癌组织中的表达研究
2011-01-10曲利娟熊喜生
曲利娟 杨 直 曾 玲 熊喜生
DR-nm23基因又称nm23-H3或NME3(non-metastatic cell 3),是迄今nm23肿瘤转移抑制基因家族8个成员(nm23-H1~nm23-H8)之一,系1995年由Venturelli等[1]应用cDNA文库差异显示筛选技术,从慢性粒细胞性白血病(chronic myelogenous leukemia,CML)急性发作期的原代细胞中克隆出。已知DR-nm23与细胞的增殖、分化、凋亡、黏附、侵袭等多种生物学行为有关,但该基因与肿瘤发生发展关系的报道甚少,尤其是与大肠癌组织的相关性研究未见报道。正常-腺瘤-癌顺序是人类大肠癌的发生、发展模式,本研究采用核酸原位杂交和免疫组化方法,检测正常肠黏膜组织、腺瘤及大肠癌组织中DR-nm23的表达水平,从mRNA和蛋白2个水平上探讨DR-nm23与大肠癌发生发展的关系。
1 材料与方法
1.1 病例材料
选取南京军区福州总医院2006年~2008年收治的、经病理检查证实的大肠癌根治术标本98例,其中大肠癌不伴淋巴结转移组59例,大肠癌伴淋巴结转移组39例;39例转移组中同时具有原发癌和淋巴结转移癌29例。选取57例大肠管状绒毛状腺瘤为腺瘤组,其中腺瘤伴高级别上皮内肿瘤35例,腺瘤伴低级别上皮内肿瘤22例。另选取42例大肠癌无转移组匹配邻近正常黏膜组织为正常组。98例大肠癌组中,男性69例,女性29例,年龄27~79岁,中位年龄57.84岁。肿瘤发生部位:结肠46例,直肠52例。组织学类型:乳头状腺癌25例,管状腺癌30例,黏液腺癌14例,低分化腺癌17例,印戒细胞癌12例。病理分级(参照2000年WHO分级标准):Ⅰ级25例,Ⅱ级44例,Ⅲ级29例。所有标本经10%中性福尔马林液固定,常规石蜡包埋。
1.2 核酸原位杂交
DR-nm23 mRNA寡核苷酸探针序列为5’-ATCCCGCTCCCGCACCGCCATC-3’,由上海博亚公司合成并进行5’端和3’端地高辛标记。敏感性加强型原位杂交检测试剂盒Ⅰ购自武汉博士德公司。按试剂盒说明书进行核酸杂交:切片脱蜡入水,3% H2O2甲醇阻断内源性过氧化物酶活性,室温孵育10 min;PBS 5 min×3,蒸馏水5 min×1;3%柠檬酸新鲜稀释的胃蛋白酶暴露mRNA核酸片段,37℃消化20 min,PBS 5 min×3,双蒸馏水5 min×1;滴加20 μl加预杂交液,37℃、4 h;吸去多余预杂交液,不洗;滴加20 μl杂交液,37℃、杂交12~16 h;杂交后洗涤;滴加封闭液,37℃、30 min;甩去多余液体,不洗;滴加生物素化鼠抗地高辛,37℃、60 min;PBS 5 min×4;滴加SABC,37℃、20 min;PBS 5 min×3;滴加生物素化过氧化物酶,37℃、20 min;PBS 5 min×4;DAB显色;苏木精复染,盐酸分化,水洗反蓝;封固,光镜下观察。用不加探针的杂交液作为阴性对照。
1.3 免疫组织化学
浓缩型羊抗人DR-nm23(编号SC-50945)多克隆抗体及即用型SABC免疫组化试剂盒,分别购自美国Santa Cruz 生物技术公司和武汉博士德生物工程有限公司。采用SP法免疫组织化学法染色:切片脱蜡入水,组织抗原高压修复1 min 40 s,PBS 5 min×2;3% H2O2阻断过氧化氢酶活性10 min,PBS 5 min×2;正常兔血清室温孵育15 min;羊抗人DR-nm23抗体(工作浓度1∶300),4℃过夜12 h,PBS 3 min×3;生物素标记二抗室温孵育15 min,PBS 3 min×3;辣根酶标记链霉卵白素室温孵育15 min,PBS 3 min×3;DAB显色,显微镜下观察,水洗终止;苏木精复染,盐酸分化,水洗反蓝;封固,光镜下观察。用PBS代替一抗作为阴性对照。
1.4 结果判断
DR-nm23 mRNA杂交信号和DR-nm23蛋白阳性表达颗粒主要定位于细胞质。每张切片根据阳性率和杂交信号(或)着色强度分别进行评分:无着色为0分,浅黄色为1分,浅棕色为2分,深棕色为3分;5%以下为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,76%以上为4分。根据阳性率和杂交信号(或)着色强度两项评分的乘积进行评价,结果分为3级:0~4分为阴性(-),5~8分为弱阳性表达(+),9~12分为强阳性表达(++)。
1.5 统计学方法
采用SPSS 13.0软件包,进行多个独立样本非参数Kruskal-Wallis Test检验和两独立样本非参数Mann-Whitney Test检验。
2 结果
2.1 正常组、腺瘤组和大肠癌组中DR-nm23表达情况
正常组中DR-nm23 mRNA表达率为76.2%(32/42),而腺瘤组(21/57,36.8%)、大肠癌组中其表达率(41/98,41.8%)均下降,3组表达差异显著(χ2=21.866,P<0.01);两两比较,正常组与腺瘤组(Z=-3.538,P<0.01)、正常组与大肠癌组(Z=-4.618,P<0.01)比较差异均显著,腺瘤组与大肠癌组比较差异不显著(Z= -0.093,P>0.05)。正常组DR-nm23蛋白表达率为71.4%(30/42),腺瘤组(22/57,38.6%)、大肠癌组其表达率(25/98,35.7%)均下降,3组表达差异显著(χ2= 25.852,P<0.01);两两比较,正常组与腺瘤组(Z=-4.385,P<0.01)、正常组与大肠癌组(Z=-4.606,P<0.01)比较差异均显著,腺瘤组与大肠癌组比较差异不显著(Z=-0.024,P>0.05),见表1。杂交信号和阳性颗粒均定位于细胞质。

表1 正常组、腺瘤组及大肠癌组中DR-nm23的表达情况(例,%)
与正常组比较,※为P<0.01;与腺瘤组比较,#为P>0.05
2.2 腺瘤组中低、高级别上皮内肿瘤DR-nm23的表达
低级别组DR-nm23 mRNA表达率为45.5%(10/22),高级别组其表达率(31.4%,11/35)下降,2组比较差异不显著(Z=-0.995,P>0.05)。DR-nm23蛋白低级别组表达率为59.1%(13/22),高级别组(25.7%,9/35)其表达率下降,2组比较差异有显著性(Z=-2.646,P<0.01),见表2。

表2 腺瘤组低级别与高级别上皮内肿瘤中DR-nm23的表达情况(例,%)
2.3 DR-nm23表达与大肠癌临床病理特征的关系
DR-nm23 mRNA表达与肿瘤病理分级密切相关(χ2=9.473,P<0.01),分化越好,其表达率越高;其表达与大肠癌淋巴结转移呈负相关性(Z=-3.555,P<0.05),但与大肠癌组织学类型无相关性(χ2=9.142,P>0.05)。DR-nm23蛋白表达不仅与大肠癌淋巴结转移呈负相关性(Z=-2.156,P<0.05),而且与大肠癌组织学类型(χ2=13.731)和病理分级(χ2=12.198)相关(P<0.01),见表3。
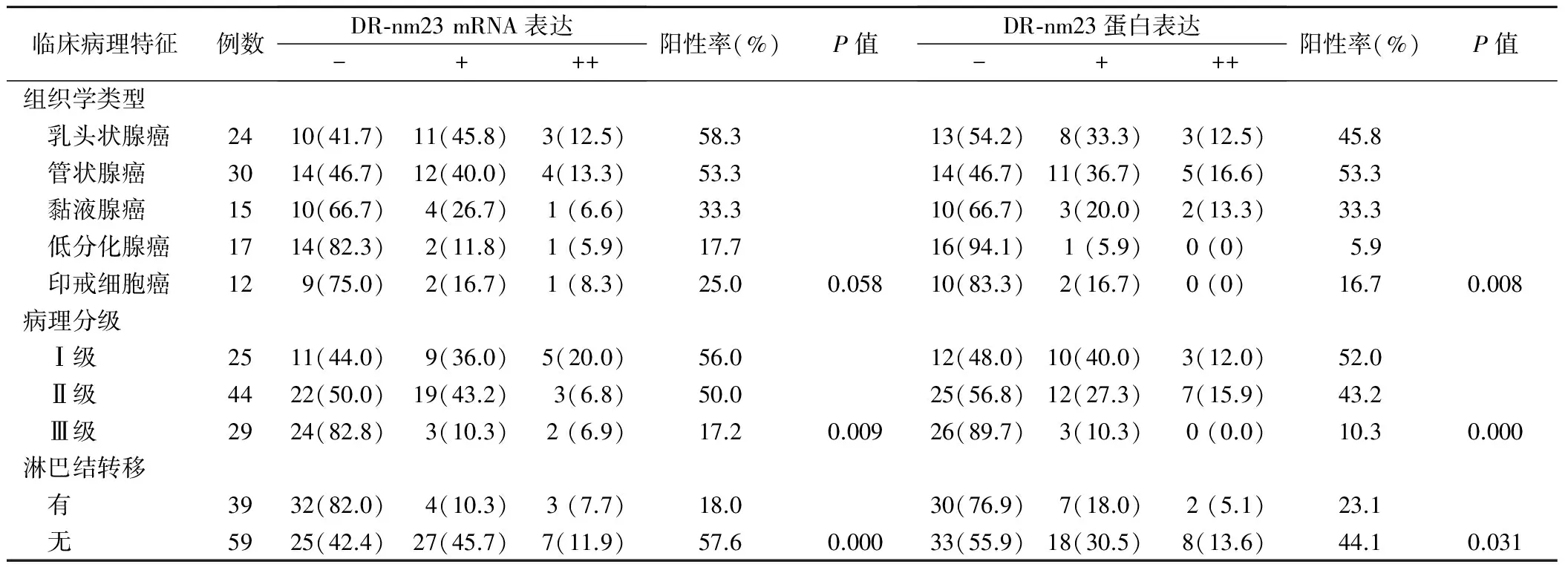
表3 DR-nm23表达与大肠癌临床病理特征的关系(例,%)
2.4 大肠癌转移组原发癌及其淋巴结转移癌中DR-nm23的表达
原发癌和淋巴结转移癌中DR-nm23 mRNA(Z=-1.188)及其蛋白(Z=-0.585)的表达差异均不显著(P>0.05),见表4。

表4 大肠癌转移组原发癌和淋巴结转移癌中DR-nm23的表达情况(例,%)
3 讨论
转移是大肠癌的重要生物学行为,是患者死亡主要原因之一。大量研究表明,肿瘤转移过程涉及一系列复杂的分子事件,是多步骤、多因素、多基因共同参与的复杂病理过程。其中肿瘤转移抑制基因nm23-H1与大肠癌转移的相关性已得到公认。DR-nm23又称nm23- H3是nm23肿瘤转移抑制基因家族成员之一,基因定位于染色体16q13,cDNA全长849 bp,由6个外显子和5个内含子组成,结构与nm23-H1和nm23-H2具有65%~70%高度同源性,但启动子结构与该家族其他成员不同,几乎不含经典的TATA框或CAAT框,而富含G+C[1]。位于上游远端核苷酸+136~+143及转录起始点下游核苷酸-1028~-523处有SP1、Ap-2、Myb、ets、GATA和Hox-1等多个转录起始因子相关元件结合位点,参与调控基因的转录效率及活性,激活DR-nm23基因的表达[1,2]。DR-nm23基因所编码的蛋白质产物是二磷酸核苷激酶(nucleoside diphosphate kinase,NDPK),NDPK的主要生理功能包括[3~5]:①具有组氨酸蛋白激酶活性,即通过磷酸组氨酸中间产物将与蛋白质结合的二磷酸核苷可逆磷酸化为三磷酸核苷,调节细胞内能量池大小,活化蛋白质,从而参与蛋白质各种功能的活动。②参与丝氨酸磷酸化及转录激活等。③具有ATP活性,参与CTP、UTP及GTP的生物合成。
研究表明,NDPK活性是nm23家族的共同特性,与细胞的分化和增殖活动密切相关[6~8],但分子机制并不十分清楚。nm23家族成员在不同组织的表达和生物学功能不尽相同。nm23-H1与多种肿瘤转移潜能密切相关[7],nm23-H2调控c-myc原癌基因转录,参与细胞的生长、分化[8];nm23-H4调节线粒体功能,与肿瘤发生发展和转移有关[9];睾丸特异性表达基因nm23-H5和nm23-H6~H8均被证实具有NDPK活性或NDPK样区域,推测可能参与肿瘤的形成和进展机制[10]。DR-nm23在CML、星形胶质细胞瘤、神经母细胞瘤、部分实体瘤如乳腺癌、胰腺癌、大肠癌、前列腺癌等均有表达。Venturelli等[11]研究发现DR-nm23在CML慢性期高表达,通过抑制粒细胞集落刺激因子诱导粒细胞分化,同时促进粒细胞凋亡,参与CML的发生、并使病情处于相对稳定状态;而在CML进展期DR-nm23表达下调或缺失,粒细胞分化严重抑制甚至停滞,使髓前体细胞过度增殖,病情急转直下向急性发作期转化。提示DR-nm23在造血细胞分化早期发挥重要作用,DR-nm23基因的突变、缺失和CML不同阶段的差异表达,可能与CML的发生、发展和恶化密切相关。Huang等[12]研究显示DR-nm23在正常脑组织中不表达,星形细胞瘤表达上调,表达与星形细胞瘤的发生有关。Amendola等[13,14]研究表明神经母细胞瘤分化越好DR-nm23表达水平越高; DR-nm23通过降低SK-N-SH神经母细胞瘤细胞株的细胞外基质的黏附性,促进Ⅳ型胶原增生,增加波形蛋白表达,从而抑制瘤细胞生长。这一特性在鼠NLE-15神经母细胞瘤细胞株的表现也得到验证,研究显示DR-nm23高表达能促进瘤细胞轴突快速生长,使β-整联蛋白显著增多,Ⅰ型胶原蛋白黏附性增加,抑制瘤细胞生长。此外,DR-nm23基因突变可减弱细胞分化能力,促进肿瘤转移[15]。
本组实验结果显示:在mRNA和蛋白两个水平,大肠癌组DR-nm23表达均较正常组、腺瘤组低,表达差异极显著;两两比较,正常组与腺瘤组、正常组与大肠癌组的表达差异均显著,但腺瘤组与大肠癌组间表达差异不显著;腺瘤组中高级别上皮内肿瘤表达较低级别上皮内肿瘤下调。提示DR-nm23基因及其蛋白产物的表达水平下调与大肠癌发生发展密切相关,且可能主要参与上皮内瘤变等癌前病变的过程。结果还显示:DR-nm23基因表达与肿瘤病理分级相关,但与组织学分型无关;DR-nm23蛋白表达与肿瘤病理分级和组织学分型均有相关性,提示DR-nm23参与了大肠癌细胞的分化,癌细胞分化越好,DR-nm23表达率越高。
本组中淋巴结转移组DR-nm23基因及蛋白表达较无淋巴结转移组高,表达与淋巴结转移呈负相关性,结果与孙青等[16]一致,提示DR-nm23可作为反映大肠癌生物学行为和预后的潜在重要指征之一。本组实验结果还显示:转移组中,原发癌与其匹配淋巴结转移癌DR-nm23在mRNA和蛋白水平表达差异不显著,从另一方面也提示了大肠癌从原发灶向转移灶转移的过程,不仅是多基因、多因素、多机制共同参与的复杂病理过程,而且表达水平在转移过程中也可能发生相应变化。
[1]Venturelli D,Martinez R,Melotti P,et al.Overexpression of DR-nm23,a protein encoded by a member of the nm23 gene family,inhibits granulocyte differentiation and induces apoptosis in 32Dc13 myeloid cells〔J〕.Proc Natl Acad Sci USA,1995,92(16): 7435.
[2]曲利娟,丁彦青.DR-nm23基因与肿瘤发生发展关系的研究进展〔J〕.国外医学肿瘤学分册,2005,32(5):336.
[3]Lacombe ML,Tokarska-Schlattner M,Epand RF,et al.Interaction of NDPK-D with cardiolipin-containing membranes: Structural basis and implications for mitochondrial physiology〔J〕.Biochimie,2009,91(6):779.
[4]Miyamoto M,Iwashita S,Yamaguchi S,et al.Role of nm23 in the regulation of cell shape and migration via Rho family GTPase signals〔J〕.Mol Cell Biochem,2009,329(1~2):175.
[5]Postel EH,Zou X,Notterman DA,et al.Double knockout Nme1/Nme2 mouse model suggests a critical role for NDP kinases in erythroid development〔J〕.Mol Cell Biochem,2009,329(1~2):45.
[6]Postel EH.Multiple biochemical activities of NM23/NDP kinase in gene regulation〔J〕.J Bioenerg Biomembr,2003,35(1): 31.
[7]Kim HD,Youn B,Kim TS,et al.Regulators affecting the metastasis suppressor activity of Nm23-H1〔J〕.Mol Cell Biochem,2009,329(1-2):167.
[8]Thakur RK,Kumar P,Halder K,et al.Metastases suppressor NM23-H2 interaction with G-quadruplex DNA within cM- YC promoter nuclease hypersensitive element induces c-MYC expression〔J〕.Nucleic Acids Res,2009,37(1):172.
[9]Tokarska-Schlattner M,Boissan M,Munier A,et al.The nucleoside diphosphate kinase D(NM23-H4)binds the inner mitochondrial membrane with high affinity to cardiolipin and couples nucleotide transfer with respiration〔J〕.J Biol Chem,2008,283(38):26198.
[10]Munier A,Serres C,Kann ML,et al.Nm23/NDP kinases in human male germ cells: role in spermiogenesis and sperm motility?〔J〕.Exp Cell Res,2003,289(2): 295.
[11]Venturelli D,Cesi V,Ransac S,et al.The nucleoside diphosphate kinase activity of DR-nm23 is not required for inhibition of differentiation and induction of apoptosis in 32Dcl3 myeloid precursor cells〔J〕.Exp Cell Res,2000,257(2): 265.
[12]Huatao Huang,Colella S,Kurrer M,et al.Gene expression profiling of low-grade diffuse astrocytomas by cDNA arrays〔J〕.Cancer Res,2000,60(24): 6868.
[13]Amendola R,Martinez R,Negroni A,et al.DR-nm23 gene expression in neuroblastoma cells: relationship to integrin expression,adhesion characteristics,and differentiation〔J〕.J Natl Cancer Inst,1997,89(17):1300.
[14]Amendola R,Martinez R,Negroni A,et al.DR- nm23 expression affects neuroblastoma cell differentiation,integrin expression,and adhesion characteristics〔J〕.Med Pediatr Oncol,2001,36(1): 93.
[15]Negroni A,Venturelli D,Tanno B,et al.Neuroblastoma specific effects of DR-nm23 and its mutant forms on differentiation and apoptosis〔J〕.Cell Death Differ,2000,7(9): 843.
[16]孙 青,丁彦青,高雪芹.肿瘤转移相关cDNA基因芯片的制备与应用〔J〕.第一军医大学学报,2002,22(12):1070.
