Mel-18在前列腺癌中的临床意义
2011-01-10胡卫列聂海波邱晓拂赵永斌肖远松
王 尉 胡卫列 吕 军 聂海波 邱晓拂 赵永斌 肖远松 刘 俊
最近研究表明,Mel-18 可能是1种新的抑癌基因。有报道发现Mel-18 表达于正常乳腺组织,而在乳腺癌原代标本中低表达或不表达,Guo 等[1~5]认为增强乳腺癌细胞Mel -18 的表达,可降低乳腺癌细胞Akt/ PKB 的活性。尽管在人类许多肿瘤中都发现了Mel-18基因的异常,但目前国内、外尚鲜见Mel-18 与前列腺癌关系的报道。它与前列腺癌分期、转移及预后之间是否存在相关关系;能否成为前列腺癌诊断及预后判断的标志物应用于临床,仍不十分明确。
1 材料与方法
1.1 临床资料
前列腺癌标本取自广州军区广州总医院泌尿外科收治的前列腺癌患者,免疫组织化学采用辣根过氧化物酶法染色。
对广州军区广州总医院泌尿外科收治的202例前列腺癌患者病理组织标本进行Mel-18免疫组织化学染色。患者的临床病理参数见表1。这些患者在前列腺癌确诊前未接受过内分泌等前列腺癌相关性治疗,通过TNM 分期系统进行临床及病理分期。自1997年至2003年期间,对76例接受根治性前列腺切除的局限性前列腺癌患者,进行生存分析,生存参数包括Gleason评分,包膜外浸润、精囊受累、外科切缘、Mel-18染色强度等。对126例未接受根治性前列腺切除术的前列腺癌患者,包括61例伴骨转移的前列腺癌患者进行生存分析,病理组织取自前列腺穿刺活检样品,通过X线、CT、MRI 及骨扫描明确转移情况。
76例接受根治性前列腺切除的局限性前列腺癌患者,平均年龄为(70.2±5.1)岁,平均随访时间为(36.3±22.8)月,术前平均血TPSA为(17.0±14.9)ng/ ml。病理分期T2、T3及T4分别为58.8%,34.7% 及 6.5%。阳性切缘率为43.9%。Gleason评分<7、 7 及 >7 分别为20.7%、 43.0% 及 36.3%。3年及 5年 PSA 无复发生存率分别为66.8% 及 61.6%,中位随访时间为58.1个月。
1.2 方法
免疫组织化学采用辣根过氧化物酶法染色[6]。Mel-18 单抗购自Santa Cruz Biotechnology公司(C20, USA)。
①主要步骤:切片用二甲苯脱蜡,梯度酒精和蒸馏水水化。3%H2O2封闭内源性过氧化酶20 min,自来水冲洗, 0.01 mol/L(pH7.4)洗。滴加一抗37℃孵育40 min, 4℃冰箱过夜PBS洗3次×5 min。滴加二抗37℃孵育40 min, PBS洗3次×5 min。滴加ABC试剂孵育60 min。PBS洗3次×5min。置0.03% H2O2-DAB 溶液显色20 min,自来水洗,蒸馏水洗。苏木精复染2 min或不复染,自来水洗。脱水,透明,封片。阴性对照以TBS 取代一抗。一抗Mel -18使用浓度为1∶400。②结果判定:Mel-18阳性表达集中在细胞核, 表现为细胞核内呈现棕黄色或者棕褐色颗粒。③按半定量积分判断Mel-18蛋白表达结果, Mel-18阳性染色细胞呈黄色至棕黄色、棕褐色颗粒。阳性染色强度分为1~4级,1级:阴性,细胞核不着色或无颗粒;2级:轻度阳性,细胞核呈均匀浅黄色或有极少量颗粒;3级:中度阳性,细胞核呈棕黄色,颗粒占整个细胞核的1 /2;4级:重度阳性,细胞核中充满棕褐色颗粒。Mel-18阳性染色密度(即阳性染色细胞百分率)亦分为1~4级, 1级:阳性细胞数0~5%, 2级:阳性细胞数6%~35%, 3级:阳性细胞数36%~70%, 4级:阳性细胞数71%~100%。为了比较组织间Mel-18表达水平的差异,每一组织切片的表达水平均以阳性染色总积分表示,总积分=该组织切片的阳性染色强度(1~4)×阳性染色密度(1~4)。依据总积分值,将Mel-18蛋白在组织中的表达水平分为阳性或阴性,≥4分为阳性表达,<4分为阴性表达[7]。
1.3 统计学分析
运用Logistic回归分析法调整年龄,评价Mel-18蛋白与前列腺癌发病风险、转移性前列腺癌、病理高分级的相关性。PSA复发定义为根治性手术后大于0.2 ng/ml。使用Kaplan-Meier生存分析和单变量Cox成比例危险因子模型(univariate cox proportional harzards model),评价影响患者无PSA复发生存率、癌特异性生存率及总生存率的的个体变量。除Mel-18蛋白表达量外,其他变量包括Gleason评分,术前PSA、Hb、LDH、AKP,肿瘤分期、病理分级和手术切缘情况。为同时评价包括Mel-18蛋白表达量对几个变量的影响,使用多变量Cox比例危险模型(multivariate Cox proportional harzards model),用Wald’s检验决定单变量和多变量Cox模型的统计学意义。显著性水准为0.05。数据在SPSS 10.0统计软件包上完成。
2 结果
2.1 Mel-18表达与前列腺癌临床病理特征的关系
前列腺癌组织中Mel-18 免疫组织化学染色分析表明,高Gleason 评分的癌组织较低Gleason 评分的癌组织染色强度降低。各组间染色分析结果表明:PSA≥100.1组较其它PSA组别染色阳性率减少(P=0.010);T2N0M0组较其它分期组别染色阳性率增多(P=0.021);Gleason评分8~10组较Gleason评分5~6组染色阳性率降低(P=0.031);Gleason评分9,10组较Gleason评分5~8染色阳性率降低(P=0.026)(表1)。运用多变量Cox成比例危险因子模型(multivariate cox proportional hazards model)分析表明:阴性Mel-18的染色结果是伴生化复发或前列腺癌特异性生存的独立预测因素(OR:2.143,95%CI:1.035~4.132;OR:2.365,95%CI:1.194~5.485)(表2,表3)。
2.2 Mel-18表达与生存情况的关系
按Mel-18染色结果分组进行生存分析,生存曲线分析表明:Mel-18阴性染色组较Mel-18阳性染色组,在PSA复发时间显著缩短(P=0.029)(图1A),初诊为D期的患者的癌特异性生存时间显著缩短(P=0.025)(图1B)。

表1 Mel-18表达与前列腺癌临床病理特征的关系

表2 多变量Cox成比例危险因子模型分析伴前列腺癌生化复发生存的预测因素

表3 多变量Cox成比例危险因子模型分析前列腺癌特异性生存的预测因素
注:1 HR:hazard ratio,2 CI:confidence interval
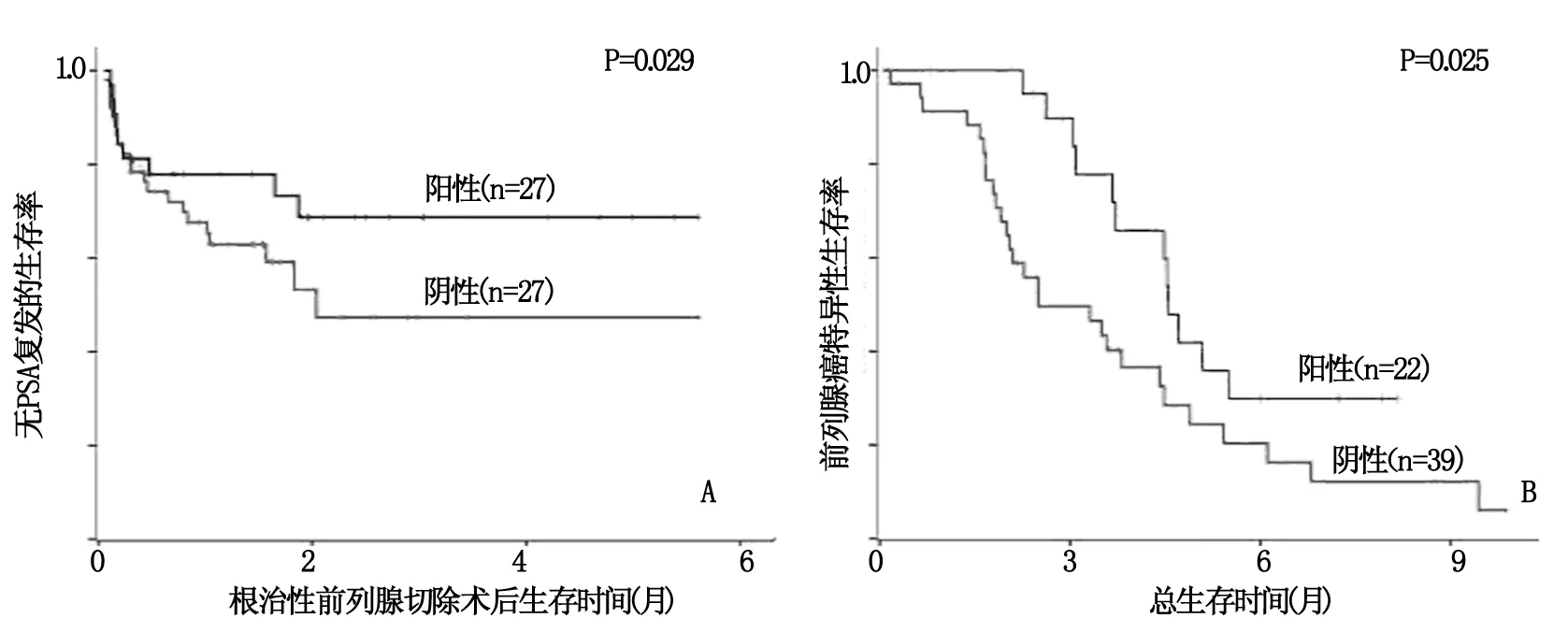
图1 Mel-18染色情况分层的Kaplan-Meier 生存曲线分析
3 讨论
前列腺癌是西方国家男性最常见的恶性肿瘤之一,居男性癌症死因的第二位。过去,我国前列腺癌发病率较低,但随着人均寿命的延长、膳食结构的改变及诊断技术的进步,其发病率在逐年提高,已跃居为男性泌尿生殖系统恶性肿瘤的第3位[8]。然而到目前为止,导致前列腺癌发生与进展的分子遗传学因素尚未完全清楚,因此,从前列腺癌的发病机理出发,在分子水平对前列腺癌的发生发展进行研究,对于前列腺癌的诊治及预防具有重要的意义。
病理学分级及临床分期对前列腺癌的预后评价存在一定的局限性。肿瘤细胞的某些基因及其表达产物在肿瘤中的发生、侵袭、转移等一系列病理过程中发挥着重要作用。癌基因激活和抑癌基因失活是各种肿瘤发生、发展的基础。抑癌基因是一类抑制细胞增殖及癌变的基因,同时也是调节生长和分化的正常基因,抑癌基因的失活会导致细胞恶性转化和肿瘤的发生。目前,对肿瘤抑制基因的研究是基因治疗肿瘤的1个研究热点。
多梳基因( polycomb group genes, PcG)家族作为核蛋白家族之一,在胚胎发育、肿瘤发生和转移中有着重要的作用[9]。Bmi-1是PcG家族中研究较多的蛋白之一,已在多种实体肿瘤中证实为原癌基因产物[10~12],Bmi-1的过度表达与前列腺癌等肿瘤发生转移及进展密切相关[13,14]。Mel-18(PcG RING finger protein 2,PCGF2),在N端区域为锌指区域,该区域与Bmi-1相应区域有93%同源性[15]。c-Myc位于染色体8q24,通过调控雄激素受体通路在前列腺癌发生、转移中发挥着作用,Bmi-1与原癌基因c-Myc有协同致癌作用。有研究表明,Mel-18通过抑制Bmi-1及c-My发挥肿瘤抑制物的作用。最近的泛基因组分析表明,8q24,17q12,及17q24.3与前列腺癌相关[16,17],Mel -18 位于染色体17q12,该区域通过基因连锁和相关性检验证实与前列腺癌风险存在相关性。最近研究表明,Mel -18是1种新的抑癌基因,有报道发现Mel -18 表达于正常乳腺组织,而在乳腺癌原代标本中低表达或不表达。Lee等认为增强乳腺癌细胞Mel -18 的表达,可降低乳腺癌细胞Akt/ PKB 的活性,通过INK4a/ARF基因抑制细胞周期进入增殖期,转录抑制原癌基因Bmi-1和c-Myc,从而发挥抵制肿瘤的作用[1~5]。
我们研究发现,前列腺癌组织中Mel-18 免疫组织化学染色分析表明,高分级的癌组织较低分级癌组织染色强度降低。阴性Mel-18的染色结果是伴生化复发或前列腺癌特异性生存的独立预测因素。研究结果证实,Mel-18与前列腺癌进展为负相关,与上述文献在其他肿瘤中的抑制作用一致,可能发挥着抑制前列腺癌进展的作用。
[1]Kanno M,Hasegawa M,Ishida A,et al.mel-18,a Polycomb group-related mammalian gene,encodes a transcriptional negative regulator with tumor suppressive activity〔J〕.EMBO J ,1995,14(22):5672.
[2]Silva J,García JM,Pea C,et al.Implication of polycomb members Bmi-1,Mel-18,and Hpc-2 in the regulation of p16INK4a,p14ARF,h-TERT,and c-Myc expression in primary breast carcinomas〔J〕.Clin Cancer Res,2006,12(23):6929.
[3]Guo WJ,Zeng MS,Yadav A,et al.Mel-18 acts as a tumor suppressor by repressing Bmi-1 expression and down-regulating Akt activity in breast cancer cells〔J〕.Cancer Res,2007,67(11):5083.
[4]Guo WJ,Datta S,Band V,et al.Mel-18,a polycomb group protein,regulates cell proliferation and senescence via transcriptional repression of Bmi-1 and c-Myc oncoproteins〔J〕.Mol Biol Cell,2007,18(2):536.
[5]Wang W,lin,TX,Huang J,et al.Analysis of Mel-18 expression in prostate cancer tissues and correlation with clinicopathologic features〔J〕.Urol Oncol,2009,Apr,21.[Epub ahead of print].
[6]Nogawa M,Yuasa T,Kimura S,et al.Intravesical administration of small interfering RNA targeting PLK-1 successfully prevents the growth of bladder cancer〔J〕.J Clin Invest,2005,115(4):978.
[7]Guo WJ,Zeng MS,Yadav A,et al.Mel-18 acts as a tumor suppressor by repressing Bmi-1 expression and down-regulating Akt activity in breast cancer cells〔J〕.Cancer Res,2007,67(11):5083.
[8]吴阶平.吴阶平泌尿外科学〔M〕.第1版.北京:山东科学技术出版社,2004:1059.
[9]Sparmann A,van Lohuizen M.Polycomb silencers control cell fate,development and cancer〔J〕.Nat Rev Cancer,2006,6(11):846.
[10]Raaphorst FM.Self-renewal of hematopoietic and leukemic stem cells:a central role for the Polycomb-group gene Bmi-1〔J〕.Trends Immunol,2003,24(10):522.
[11]Dirks P.Bmi1 and cell of origin determinants of brain tumor phenotype〔J〕.Cancer Cell,2007,12(4):295.
[12]Glinsky GV.“Stemness”genomics law governs clinical behavior of human cancer:implications for decision making in disease management〔J〕.J Clin Oncol,2008,26(17):2846.
[13]Glinsky GV,Berezovska O,Glinskii AB.Microarray analysis identifies a death-from-cancer signature predicting therapy failure in patients with multiple types of cancer〔J〕.J Clin Invest ,2005,115(6):1503.
[14]Mohty M,Yong AS,Szydlo RM,et al.The polycomb group BMI1 gene is a molecular marker for predicting prognosis of chronic myeloid leukemia〔J〕.Blood,2007,110(1):380.
[15]Goebl MG.The bmi-1 and mel-18 gene products define a new family of DNA-binding proteins involved in cell proliferation and tumorigenesis〔J〕.Cell ,1991,66(4):623.
[16]Zheng SL,Sun J,Wiklund F,et al,Bleecker ER,et al.Cumulative association of five genetic variants with prostate cancer〔J〕.N Engl J Med,2008,358(9):910.
[17]Sun J,Chang BL,Isaacs SD,et al.Cumulative effect of five genetic variants on prostate cancer risk in multiple study populations〔J〕.Prostate,2008,68(12):1257.
