酸菜中降胆固醇功能植物乳杆菌的体外筛选
2011-01-09于志会李常营张雪李盛钰李达杨贞耐
于志会, 李常营, 张雪, 李盛钰, 李达, 杨贞耐*1,
(1.吉林大学生物与农业工程学院,吉林长春 130118;2.吉林省农业科学院农产品加工研究中心,吉林长春 130033;3.吉林农业科技学院,吉林 132011)
酸菜中降胆固醇功能植物乳杆菌的体外筛选
于志会1,3, 李常营2, 张雪2, 李盛钰2, 李达2, 杨贞耐*1,2
(1.吉林大学生物与农业工程学院,吉林长春 130118;2.吉林省农业科学院农产品加工研究中心,吉林长春 130033;3.吉林农业科技学院,吉林 132011)
以分离自东北家庭自制酸菜中的9株植物乳杆菌为研究对象,采用邻苯二甲醛法筛选具有降胆固醇功能的乳杆菌,并通过耐酸、耐胆盐及抗生素敏感性实验,分析菌株的益生特性。结果表明,多株植物乳杆菌具有良好的降胆固醇功能,其中菌株S56的脱除胆固醇的量最高,达到22.40μg/m L。实验菌株均能耐受p H 3.0的酸度和10 g/L的牛胆盐。其中菌株S2-6、S2-5、S4-1和S56在p H 2.0的环境中能保持生长1 h,具有较强的耐酸性。
植物乳杆菌;胆固醇降解;体外筛选
血清胆固醇水平偏高是诱发动脉硬化、冠心病、脑中风等心脑血管疾病的主要危险因素,严重威胁着人类的健康。20世纪70年代,科学家先后通过对大量饮用酸乳等发酵乳制品的非洲Masai人血清胆固醇的研究和对常饮酸乳的美国人的调查均发现乳酸菌具有降低人体血清胆固醇的作用[1]。这些结果引起了国内外研究者的普遍关注。近年来人们对嗜酸乳杆菌降胆固醇功能进行了大量的研究工作。Danieloson等报导了由猪肠道中分离出的嗜酸乳杆菌LA 16能降低猪血清胆固醇和低密度脂蛋白[2]。Corzo和 Gilliland等研究表明嗜酸乳杆菌能分泌胆盐水解酶促进甘氨酸和牛磺酸水解,形成的游离胆酸和胆酸盐进而与胆固醇发生共沉淀作用[3];另外一些研究发现其它乳杆菌如发酵乳杆菌[4]、加氏乳杆菌[5]、双歧杆菌[6]和干酪乳杆菌[7]等也具有良好的体外降胆固醇功能。但目前关于植物乳杆菌降胆固醇的研究报道甚少[8]。
一些传统发酵食品是功能性益生菌的重要来源。为了筛选具有降低胆固醇功能的益生性乳杆菌,本研究利用体外筛选方法分析了9株分离自东北家庭自制酸菜的植物乳杆菌(L.p lantarum)的降胆固醇作用,并对其耐酸、耐胆盐、抗生素敏感性等益生特性进行研究。
1 材料与方法
1.1 供试菌株及培养基
供试菌株分离自东北家庭自制酸菜,为作者所在实验室保藏菌株。经表型、生理生化、API试验和16srDNA鉴定均为植物乳杆菌。阳性对照的益生菌株为Lactobacillus rham nosusGG(LGG),分离自市售LGG发酵乳(伊利乳业集团)。菌株在含体积分数30%甘油的MRS培养基中,-80℃冻存。使用前接种于MRS液体培养基,37℃活化2次。
培养基:M RS液体培养基和M RS固体培养基按文献方法配制[9]。MRS-Oxgall-CHOL液体培养基是在MRS液体培养基中加入已过滤除菌的水溶性胆固醇(100μg/m L)、胆盐(3 g/L)、巯基乙醇酸钠(体积分数0.2%)。
1.2 主要仪器和试剂
BCN-1360B型无菌超净工作台:哈尔滨市东联电子技术开发有限公司生产;GENbox厌氧培养系统(bioMérieux),Cary 300 UV-V IS分光光度计:美国Varian公司生产;Thermo CR3i高速冷冻离心机:美国 Thermo Fisher Scientific公司生产;氮吹仪:上海济成分析仪器有限公司生产;水溶性胆固醇、牛胆盐、巯基乙醇酸钠均购自美国Sigma公司;多种抗生素:北京鼎国生物技术有限责任公司产品。
1.3 试验方法
1.3.1 降胆固醇植物乳杆菌的体外筛选
1)活化菌株:菌液中菌的浓度为3×109CFU
/m L按体积分数3%接种量接入10 m L灭菌MRSO-Oxgall-CHOL液体培养基中,37℃厌氧培养24 h,离心(10 000 g,4 ℃,10 min),取上清。采用邻苯二甲醛法[10]测定所得上清液胆固醇的含量,以未接菌的M RSO-Oxgall-CHOL培养液作空白对照,对照液的胆固醇含量减去培养液上清胆固醇含量,即得到被测菌体去除的胆固醇量。所得OD值依据胆固醇标准曲线计算出胆固醇移除量。
1.3.2 耐酸试验 用1 mol/L盐酸调M RS液体培养基到p H值分别为2.0、3.0。菌种活化培养24 h后,按照体积分数3%的接种量加到p H值为2.0、3.0的液体M RS中,置于37 ℃培养箱厌氧培养,分别于1、2和3 h无菌取出培养菌液50μL,稀释并涂布于M RS琼脂平板中[11]。37℃厌氧培养48 h后菌落计数(以CFU/m L表示)。
1.3.3 菌株耐胆盐能力测试 试验设3、5、10 g/L 3个胆盐质量浓度,以不加胆盐的培养基为对照。活化后的乳杆菌接种于M RS液体培养基中,37℃厌氧培养24 h,按体积分数3%接种量分别接种于含不同浓度牛胆盐的M RS液体培养基中。37℃厌氧培养,分别于0 h和4 h无菌取出培养液50μL,稀释并涂布于M RS琼脂平板中。培养48 h后菌落计数。
1.3.4 药物敏感性试验 采用最小抑制浓度值法(M IC)[12]。依据各类抗生素作用机制不同,选择了抑制细菌细胞壁合成、细菌核酸合成和蛋白质合成以及抑制细胞质膜的10种常用抗生素。上述10种抗菌药物根据不同剂型和不同的溶剂进行倍比稀释 ,终质量浓度为:512、256、128、64、32、16、8、4、2、1、0.5 mg/L。M RS液体培养基添加不同浓度的抗生素,37℃厌氧培养24 h。根据生长状况观察得出菌株对每种抗生素的M IC值。根据测定的M IC值和M IC临界点值EUC(EU Commission)的统计参考值,确定菌株对各种抗生素的敏感性结果。
2 结果与分析
2.1 降胆固醇菌株的体外筛选
9株植物乳杆菌及1株商业菌(L.rham nosusGG)厌氧条件下在M RS-Oxgall-CHOL液体培养基中胆固醇的去除能力如图1所示,实验菌株均具有较好的胆固醇去除能力,去除量在14.38~22.40 μg/mL。试验菌株中除SC9胆固醇脱除量(14.38 μg/mL)略低于商业菌L.rhamnosusGG(14.84 μg/mL)以外,其余均有较强的脱除能力。其中S56的脱除胆固醇的量最高,达到22.40μg/m L。
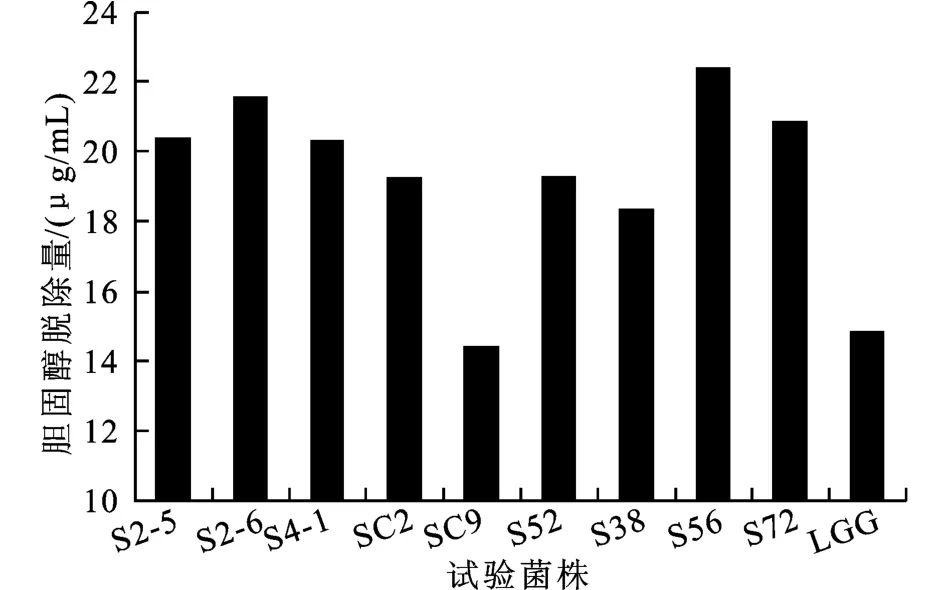
图1 乳杆菌对胆固醇的脱除能力Fig.1 Cholesterol removal ability by lactobacilli strains
2.2 耐酸性
耐酸试验结果见表1,虽然不同菌株起始活菌数不同(lg CFU/mL从7.7~8.7),但9株受试菌在p H值3.0、37 ℃条件下培养3 h后,除S38以外活菌数均超过6.7 lg CFU/m L,菌株的存活率在85%以上。这可能与其在酸菜的高酸度环境条件下长期驯化有关,从而对酸具有天然的抵抗能力。菌株S2-6、S4-1、S56和 S72的酸耐受能力与阳性对照菌L.rham nosusGG相当。菌株 S2-5、S2-6、S4-1、S56在p H值2.0,37 ℃条件下培养1 h后,活菌数分别为 5.6、5.8、6.0和 6.1 lg CFU/mL。均高出L.rham nosusGG的活菌数(4.5 lg CFU/mL),说明4株植物乳杆菌具有较强的低p H耐受性能。菌株 S38在p H 2.0,37℃条件下培养1h后,活菌数为4.0 lg CFU/m L,耐酸能力相对低一些。另外4株菌 SC2、SC9、S72、S52虽在p H值为3.0条件下具有较强的耐酸性,但均不能耐受p H值为2.0。

表1 植物乳杆菌的耐酸性能Tab.1 Acid resistance of Lactobacillus plantarum活菌数/(lg CFU/mL)
2.3 菌株耐胆盐能力测试
供试菌株在含质量浓度分别为3、5、10 g/L的牛胆盐培养基中,生长状况良好,胆盐耐受能力与阳性对照菌株L.rham nosusGG相当。如表2所示。

表2 植物乳杆菌的耐胆盐情况Tab.2 Bile tolerance of Lactobacillus plantarum活菌数/(lg CFU/m L)
试验结果表明,9株植物乳杆菌在不同程度上对高质量浓度牛胆盐(10 g/L)均有耐受性,活菌数在7.4 lg CFU/m L以上,菌株存活率在87%以上,且这些菌株均随着胆盐浓度的增加,活菌数具有不同程度的降低。与对照菌L.rham nosusGG结果一致。菌株S72在胆盐质量浓度5 g/L的条件下的活菌数比在胆盐质量浓度为 3 g/L时略高。在P.Burns、G. Vinderola等人的研究报道中,L.p lantarum08342和L.plantarum20174在胆盐质量浓度5 g/L的条件下的生长情况也略好于胆盐质量浓度为3 g/L的生长情况[13]。这表明适当的胆盐浓度(如5 g/L)可能刺激某些植物乳杆菌的生长。总之,本研究的9株植物乳杆菌均具有较强的耐胆盐能力。
2.4 抗生素敏感性试验
按照1.3.4中所述方法对供试菌株进行药物敏感性试验,根据 E-Test结果判读手册读取实验结果,见表3。
在检测的9株植物乳杆菌中,菌种不同对抗生素的最小抑制浓度也不同。所有菌株均耐受4种或4种以上的抗生素,属于多重耐药菌。尤其是对卡那霉素、万古霉素、多粘菌素B、赤霉素等4种抗生素均表现出强耐药性,最小抑制质量浓度均高于512μg/m L。所有菌株对红霉素、利福平、氯霉素、青霉素等4种抗生素敏感,这也与选择的商业菌株L.rhamnosusGG结果一致。Sw enson[14]等研究证实许多乳杆菌对糖肽类抗生素-万古霉素具有耐药性,Kattla[15]等研究证实乳杆菌对四环素和氯霉素敏感,本实验也得出了相同的实验结果。
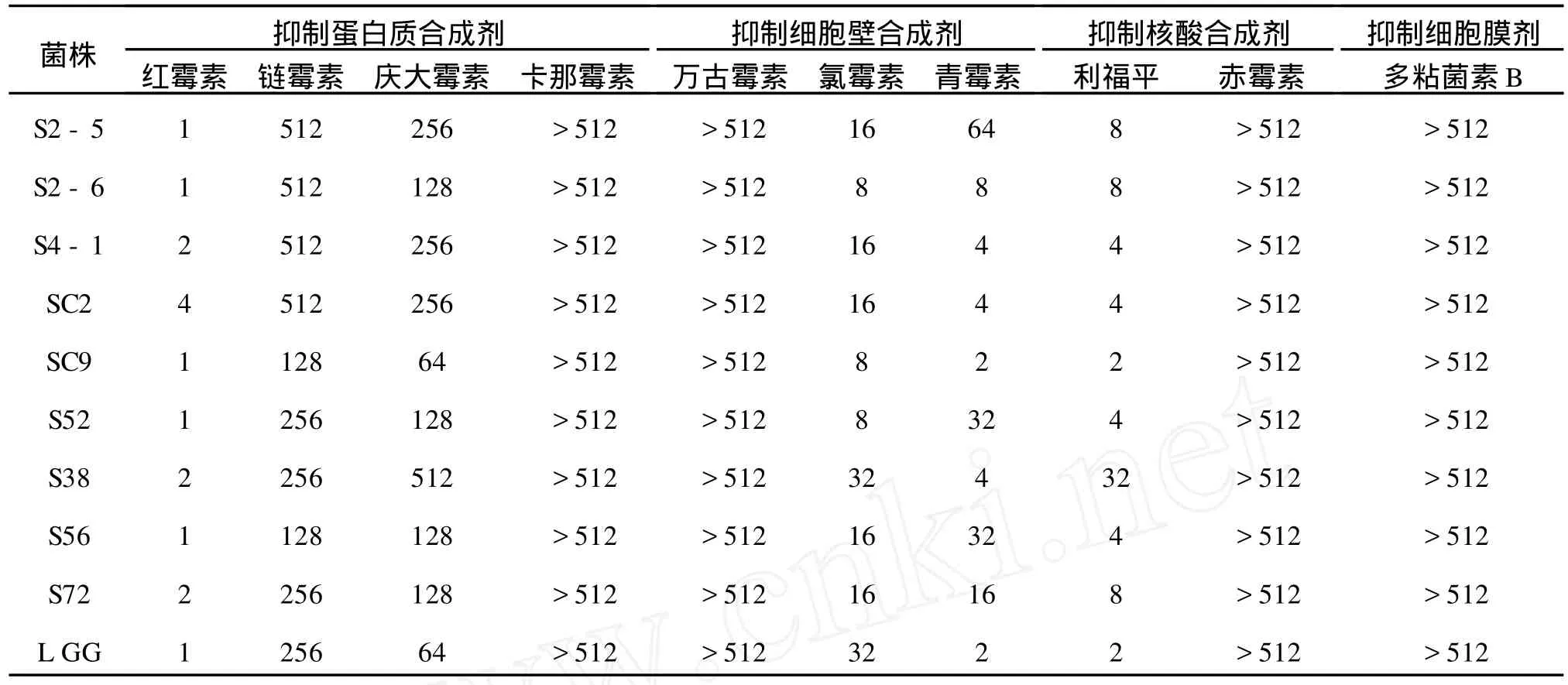
表3 实验菌株对不同抗生素的最低抑菌质量浓度(M IC)Tab.3 Strains minimum inhibitory concentration of different antibiotics(M IC) M IC/(μg/m L)
3 讨论与结语
益生菌是指通过摄取适当的量,对食用者的身体健康能发挥有效作用的活菌[16]。益生菌在激活机体的免疫系统[17]、缓解肠道炎症[18]、降低胆固醇[19]和降血压[20]等方面发挥重要作用。目前功能益生菌正受到越来越多的关注,筛选这些功能益生菌成为研究热点。尤其是一些长期食用安全的传统发酵食品,是功能性益生菌的重要来源[21]。本研究采用体外筛选方法从东北酸菜品来源的乳杆菌中筛选出多株具有降胆固醇功能植物乳杆菌,并有望为今后益生菌和功能性乳制品的研究与开发提供优良菌种。
经口进入机体的益生菌,必须能耐受上消化道的强酸和高胆盐环境,并具有良好的粘附性能及定植抗性才能发挥益生作用。因此,对于具有特定功能的降胆固醇功能的乳杆菌必须能够耐受低p H值的胃液及肠内的高胆盐环境才能发挥其功能性。Pereira等评价了一些分离自人肠道的乳杆菌和双歧杆菌的体外降胆固醇作用,同时考察了菌株对低p H值和胆盐的耐受能力[22]。T.D.T.nguyen等报道了从新生婴儿粪便中分离的植物乳杆菌p H 04在动物体内降胆固醇能力及胆盐耐受性和抗生素敏感性[23]。本研究对筛选出的9株具有较强降胆固醇功能的植物乳杆菌的耐酸及耐胆盐能力进行了分析。结果表明实验菌株均能耐受p H值为3.0的酸度和10 g/L的牛胆盐。其中菌株S2-6、S2-5、S4-1和S56在p H值为2.0的低酸环境中能保持生长1h,具有较强的耐酸性。经综合比较,S56对胆固醇的脱除及耐酸、耐胆盐能力均较高,在药物敏感性试验中对各抗生素也表现出一定敏感性。
乳酸菌确切的降胆固醇机理尚不明确,可能的降胆固醇机理包括(1)游离胆酸盐与胆固醇的共沉淀作用;(2)细菌酶对胆酸盐的去结合作用;(3)胆固醇结合到细菌细胞膜或壁上;(4)细菌对胆固醇的吸收;(5)共沉淀和吸收作用同时发生。本研究经体外筛选获得了4株具有较强的耐酸、耐胆盐和降胆固醇等特性的植物乳杆菌,后续研究有必要将其应用于动物体内检测其对血清等胆固醇的影响情况,并进一步分析其降胆固醇的机制。
(References):
[1]Manson JE,Tostesonh,Ridker PM,et.al.The primary prevention of myocardial infarction[J].New Engl JMed,1992,326:1406-1416.
[2]Danielson A D,E R Peo,Jr K M Shahani,et al.Anticholesterolemic property ofLactobacillus acidophilusyogurt fed to mature boars[J].An im.Sci,1989,67:966-974.
[3]Corzo G,S E Gilliland,L M Buck.Measurement of bile salt hydrolase activity from Lactobacillus acidophilus based on disappearance of conjugated of bile salts[J].J.Dairy Sci,1999,82:466-471.
[4]Brashears M M,Gilliland,L M Buck.Bile salt deconjugation and cholesterol removal from media by Lactobacillus casei[J].J.Dairy Sci,1998,81:2103-2110.
[5]Usman H A.Bile tolerance,taurocholate deconjugation,and binding of cholesterol byLactobacillus gasseristrains[J].J.Dairy Sci,1999,82:243-248.
[6]Dora IA Pereira,Glenn R Gibson.Cholesterol assimilation by lactic acid bacteria andB ifidobacteriaisolated from the human gut[J].Applied and Environmental M icrobiology,2002,4689-4693.
[7]M T Liong,N P Shah.Acid and bile tolerance and cholesterol removal ability ofLactobacilli strains[J].J.Dairy Sci,2005,88:55-66.
[8]M in Zhang,xiaomin Hang,Xiaobing Fan.Characterization and selection ofLactobacillus strainsfor their effect on bile tolerance,taurocholate deconjugation and cholesterol removal[J].World JM icrobiol Biotechnol,2008,24:7-14.
[9]De Man JC,Rogosa M,Sharpe M E.A medium for the cultivation of lactobacilli[J].J.Appl.Bacteriol.,1960,23:130-135.
[10]Gilliland SE,Nelson CR,Maxwell C.A ssimilation of cholesterol byLactobacillus acidophilus[J].Applied and Environmental Microbiology,1985,49(2):377-381.
[11]Claire,L Vernazza,Glenn R.et al.Carbohydrate.Acid tolerance and bile tolerance in five strains ofB ifidobacterium[J].Journal of Applied Microbiology,2006,100:846-853.
[12]W PCharteris,PM Klly,L Morelli,et al.Antibiotic susceptibility of potentially probiotic Bifidobacterium isolates from the human gastrointestinal tract[J].Applied Microbiology,1998,26:333-337.
[13]Burns P,Vinderola G.Bile-resistant derivatives obtained from nonintestinal dairylactobacilli[J].International Dairy Journal,2008,18:377-385.
[14]Swenson JM,Facklam R R,Tho rnsberry C.Antimicrobial susceptibility of vancomycin resistantLeuconostoc,PediococcusandLactobacillusspecies[J].Antimicrobial Agents and Chemotherapy,1990,34:543-547.
[15]Kattla A K,Kruse H Johnsen G,Herikstad H.Antimicrobial susceptibility of starter culture bacteria used in Norwegian dairy products[J].International Journal of Food Microbiology,2001,67:147-152.
[16]Haenel H,Bendig J.Intestinal flora in health and disease[J].Progr.Food Nutr.Sci.1,1975,21-64.
[17]Cunningham-Rundles S,Ahrne S,Bengmark S,et.al.Probiotic and immune response[J].The American Journal of Gastroenterology,2000,95(1):S22-S25.
[18]Isolauri E,Kirjavainen P V,Salminen S.Probiotics:a role in the treatment of intestinal infection and inflammation[J].Gut.50.suppl,2002,3:11154-9.
[19]Do ra IA,Pereira,Glenn R.Gibson.Cholesterol assimilation bylactic acid bacteriaandbifidobacteriaisolated from the human gut[J].Appl.Environ.Microbio,2002,9:4689-4693.
[20]Hata Y,Yamamoto M,Ohni M,et al.A placebo-controlled study of the effect of sourmilk on blood pressure in hypertensive subjects[J].Am.J.Clin.Nutr,1996,64:767-771.
[21]居华,刘书亮,敖灵,王燚.降胆固醇乳酸菌的筛选、鉴定及生长特性[J].中国乳品工业,2007,35(8):007-011.
JU Hua,LIU Shu-liang,AO Ling,et al.Study on characteristics of grow th,screening and identification of cholesterol-reducing Lactic acid bacteria[J].China dairy industry,2007,35(8):007-011.(in Chinese)
[22]Perira D IA,G R Gibson.Cholesterol assimilation by lactic acid bacteria and bifidobacteria isolated from the human gut[J].Appl.environ.Microbiol,2002,68:4689-4693.
[23]T D T Nguyen,J H Kang,M S Lee.Charaterization ofLactobacillus plantarumPh04,a potential probiotic bacterium with cholesterol-lowering effects[J].Inter Journal of Food M icrobiology,2007,113:358-361.
In Vitro Cholesterol-Lowering Activity of Potential Probiotic Lactobacillus Plantarum Isolated from Chinese Sauerkraut
YU Zhi-hui1.3, LI Chang-ying2, ZHANG Xue2, L ISheng-yu2, LI Da2, YANG Zhen-nai*1,2
(1.College of Biological and Agricultural Engineering,Jilin University,Changchun 130118,China;2.Center of Agro-Food Technology,Jilin Academy of Agricultural Sciences,Changchun 130033,China;3.Jilin Agriculture Science and Technology College,Jilin,132011,China)
NineLactobacillus plantarumstrains were isolated from the Northeast homemade sauerkraut and exhibited high cholestero l-lowering ability.By acid and bile tolerance and antimicrobial susceptibility testing,these strains were studied for their potenticl probiotic.The results showed good cholesterol-lowering ability with S56 giving the highest of cholesterol removal at 22.40μg/mL.A ll the strains could tolerate pH 3.0 and 10 g/L of bovine bile salt.Strains S2-6,S2-5,S4-1 and S56 maintained the grow th for 1h at pH 2.0.
L actobacillus plantarum,cholesterol lowering,in vitro screening
TQ 920.1
A
1673-1689(2011)03-0398-05
2010-05-22
国家自然科学基金项目(No.30670057)。
于志会(1979-),女,吉林农安人,博士研究生,讲师,主要从事生物资源保护与利用研究。
Email:yzh_jilin@163.com
*
杨贞耐(1965-),男,江西广丰人,工学博士,研究员,主要从事乳品工艺与生物技术研究。Email:zyang@cjaas.com
