甲基肼水溶液的脉冲辐解研究
2011-01-09叶国安付海英吴国忠
陈 辉,何 辉,叶国安,付海英,吴国忠
1.中国原子能科学研究院,北京 102413;
2.中国科学院上海应用物理研究所,上海 201800
甲基肼水溶液的脉冲辐解研究
陈 辉1,何 辉1,叶国安1,付海英2,吴国忠2
1.中国原子能科学研究院,北京 102413;
2.中国科学院上海应用物理研究所,上海 201800
利用脉冲电子束进行甲基肼水溶液的脉冲辐解研究,对其瞬态光谱中的主要吸收峰作了归属,并初步考察了这些瞬态物种的生长、衰减等行为。结果表明,·OH与甲基肼反应生成CH3·NNH2,速率常数为(2.4±0.1)×1010mol-1·L·s-1;e-aq与甲基肼反应生成CH3·NHNH2自由基,速率常数为(2.7±0.2)×108mol-1·L·s-1。
甲基肼;脉冲辐解;瞬态吸收光谱;自由基
甲基肼作为一种新型的支持还原剂在后处理工艺中有着很大的应用前景[1-3]。在后处理工艺流程中,由于硝酸的辐射分解等原因,1B、2B萃取器中存在一定量的亚硝酸,由于它对还原反萃剂有严重的破坏作用,并且对Pu(Ⅲ)氧化为Pu(Ⅳ)起催化氧化作用,从而影响Pu的反萃。为抑制亚硝酸的破坏作用,需向体系中加入支持还原剂,确保在Pu(Ⅳ)还原反应发生之前将体系中存在的亚硝酸破坏掉[4]。甲基肼破坏亚硝酸的速度快,反应不会产生有爆炸危险性的叠氮酸,且不引入盐分,是一种较有应用前景的支持还原剂[4-5]。
在乏燃料处理过程中,甲基肼在辐照和化学作用下会发生辐射降解等反应,这将引起甲基肼有效浓度的降低,会严重影响流程中1B/2B铀钚分离工艺和钚纯化工艺的正常运行。因此甲基肼的辐照稳定性就成为决定其是否可用的重要因素。已有研究[6]结果表明,在γ辐照场下,甲基肼生成的主要产物为CH4、NH3、CH3NH2、CH3OH等。
已有文献报道关于肼的脉冲辐解研究。William等[7]对无水肼脉冲辐解生成的溶剂化电子进行研究,得到无水肼脉冲辐照后的瞬态吸收光谱。结果表明,室温下溶剂化电子在1 015nm处有最大吸收,摩尔吸光系数ε=(2.2±0.1)×104mol-1·L·cm-1。Hayon等[8]利用脉冲辐解技术,对不同条件下与肼类化合物的单电子反应进行研究。结果表明,与肼类化合物的反应速率与该化合物的质子化形式以及pK值有关。随着pK值的减小,反应速率常数增大;e-aq与质子化的肼类化合物的反应速率大于其与未质子化的肼类化合物的反应速率。·OH与几种肼类化合物的反应速率差异并不明显,对于同一肼类物质而言,未质子化形式与·OH反应的速率常数约为质子化形式与·OH反应速率常数的10~20倍。
本工作拟采用脉冲辐解技术,开展水辐解产生的初级活性粒子e-aq、·OH与肼的一取代衍生物单甲基肼(MMH)反应动力学研究,从而了解单甲基肼水溶液辐解反应的瞬态产物,并推断合理的微观机理。
1 实验部分
1.1 实验试剂
甲基肼,纯度大于99%,航天工业公司;特丁醇,分析纯,上海菲达工贸有限公司。配制溶液所用水为三次重蒸水。N2和N2O气体为纯度大于99.99%的高纯气体,上海春雨特种气体有限公司。
1.2 实验装置
本实验采用中国科学院上海应用物理研究所的纳秒级脉冲辐解装置。直线电子加速器能量为10MeV,脉冲宽度为8ns,单脉冲辐射剂量为10~50Gy连续可调,时间分辨吸收光谱系统采用500W氙灯为分析光源(其强度在测量期间加亮100倍),分析光与电子束成垂直方向透过光程为20mm的石英样品池,经44W的单色仪分光,为IP28光电倍增管检测,经反馈补偿后由HP54510B数字示波器转换成数字信号,并记录存储于计算机中,以自编软件进行动力学数据处理[9-12]。用 N2O 饱和的0.01mol/L KSCN 水溶液[8]作为脉冲电子剂量计,在480nm处取摩尔消光系数ε[(SCN)-2]为7 600mol-1·L·cm-1,选用的单脉冲电子剂量为10Gy。
1.3 实验方法
1.3.1 水合电子与甲基肼的反应 配制一定浓度的甲基肼水溶液,加入一定量的特丁醇,通N2气饱和20min,以除去空气中的溶解氧,进行脉冲辐解实验。经电子束脉冲辐解后,水辐解产生的氢自由基的量子产额可忽略不计[14],羟基自由基被特丁醇清除(如式(2)所示)生成几乎无反应活性的特丁醇抽氢自由基。因此,体系中参与反应的初级活性粒子只剩下水合电子(如式(3)所示)。相对于电子脉冲所产生的活性自由基而言,溶质甲基肼的浓度很高,在微观反应过程中可将甲基肼的浓度视为恒定。因此,选取e-aq最大吸收波长处的吸收强度随时间变化的衰减曲线,对其加以拟合处理,得出反应级数及其表观速率常数。改变甲基肼的浓度,用测得的表观速率常数对浓度作图,即可得到甲基肼与反应的速率常数。
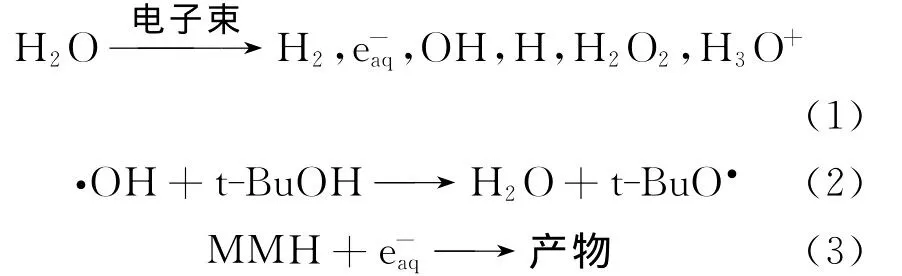
1.3.2 羟基自由基与甲基肼的反应 用超纯水配制一定浓度甲基肼的水溶液,通N2O气体饱和20min以去除空气。H原子能通过与N2O发生反应(如式(4)所示)转化成·OH自由基,而N2O可通过式(5)将去除[13],因此体系中参与反应的主要活性粒子是·OH自由基。·OH的吸收光谱在紫外区域[15],直接用时间分辨吸收监测·OH衰减的变化来测定速率常数也很困难。因此研究·OH动力学通常采用监测出现强吸收的反应产物的吸收变化,最典型的是采用竞争反应动力学技术[10]。由于·OH与SCN-反应产物的吸收在实验条件容易观察到的光谱区很强,因此SCN-被广泛用作研究·OH反应竞争动力学的参照反应物(竞争剂)。经N2O饱和的体系中,KSCN与羟基自由基发生反应,如式(6)~(8)所示[7,16]:
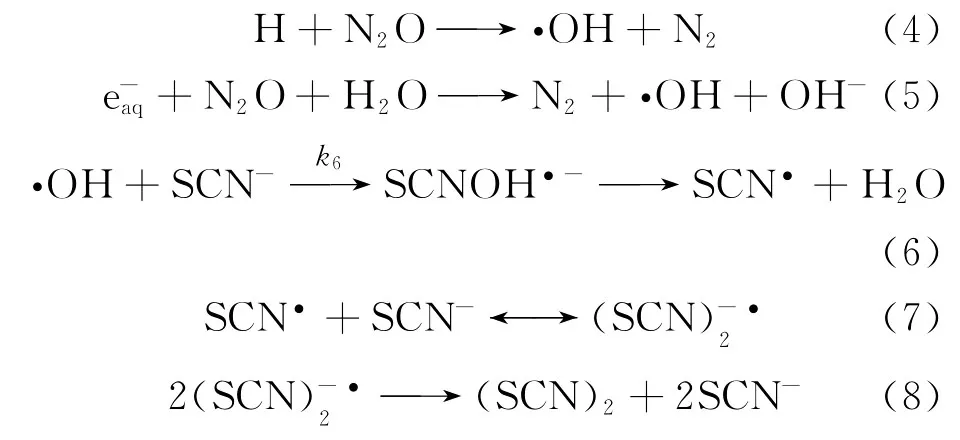

竞争反应存在如式(10)所示方程:
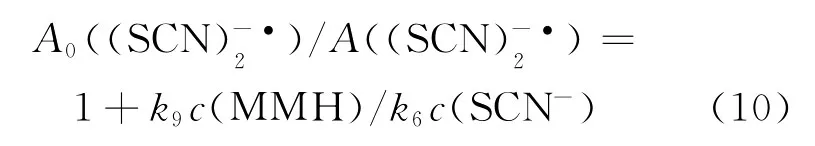
其中,A0,无MMH时瞬态吸收光谱中的最大吸收强度;A,加入MMH后瞬态吸收光谱中的最大吸收强度。监测不同MMH浓度下的瞬态吸收光谱,以A0/A-1对c(MMH)/c(SCN-)作图得到一条直线,利用该直线的斜率及k6=1.1×1010mol-1·L·s-1[10-11]即可得到 MMH 与·OH反应的速率常数k9。
2 结果与讨论
2.1 水合电子与甲基肼的反应
2.1.1 吸收光谱 配制5mmol/L MMH 的水溶液,加入重蒸馏的特丁醇使之最终的浓度为0.1mol/L,通 N2气饱和20min,以除去空气中的溶解氧,进行脉冲辐解实验,可得到电子脉冲不同时间后吸光率与波长的关系曲线,如图1所示。由图1可以看出,甲基肼溶液在经电子束辐照后10ns在310nm处出现吸收峰,720nm处出现另一吸收峰。720nm处的吸收在电子脉冲期间迅速生成,又迅速衰减,其衰减曲线符合一级反应动力学规律,是水合电子的特征吸收峰[11]。该体系中只有活性粒子e-aq参与反应,因此310nm处的吸收峰可归结为溶质甲基肼与水合电子反应生成的中间产物的贡献。同样条件下加入特丁醇,用N2O气体代替N2,经电子束辐解后则得不到任何吸收峰,也证实了以上吸收峰归属的正确性。此外,由图1可知,水合电子在720nm处吸收的衰减和中间产物在310nm处吸收的生成几乎同步。
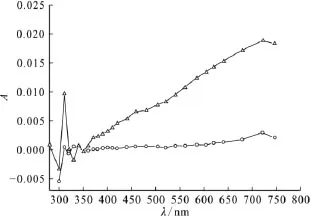
图1 N2饱和的MMH溶液脉冲辐解光谱图Fig.1 Pulse radiolysis spectra of MMH solution saturated with N2
2.1.2 反应动力学 720nm处e-aq的吸收随时间的变化曲线如图2所示,根据其衰减部分做反应级数拟合。由于体系中所产生的水合电子浓度远远低于溶质 MMH,因此,水合电子与 MMH的反应可近似看作是准一级反应,拟合结果见图3,直线斜率即为水合电子的表观衰减速率常数。改变甲基肼的浓度,可得到一系列水合电子表观衰减速率常数,用表观速率常数kapp对甲基肼浓度作图示于图4,直线斜率即为MMH与水合电子的绝对反应速率常数,其值为(2.7±0.2)×108mol-1·L·s-1。

图2 720nm处瞬态物种的生成-衰减Fig.2 Build-up/decay trends of transient species at 720nm
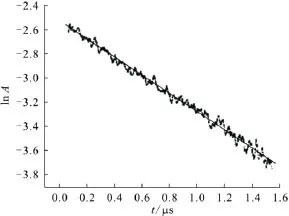
图3 e与MMH反应的准一级拟合效果Fig.3 Quasi-first-order reaction fit result of ewith MMH

图4 e与MMH反应产物的表观速率常数同MMH浓度的关系Fig.4 Dependence of kapp on the concentration of MMH
2.2 羟基自由基与甲基肼的反应
2.2.1 吸收光谱 配制不同浓度 MMH-0.2mmol/L KSCN的水溶液,通N2O气体饱和20min以去除空气,经电子脉冲辐照后得到瞬态吸收光谱图示于图5。由图5可以看出,当KSCN水溶液中加入一定量MMH后,由于MMH与KSCN竞争与·OH自由基发生反应,因此在480nm处的最大吸收强度减弱。
2.2.2 反应动力学 监测不同MMH浓度下的瞬态吸收光谱,以A0/A-1对c(MMH)/c(SCN-)作图得到一条直线(图6),利用该直线的斜率及k6即可得到 MMH与·OH反应的速率常数k9=(2.4±0.1)×1010mol-1·L·s-1。
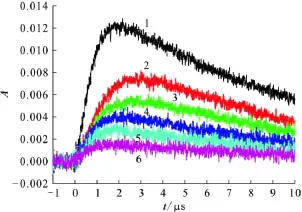
图5 480nm处瞬态物种的生成-衰减Fig.5 Build-up/decay trends of transient species at 480nm
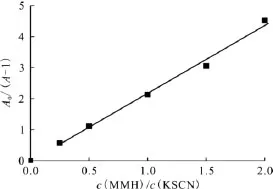
图6 与羟基自由基反应的表观速率常数与SCN-浓度的关系Fig.6 Competition kinetics plot for rate constant determination of hydroxyl radical reaction with MMH
2.3 反应机理
2.3.1 水合电子与甲基肼的反应 甲基肼分子中,由于CH3NH—基团的电负性比—NH2基团的电负性小[11],成键电子云偏向电负性大的—NH2基团一边,从而使得电子云密度高的—NH2基团稍带有负电性,电子云密度低的CH3NH—基团稍带有正电性。当e-aq与甲基肼发生反应时,必向电子云密度低的CH3NH—基团中的N进行攻击。因此,式(3)可以表示为:
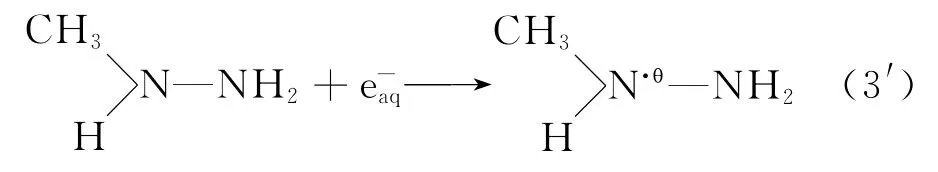
对于肼及其甲基取代衍生物与水合电子反应已有报道[7,16],表1给出肼及其衍生物与反应的速率常数。由表1可知,与肼类化合物的反应速率与该化合物的质子化形式以及pK值有关。随着pK值的减小,反应速率常数增大;e与质子化的肼类化合物的反应速率大于其与未质子化的肼类化合物的反应速率。本研究结果不能归入已有研究的规律中,有待进一步研究。
表1 e与MMH反应的速率常数Table 1 Rate constants of reaction of ewithhydrazines in aqueous solution

表1 e与MMH反应的速率常数Table 1 Rate constants of reaction of ewithhydrazines in aqueous solution
注(Note):1)文献中速率常数误差为±15%(Error in rate constants is±15%);2)本工作(This work)
H2NNH2 8.07 2.2×108(pH=6.0)2.3×106(pH=10.5)CH3HNNH2 7.87 1.4×109(pH=5.5)6.5×106(pH=12.0)2.7×108(pH=11.0)2)CH3HNNHCH3 7.52 2.3×109(pH=5.6)6.1×106(pH=12.4)(CH3)2NNH2 7.21 5.8×109(pH=5.6)2.4×107(pH=12.0)(CH3)2NNHCH3 6.56 1.3×1010(pH=5.4)~108(pH=10.4)
2.3.2 甲基肼与羟基自由基的反应 羟基自由基与甲基肼的反应中,OH·可能在CH33N1HN2H2分子中的位置1、2和3处进行抽氢反应。采用基态 Hartree-Fock 方 法 和 3-21+ 基 组,利 用GAUSS03对抽氢产物的UHF自由能进行计算,结果列入表2。UHF自由能越小,该反应越易发生。由表2可知,在与·OH发生抽氢反应时,MMH主要在位置1上失去H,式(5)中瞬态中间产物P为CH3N·NH2自由基。表3给出肼及其衍生物与·OH自由基的反应速率常数。·OH自由基与几种肼类化合物的反应速率差异并不明显。由于·OH自由基的亲电性,使得未质子化形式的肼类物质与·OH自由基反应的速率常数约为质子化形式与·OH自由基反应速率常数的10~20倍。当H2NNH2中的与N相连的H原子被斥电子基团—CH3取代时,有利于抽氢反应的进行,因此·OH自由基与肼反应的速率常数小于·OH自由基与肼的甲基取代物反应的速率常数。由于存在空间位阻效应,使得单甲基肼比肼的二甲基取代物更易于与·OH自由基发生抽氢反应,因此k(CH3HNNH2+·OH)>k(CH3HNNHCH3+·OH)、k((CH3)2NNH2+·OH)。
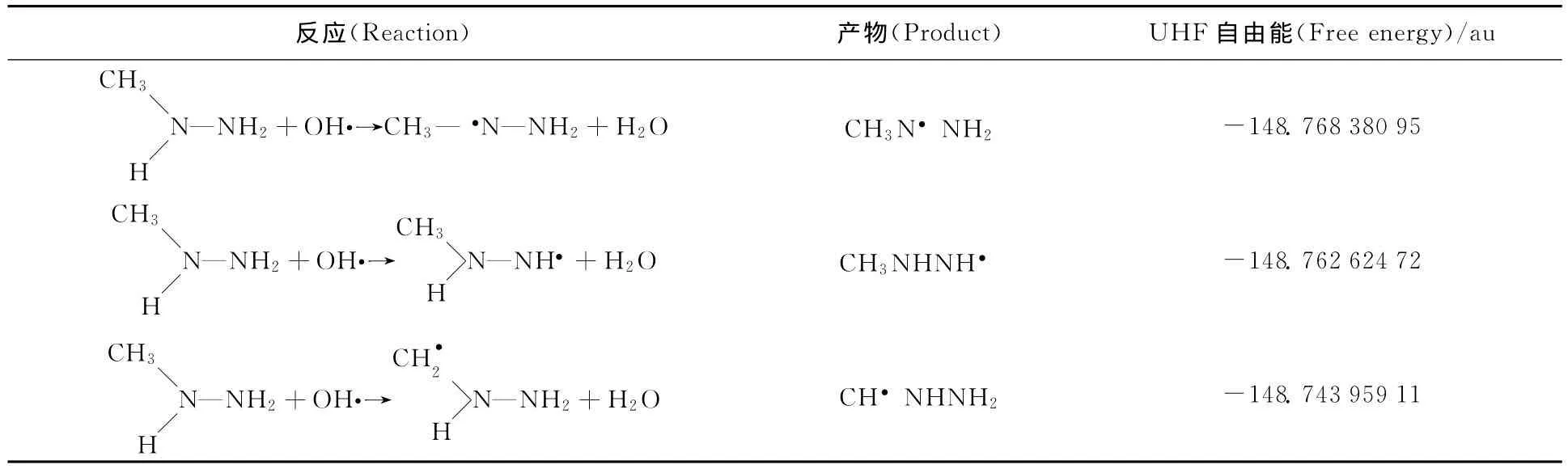
表2 抽氢产物的UHF自由能Table 2 UHF free energy of the hydrogen abstraction products

表3 羟基自由基与MMH反应的速率常数Table 3 Rate of reaction of·OH with hydrazines in aqueous solution
3 结 论
采用脉冲辐解技术,并用竞争反应动力学方法对甲基肼与水辐解初级活性粒子和·OH的反应动力学进行研究。得到甲基肼与反应的速率常数为(2.7±0.2)×108mol-1·L·s-1,与·OH反应的速率常数为(2.4±0.1)×1010mol-1·L·s-1。结果表明,MMH能迅速与水合电子、羟基自由基发生反应;MMH与水合电子的反应速率远远大于其与羟基自由基的反应速率。
[1]张先业,叶国安,肖松涛,等.单甲基肼还原Np(Ⅵ)Ⅰ.反应动力学研究[J].原子能科学技术,1997,31(3):193-198.
[2]张先业,叶国安,肖松涛,等.单甲基肼还原Np(Ⅵ)Ⅱ.Purex流程中 U-Np分离的研究[J].原子能科学技术,1997,31(4):315-319.
[3]叶国安.Purex流程中有机无盐试剂的应用分析[J].原子能科学技术,2004,38(2):152-158.
[4]吴华武,崔秉懿.核燃料化学工艺学[M].北京:原子能出版社,1989:230-231.
[5]魏 艳.硝酸介质中单甲基肼与亚硝酸的反应及七价锝与无盐试剂的反应动力学研究[D].中国原子能科学研究院,2006:27-39.
[6]许 零.核燃料后处理工艺中几种无盐试剂及络合剂的辐解研究[D].中国原子能科学研究院,2001:9-19.
[7]William Arthur Seddon,Fletcher John Wallace,Fred Charles Sopchyshyn.Pulse Radiolytic Formation of Solvated Electrons in Hydrazine[J].Can J Chem,1976,54:2 807-2 812.
[8]Hayon E,Simic M.Intermediates Produced From the One-Electron Oxidation of Hydrazine.Evidence for the Formation and Decay of Tetrazane and Triazene[J].J Am Chem Soc,1972,94(1):42-47.
[9]Wang S L,Wang M,Sun X Y,et al.Study on the Chemical Activity of Nicotine by Pulse Radiolysis[J].Spectrosc Spectral Anal,2003,23(3):481.
[10]Yao S D,Sheng S G,Cai J H,et al.Nanosecond Pulse Radiolysis Studies in China[J].Radiat Phys Chem,1995,46(1):105.
[11]Jou F Y,Freeman G R.Shapes of Optical Spectra of Solvated Electrons.Effect of Pressure[J].J Phys Chem,1977,81:909-915.
[12]杨 频.分子结构参量及其与物性关联规律[M].北京:科学出版社,2007:310.
[13]Spinks J W T,Woods R J.Introduction to Radiation Chemistry[M].3rd Ed.New York:Wiley,1990.
[14]Swallow A J.Application of Pulse Radiolysis to the Study of Aqueous Organic Systems.In:The Study of Fast Processes and Transient Species by Electron Pulse Radiolysis[R].Dordrecht Reidel Publ Co.,1982:241-266.
[15]Asmus K D.Sulfur-Centered Free Radicals.In:Nygaard O F,Simic M G,eds.Radioprotectors and Antcarcinogens[M].New York:Academic,1983:23-42.
[16]James W Sutherland.Pulse Radiolysis of Aqueous Hydrazine Solutions.The Triazene Species[J].J Phys Chem,1979,83(7):789-795.
Pulse Radiolysis of Aqueous Methylhydrazine Solutions
CHEN Hui1,HE Hui1,YE Guo-an1,FU Hai-ying2,WU Guo-zhong2
1.Institute of Radiochemistry,China Institute of Atomic Energy,Beijing 102413,China;
2.Shanghai Institute of Applied Physics,Chinese Academy of Sciences,Shanghai 201800,China
Pulse radiolysis of aqueous methylhydrazine solutions under different conditions was studied.The main characteristic peaks in these transient absorption spectra were attributed and the build-up/decay trends of several transient species were investigated.The reaction product of·OH radical and methylhydrazine is CH3·NNH2radical with a rate constant of(2.4±0.1)×1010mol-1·L·s-1.The reaction product of e-aqand methylhydrazine is CH3·NHNH2radical with a rate constant of(2.7±0.2)×108mol-1·L·s-1.
methylhydrazine;pulse radiolysis;transient absorption spectrum;free radical
TL24
A
0253-9950(2011)05-274-06
2010-08-16;
2011-03-07
陈 辉(1978—),女,吉林省吉林市人,博士研究生,核燃料循环与材料专业
