Purex流程中二甲基羟胺与甲基肼的分析
2011-01-09李传博刘金平晏太红郑卫芳
李传博,刘金平,晏太红,张 宇,郑卫芳
中国原子能科学研究院 放射化学研究所,北京 102413
Purex流程中二甲基羟胺与甲基肼的分析
李传博,刘金平,晏太红,张 宇,郑卫芳
中国原子能科学研究院 放射化学研究所,北京 102413
研究了在测定1BP中的N,N-二甲基羟胺(DMHAN)和甲基肼(MMH)的浓度之前用TODGA将其中的Pu(Ⅲ)萃取出来;并基于所发现的在室温下pH为2.0~5.5时,Fe3+只与DMHAN反应而不与稀的MMH发生反应;以及在室温下pH为0~5.5时,稀的I2溶液只与MMH发生反应而不与稀的DMHAN反应;分别建立了用Fe3+/邻菲罗琳-分光光度法测定1BP萃余液中DMHAN的浓度,相对偏差小于1.0%,检测下限为3.00×10-6mol/L;用I2溶液褪色-分光光度法测定了其中的 MMH的浓度,相对偏差小于1.0%,检测下限为3.00×10-5mol/L。并考察了反应时间、甲醇、甲醛和酸度等对结果的影响。该方法不仅适用于测定1BP中DMHAN和MMH的浓度,也适用于1BX、2BX和2BP中。
二甲基羟胺;甲基肼;分光光度法;Purex流程
现今Purex流程向着减少液体体积、简化流程的方向发展。新型无盐试剂的研究成为改善流程的一个重要方向[1]。中国原子能科学研究院对N,N-二甲基羟胺进行了深入的研究,并开发了基于N,N-二甲基羟胺(DMHAN)和甲基肼(MMH)还原体系的先进二循环流程[2]。所以,该流程中DMHAN和MMH浓度的分析显得格外重要。
其中1BX、2BX中因只含有 HNO3、DMHAN和MMH,DMHAN和MMH的分析均已有成熟的分析方法[3-5]。1BP和2BP不仅含有 HNO3及剩余的DMHAN和MMH,还含有DMHAN与Pu(Ⅳ)和MMH与亚硝酸的氧化还原产物,以及DMHAN及MMH的γ辐解产物,如Pu(Ⅲ)、甲醇、甲醛、乙醇、甲酸、甲胺和二甲胺等。因为1BP、2BP中含有的醇类、醛类和胺类的影响和干扰使得用于分析1BX、2BX中DMHAN和MMH的方法已不能使用。
在分析DMHAN和MMH浓度时,为尽量减少样品的取样体积和分析时造成的Pu的流失,本实验考察了在分析前用TODGA将1BP、2BP中的Pu(Ⅲ)萃取出来;并拟分别建立邻菲罗琳显色-分光光度法测定DMHAN的浓度,褪色-分光光度法测定MMH的浓度,同时考察反应时间、pH值、甲醇和甲醛等对测定结果的影响。
1 加标回收率方法原理
采用加标回收率法对本实验所建立的分析方法的准确度进行检测。加标回收率方法原理为:取两份相同的样品,向其中的一份中加入定量的待测成分的标准物质。将两份样品按相同的分析条件和步骤进行处理、分析。将加入标准物质样品的分析值减去未加入标准物质样品的分析值,其差值同所加入标准物质的实际值之比即为样品加标回收率(Y)。即:加标回收率=(加标试样测定值-未加标试样测定值)÷加入的标准物质量×100%
2 实验部分
2.1 仪器与试剂
UV-λ20型分光光度计,美国PE公司;T50酸碱滴定仪,瑞士 METTLER-TOLEDO公司;单道α计数器,北京核分析仪器厂。
N,N,N,N-四辛基-3-氧-戊二酰胺(TODGA)、硝酸钚溶液和二甲基羟胺(纯度大于98%),中国原子能科学研究院放化所生产;单甲基肼,航天三院生产。其余试剂均为分析纯,国药集团生产。
向250mL容量瓶中加入0.511 2g邻菲啰林、0.45mL 11.10mol/L的盐酸和0.499 5g硫酸高铁铵,用水稀释至刻度,摇匀,作为显色剂。
配置0.05mol/L的邻苯二甲酸氢钾溶液,加入少量NaOH溶液调剂至pH=5.0,作为缓冲溶液。
2.2 实验方法
2.2.1 Fe3+氧化还原-分光光度法测定 DMHAN浓度的标准曲线 分别向8个10mL的容量瓶中加入2.00mL的缓冲溶液,1.20mL的显色剂;并分别加入0、100、150、200、250、300、350、400μL浓度为3.89×10-4mol/L的DMHAN标准溶液。用水稀释至刻度,置于25℃水浴中加热40min;以未加DMHAN标准溶液的空白样为参比,测各组样品在510nm处的吸光度。绘制标准曲线。
2.2.2 I2氧化还原褪色-分光光度法测MMH浓度的标准曲线 分别向7个5.00mL的容量瓶中加入 0.50mL 0.50mol/L HNO3和250μL 4.13×10-2mol/L的I2稀溶液;并分别加入0、50、150、250、350、400、500μL浓度为2.01×10-3mol/L MMH的标准溶液。用水稀释至标准刻度,置于20℃水浴中保持40min;以去离子水为参比,测量上述样品中未加入MMH标准溶液的I2稀溶液(黄色)在可见光波长范围内的吸光度值。以吸光度值为1.00(吸光度值在0.2~0.8之间时测量相对误差较小)时所对应的波长为分析测量波长,以去离子水为参比,测量各样品在波长λ处的吸光度值。做吸光度随MMH浓度变化的标准曲线。
2.2.3 影响和干扰实验 取一定体积的3.89×10-4mol/L DMHAN的标准溶液,与2.2.1节实验条件一致,分别考察反应时间、pH值、加入MMH、加入甲醇和甲醛等对上述实验的影响和干扰。取一定体积的2.01×10-3mol/L MMH的标准溶液,与2.2.2节实验条件一致,分别考察反应时间、pH值、加入DMHAN、加入甲醇和甲醛等对上述实验的影响和干扰。
2.2.4 1BP或2BP料液中Pu(Ⅲ)的萃取 取200.00μL的1BP样品,加入1.00mL 0.20mol/L的TODGA-十二烷溶液,充分混合、震荡5min;重复萃取2次,分相。取下层水相50.00μL制样,测其α计数;平行2次。
3 结果与讨论
3.1 TODGA-十二烷溶液对Pu(Ⅲ)的萃取
将中国原子能科学研究院放射化学研究所Purex流程台架温实验1BP样品编号为1BP01—1BP10,其中Pu3+的质量浓度为3.9g/L。将1BP01用1.00mL 0.20mol/L 的 TODGA-十二烷溶液萃取2次,取下层水相50.00μL制样,测其60s的α计数,平行2次;与原始水相的α放射性测定值比较,计算出萃取率为99.994%,水相中绝大多数的Pu3+已被萃取。
3.2 Fe3+氧化还原-分光光度法测定DMHAN浓度
3.2.1 标准曲线的绘制 根据2.2.1节实验条件所测,当DMHAN浓度为3.00×10-6~1.90×10-5mol/L时,DMHAN的浓度与吸光度呈现良好的线性关系,标准曲线方程为:y=0.044 68x-0.030 51,r2=0.999 7,如图1所示。
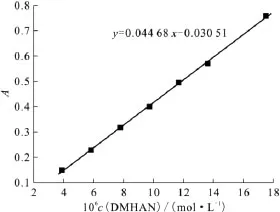
图1 用Fe3+/邻菲罗林分光光度法测定DMHAN的标准曲线Fig.1 Calibration curve for spectrophotometric determination of DMHAN with Fe3+/1,10-phenanthroline
3.2.2 影响和干扰实验
(1)反应时间的影响
与2.2.1节实验条件一致,当反应时间大于25min时,DMHAN与Fe3+氧化还原反应速率开始变缓,A以0.002/min的速率递增。图2为一定量的DMHAN与Fe3+氧化还原反应随时间的变化曲线。本实验选择反应时间为40min。
(2)pH 的影响
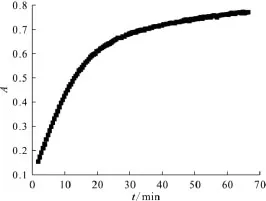
图2 反应时间对一定浓度DMHAN与Fe3+反应后吸光度的影响Fig.2 Effect of color reaction time on the absorbance created by mixing a certain concentration of DMHAN with Fe3+
Fe2+与邻菲罗琳形成稳定的配合物,在pH为2~9时溶液的吸光度保持恒定。经实验验证,与2.2.1节实验条件一致,当pH为3~5.5时,pH 吸光度随DMHAN浓度变化的标准曲线无影响。
(3)MMH存在时的干扰情况
与2.2.1节实验条件一致,当 MMH的浓度小于5.0×10-3mol/L时,MMH 与Fe3+不发生反应。当DMHAN的浓度为7.8×10-6mol/L,MMH的浓度为0~2.50×10-5mol/L时,反应40min的吸光度值随MMH浓度的变化保持恒定,如图3所示,说明在此实验条件下MMH与Fe3+不发生反应。
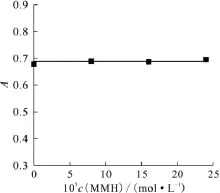
图3 MMH浓度对吸光度的影响Fig.3 Effect of MMH concentration on absorbance c(DMHAN)=7.8×10-6 mol/L
(4)甲醛、甲醇存在时的干扰情况
与2.2.1节实验条件一致,当样品中未加入DMHAN,并且分别含有0.10mol/L 的甲醛和0.10mol/L甲醇时,两样品的吸光度值分别为0.008 17和0.002 48。结果表明,当样品含有甲醛、甲醇时对该方法无干扰。
3.3 I2氧化还原褪色-分光光度法测定MMH浓度
3.3.1 标准曲线的绘制 根据2.2.2节的实验条件,检测未加MMH标准溶液的样品,即I2溶液,呈黄色,在450nm到480nm(黄色物质的吸收波长范围)处的吸光度值,如图4所示,此时水溶液中含2.07×10-3mol/L的I2。当I2溶液中加入 MMH后,两者反应会使得I2溶液颜色变淡,为使反应后的溶液的吸光度值大约为0.2~0.8,选择458nm(在458nm时吸光度为1.00)为检测波长,并检测各样品在458nm的吸光度值。根据上述实验条件所测,当 MMH浓度为3.00×10-5~3.50×10-4mol/L时,MMH的浓度与(1-A)呈现良好的线性关系,标准曲线方程为y=0.203 68x-0.059 92,r2=0.999 5,如图5所示。
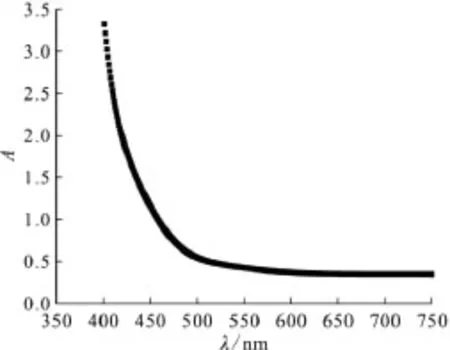
图4 I2溶液的吸光度与400~750nm处波长关系Fig.4 Absorbance of I2solution in the wavelength range of 400-750nm c(I2)=2.07×10-3 mol/L

图5 在458nm处MMH的标准曲线Fig.5 Calibration curve at 458nm
3.3.2 影响和干扰实验
(1)反应时间的影响
与2.2.2节实验条件一致,当反应时间大于20min时,MMH与I2的反应已停止,图6为当MMH初始浓度为2.01×10-4mol/L时,MMH与I2的氧化还原反应的(1-A)值随反应时间变化图。本实验选择反应时间为40min。

图6 反应时间对(1-A)的影响Fig.6 Effect of time on(1-A)c0(MMH)=2.01×10-4 mol/L
(2)pH 的影响
与2.2.2节实验条件一致,当 MMH初始浓度为2.01×10-4mol/L,pH 为0.7~3.5时,溶液的(1-A)值随pH的增加而缓慢下降,如图7所示;当pH从0.7下降到3.5时,(1-A)值减小5.6%。说明在上述实验中,pH对上述标准曲线略有影响。
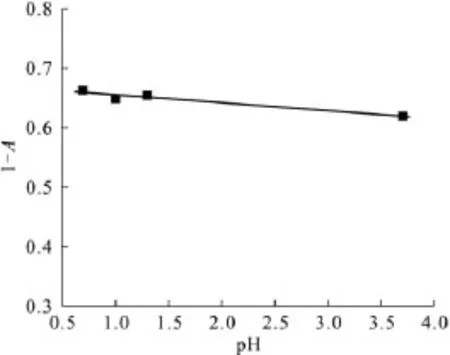
图7 pH值对(1-A)值的影响Fig.7 Effect of pH on(1-A)
(3)DMHAN存在时的干扰情况
与2.2.2节实验条件一致,当DMHAN的浓度小于1.0×10-2mol/L时,I2不与 DMHAN 发生氧化还原反应。当MMH初始浓度为2.01×10-4mol/L,DMHAN浓度为0 ~ 1.00 ×10-3mol/L时,(1-A)随 DMHAN 浓度的变化保持恒定,如图8所示,说明在此实验条件下,I2未与DMHAN发生氧化还原反应。
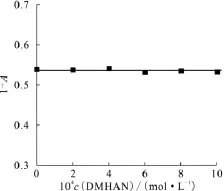
图8 DMHAN浓度对(1-A)的影响Fig.8 Effect of DMHAN concentration on(1-A)c0(MMH)=2.01×10-4 mol/L
(4)甲醛、甲醇存在时的干扰情况
与2.2.2节实验条件一致,当样品中未加入MMH,并且分别含有0.10mol/L的甲醛和0.10mol/L甲醇时,经40min后,两样品的(1-A)值分别为0.002 17和0.001 48。结果表明,当样品含有甲醛、甲醇时对该方法无干扰。
3.4 1BP样品中MMH和DMHAN浓度的分析
利用本研究所建立的分析方法,对1BP样品中的二甲基羟胺与甲基肼进行了分析测定;并且,为确定该分析方法对1BP样品中各种副产物的抗干扰性,利用加标回收率法对该分析方法的准确度进行了检测。
3.4.1 MMH 浓度测定 配制0.297mol/L的MMH标准溶液;将样品1BP01、1BP02、1BP03中Pu(Ⅲ)萃后的萃余液分别稀释25倍编号为1BP01-1、1BP02-1、1BP03-1;取一定体积的MMH标准溶液加入到1BP01-1、1BP02-1、1BP03-1样品中。分别如2.2.2节制样,测得各组样品的吸光度值并根据标准曲线算出其中MMH的浓度,结果列入表1。由表1可知各样品测量值的相对偏差和加标回收率。
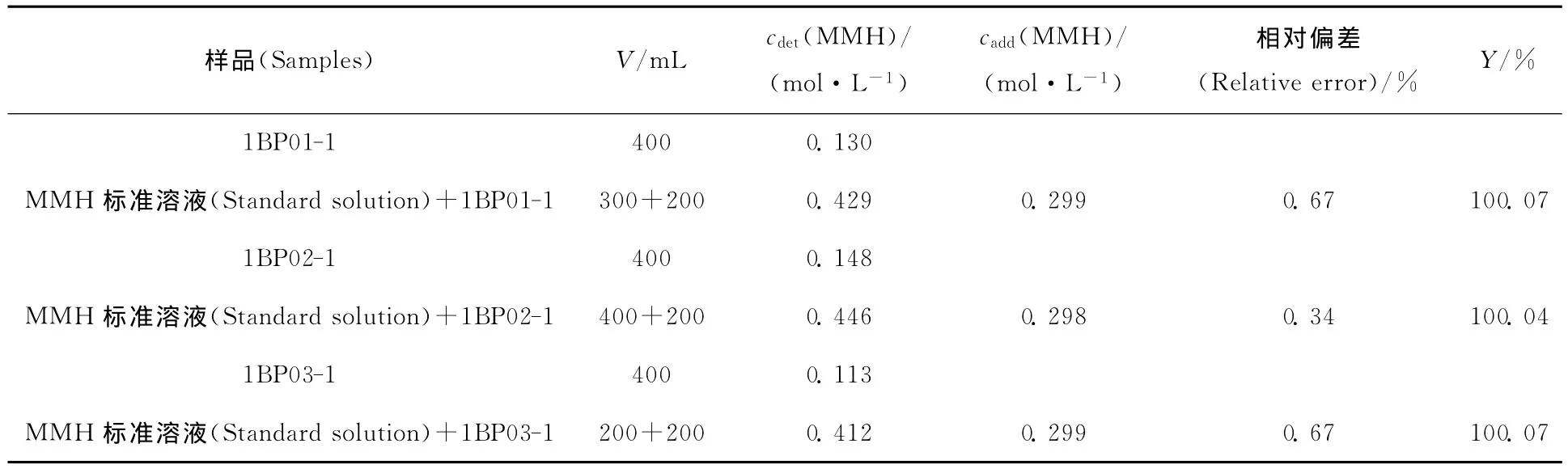
表1 I2 溶液褪色-分光光度法测1BP样品中MMH的加标回收率Table 1 Sample recovery rate for determination of MMH in 1BP by iodine fading spectrophotometry
3.4.2 DMHAN浓度测定 配制一定浓度的DMHAN标准溶液;将样品1BP01—1BP04中Pu(Ⅲ)萃取后的萃余液分别稀释2 500倍并编号为1BP01-2、1BP02-2、BP03-2、1BP04-2;分别取一定体积的DMHAN标准溶液加入到1BP01-2、1BP02-2、BP03-2、1BP04-2中。分别如2.2.1节制样,测得各组样品的吸光度值并根据标准曲线算出其中DMHAN的浓度,结果列入表2。由表2可知各样品测量值的相对偏差和加标回收率。
4 结 论
(1)用1.00mL 0.20mol/L的 TODGA-十二烷溶液将1BP样品萃取2次,萃取率可达99.994%。TODGA-十二烷溶液对Pu(Ⅲ)具有极好的萃取效果。
(2)用邻菲罗琳显色-分光光度法测定1BP萃余液中DMHAN的浓度,当DMHAN浓度为3.00×10-6~1.90×10-5mol/L时,DMHAN的浓度与吸光度呈现良好的线性关系,误差小于1.0%。甲醛、甲醇、甲酸、二甲胺、甲胺和乙醇等均对该方法无干扰。
(3)用褪色-分光光度法测定1BP萃余液中MMH的浓度,当 MMH的浓度为3.00×10-5~3.50×10-4mol/L时,MMH的浓度与(1-A)呈现良好的线性关系,误差小于1.0%。甲醛、甲醇、甲酸、二甲胺、甲胺和乙醇等均对该方法无干扰。
(4)本实验所建立的DMHAN与MMH的分析方法不仅可用于1BP中,还可以应用于1BX、2BX和2BP中。
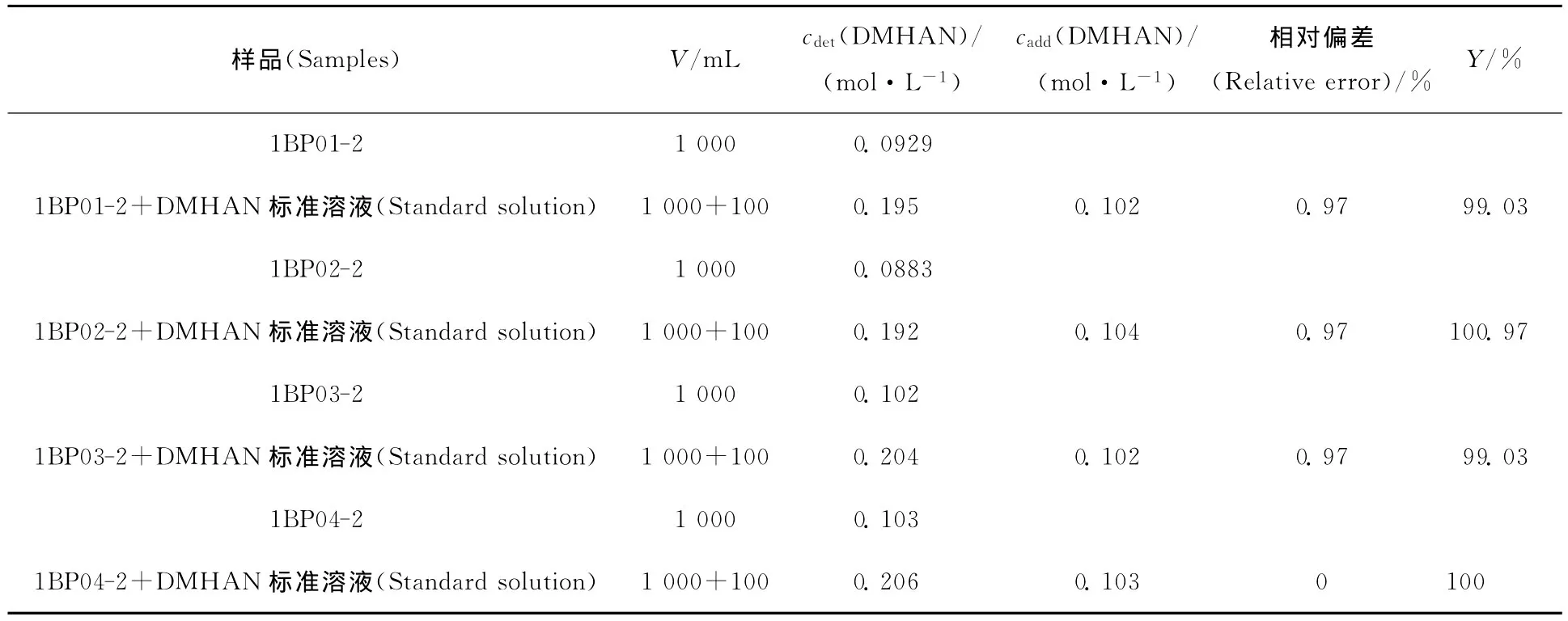
表2 Fe3+/邻菲罗琳显色-分光光度法测定1BP样品中DMHAN的加标回收率Table 2 Sample recovery rate for determination of DMHAN in 1BP by Fe3+/1,10-phenanthroline spectrophotometry
[1]叶国安.Purex流程中有机无盐试剂的应用分析[J].原子能科学技术,2004,38(2):152-158.
[2]何 辉,胡景炘,张先业,等.N,N-二甲基羟胺对Pu(Ⅵ)的还原反萃和相应的计算机模型[J].核化学与放射化学,2001,(02):65-71.
[3]肖松涛,欧阳应根.间接分光光度法测定单甲基肼、二甲基羟胺[R].中国核科技报告,2008(1):68-72.
[4]国家环境保护局.GB/T 14375—1993 水质-二甲基肼的测定对二甲胺基苯甲醛分光光度法[S].
[5]曹 希,汪南杰,张 涛,等.容量法测定硝酸肼和铀(Ⅳ)的含量[J].核化学与放射化学,2006,28(01):55-60.
[6]何 辉.N,N-二甲基羟胺在铀钚分离中的应用和计算机程序的开发[D].北京:中国原子能科学研究院,2001.
[7]陈 辉.N,N-二甲基羟胺、甲基肼辐解行为和机理研究[D].北京:中国原子能科学研究院,2010.
[8]魏 艳,丛海峰,矫海洋,等.单甲基肼与亚硝酸的反应动力学[M].中国原子能科学研究院年报,2006:12.
Analyzing Method ofN,N-Dimethylhydroxylamine and Methylhydrazine in Purex Process
LI Chuan-bo,LIU Jin-ping,YAN Tai-hong,ZHANG YU,ZHENG Wei-fang
China Institute of Atomic Energy,P.O.Box 275(26),Beijing 102413,China
The extraction of Pu(Ⅲ)with TODGA from 1BP solution prior to the determination ofN,N-dimethylhydroxylamine(DMHAN)and methylhydrazine(MMH)in it was studied and excellent removal was observed.It was found that Fe3+could react with DMHAN but did not react with MMH in the pH range 2.0-5.5at room temperature.It was also found that dilute I2solution reacted only with MMH but not with dilute DMHAN in the pH range 0-5.5at room temperature.Based on these findings the determination of DMHAN with Fe3+/1,10-phenanthroline spectrophotometry,and the determination of MMH by iodine fading spectrophotometry were developed.Their detection limits were found to be 3.00×10-6mol/L and 3.00×10-5mol/L,respectively.Their analytical errors were estimated lower than 1.0%.The influence of reaction time,acidity,and the existence of methanol or formaldehyde on the determination was examined.These methods could also be used to analyze DMHAN and MMH in 1BX,2BX,and 2BP solutions.
N,N-dimethylhydroxylamine;methylhydrazine;spectrophotometry;Purex process
TL241
A
0253-9950(2011)05-268-06
2011-03-04;
2011-05-03
李传博(1980—),男,山东莱芜人,硕士,研究实习员,核燃料循环与材料专业
