毛细管电泳法检测婴幼儿奶粉中乳铁蛋白的质量分数
2011-01-08顾媛程利花姜金斗杨金宝钱文斌b吴菁岚b应汉杰b
顾媛,程利花,姜金斗,杨金宝,钱文斌b,吴菁岚b,应汉杰b
(1.南京工业大学a.生物与制药工程学院;b.国家生化工程技术研究中心,南京 210009;2.国家乳制品质量监督检验中心,哈尔滨 150086)
毛细管电泳法检测婴幼儿奶粉中乳铁蛋白的质量分数
顾媛1a,程利花1a,姜金斗2,杨金宝2,钱文斌1ab,吴菁岚1ab,应汉杰1ab
(1.南京工业大学a.生物与制药工程学院;b.国家生化工程技术研究中心,南京 210009;2.国家乳制品质量监督检验中心,哈尔滨 150086)
建立了准确简便的测定婴幼儿奶粉中乳铁蛋白质量分数的方法,样品经脱脂、酸法去除酪蛋白和硫酸铵沉淀富集、纤维素滤膜过滤净化等方法进行预处理,选择直径为50 μm,有效长度为57 cm的未涂层毛细管柱进行检测,缓冲溶液为浓度40 mmol/L的硼酸盐/磷酸盐(pH值为9.5),浓度为50 mmol/L的SDS,浓度为20 mmol/L的Brij35,体积分数4%异丙醇,浓度为30 mmol/L硫酸钠,工作电压为18 kV,检测波长为200 nm。结果显示标准曲线相关系数为0.9992;平均回收率为92.8%,6次样品测定RSD为2.4%。
乳铁蛋白;毛细管电泳;婴幼儿配方奶粉
0 引言
乳铁蛋白(Lactoferrin,LF)是1960年由Johannson从人乳中分离获得的一种铁结合性多功能糖蛋白[1,2]。在GB 2760食品添加剂使用卫生标准中规定,乳铁蛋白可以在婴儿配方奶粉、较大婴儿和幼儿配方奶粉中使用,使用量为30~100 mg/100 g。目前国内外报道的LF检测方法主要有酶联免疫法[3]、高效液相色谱法[4-5]和高效毛细管电泳法[6,7],但这些方法大都适用于牛初乳或者是原料中的高质量分数LF的检测,而关于婴幼儿奶粉中LF的检测方法报道较少。杜凌等人用酶联免疫法来检测婴幼儿奶粉中的LF[8],但是该法稳定性差,产生的误差较大,不适用于精密定量分析。本文建立了一种毛细管电泳法来检测婴幼儿奶粉中的LF,该方法拓宽了毛细管电泳法检测LF的适用范围,适于婴幼儿奶粉中低质量分数LF的测定。
1 实验
1.1 材料
市售婴幼儿配方奶粉;乳铁蛋白标准品(纯度约为90%);硫酸铵,盐酸,四硼酸钠、磷酸二氢钠,磷酸氢二钠,氯化钠,硫酸钠均为分析纯。十二烷基磺酸钠(SDS),Brij35(聚氧乙烯月桂醚),异丙醇。实验所用水均为去离子水。
1.2 仪器
贝克曼P/ACE MDQ毛细管电泳仪,冷冻离心机,pH计。
1.3 方法
1.3.1 样品的预处理[5]
准确称取10 g婴幼儿奶粉样品,使其完全溶解于100 mL水中,然后以5 000 r/min速度离心30 min,去除上层漂浮的脂肪;再用稀盐酸调节pH值至4.6,用滤纸过滤。取一定量的滤液,然后缓慢搅拌加入硫酸铵至硫酸铵浓度为40%,将溶液静止3 h,以5 000 r/min速度离心30 min,取上清液,再向上清液中缓慢搅拌加入硫酸铵至硫酸铵浓度为80%,将溶液静止3 h,以5 000 r/min速度离心30 min,取沉淀,用10 mL去离子水溶解,再用0.45 μm纤维素滤膜过滤至样品瓶内,摇匀后供毛细管电动色谱测定。
1.3.2 毛细管柱的处理[9]
毛细管柱(50 μm×57 cm)第一次使用前用浓度为1 mol/L氢氧化钠洗15 min,再用超纯水洗5 min,后用电泳缓冲液冲洗5 min。每次进样前依次用浓度为0.05 mol/L氢氧化钠和缓冲液冲洗5 min。
1.4 标准溶液的配制
准确称取50 mg乳铁蛋白标准品用三重蒸馏水溶于25 mL容量瓶中,然后依次稀释至2.0,1.0,0.75,0.50,0.375,0.25和0.10 g/L,并用0.45 μm纤维素滤膜过滤后用于色谱测定。
1.5 色谱条件
色谱柱为毛细管柱(50 μm×57 cm);柱压为18 kV;柱温为25℃;检测器为二极管阵列检测器;检测波长为200 nm;进样时间为10 s;检测缓冲液pH值为9.5,浓度为40 mmol/L硼酸盐/磷酸盐+50 mmol/LSDS+20 mmol/LBrij35+体积分数4%异丙醇+30 mmol/L硫酸钠。
2 结果与讨论
2.1 检测缓冲液的确定
2.1.1 缓冲液种类及浓度的确定
缓冲液的种类是影响乳铁蛋白分离的重要因素,考察了磷酸盐与硼酸盐缓冲液对分离的影响,发现使用单一的硼酸盐缓冲体系和单一的磷酸盐缓冲体系,峰会集中在一较小的区间内,且不少峰出现重叠,分离度不佳,重现性差。实验着重考察了二元缓冲体系。磷酸盐-硼酸盐二元缓冲体系可以使分析窗口扩大,缓冲容量增大,且在较高浓度下亦不会产生过大电流,对未知物的干扰影响小。实验考察了在20,30,40 mmol/L浓度下的缓冲盐对分离度的影响。结果表明,随着浓度的增加,保留时间会延长,但是分离度会变好,所以选择40 mmol/L浓度下的硼酸盐/磷酸盐溶液作为最适缓冲液。
2.1.2 表面活性剂及浓度的确定
表面活性剂在MECC中起着极其重要的作用,单独以SDS作为添加剂,分析物的分离效果较差。若加入Brij35,则会改善其分离度。但是表面活性剂的浓度不能过低,也不能过高,否则会降低分离度。经实验考察,结果发现在50 mmol/L的SDS和20 mmol/L的Brij35浓度下,分离度最好。
2.1.3 有机溶剂体积分数的确定
因为表面活性剂中的SDS常常会产生泡沫,从而使组分在电泳过程中产生大量的焦耳热,降低迁移时间的重复性,使各组分区带增宽。加入适当的有机溶剂,能使SDS所起的泡沫消泡,减少焦耳热,提高迁移时间的重复性,对提高分离度有明显的效果。高体积分数的异丙醇削弱了样品分子与表面活性剂的作用,使分离度降低,应控制在体积分数为4%左右为佳。
2.1.4 硫酸钠盐分浓度的确定
在缓冲液中加入一定量的阳离子中性盐能够改善分离度,并改善峰型,加入硫酸钠还可以改变胶束的大小和形状,并且可以增加胶束的疏水性。但是加入过多的钠盐会使分离时间延长,并且产生过大的焦耳热,对基线造成抖动漂移等影响。实验考察了浓度为20,30,40 mmol/L硫酸钠的影响,最终选择浓度为30 mmol/L的硫酸钠,该浓度下的硫酸钠使得分离度较佳,基线较平稳。
2.2 缓冲液pH值的确定
实验在硼酸盐/磷酸盐缓冲液的有效缓冲范围内研究了pH值变化对分离的影响,当pH值小了,各种蛋白电泳迁移率的差异过小,导致组分峰重叠严重;当pH值大了,缓冲液中OH-浓度急剧增加,电流增大,焦耳热效应是分离效率反而下降。因此,实验考察了pH值为8.5,9.0,9.5,10.0对分离度的影响,结果pH值为9.5时分离度最好。
2.3 乳铁蛋白的标准曲线
以LF的质量浓度为横坐标,以LF在200 nm处的紫外吸收峰面积为纵坐标,作乳铁蛋白的标准曲线,结果如图1所示,由此计算出的回归方程为y=998768x-4082,相关系数R2=0.9992,LF溶液在质量浓度为0.1~2.0 g/L范围内呈线性相关。
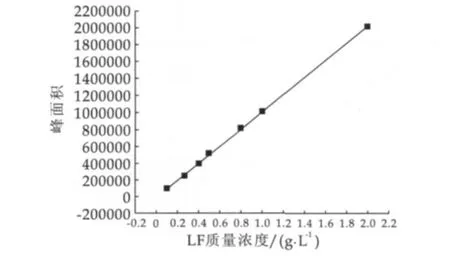
图1 乳铁蛋白的标准曲线
2.4 样品测定的色谱图
乳铁蛋白标样、婴幼儿配方奶粉中LF的CE图谱如图2和图3所示。由图2和图3可以看出,乳铁蛋白出峰时间在23 min左右。
2.5 方法回收率
准确称取3组婴儿配方奶粉,分别添加不同浓度的乳铁蛋白,每组3个平行,按1.3.1节方法处理样品,进样检测,结果如表1所示。
2.6 方法精密度
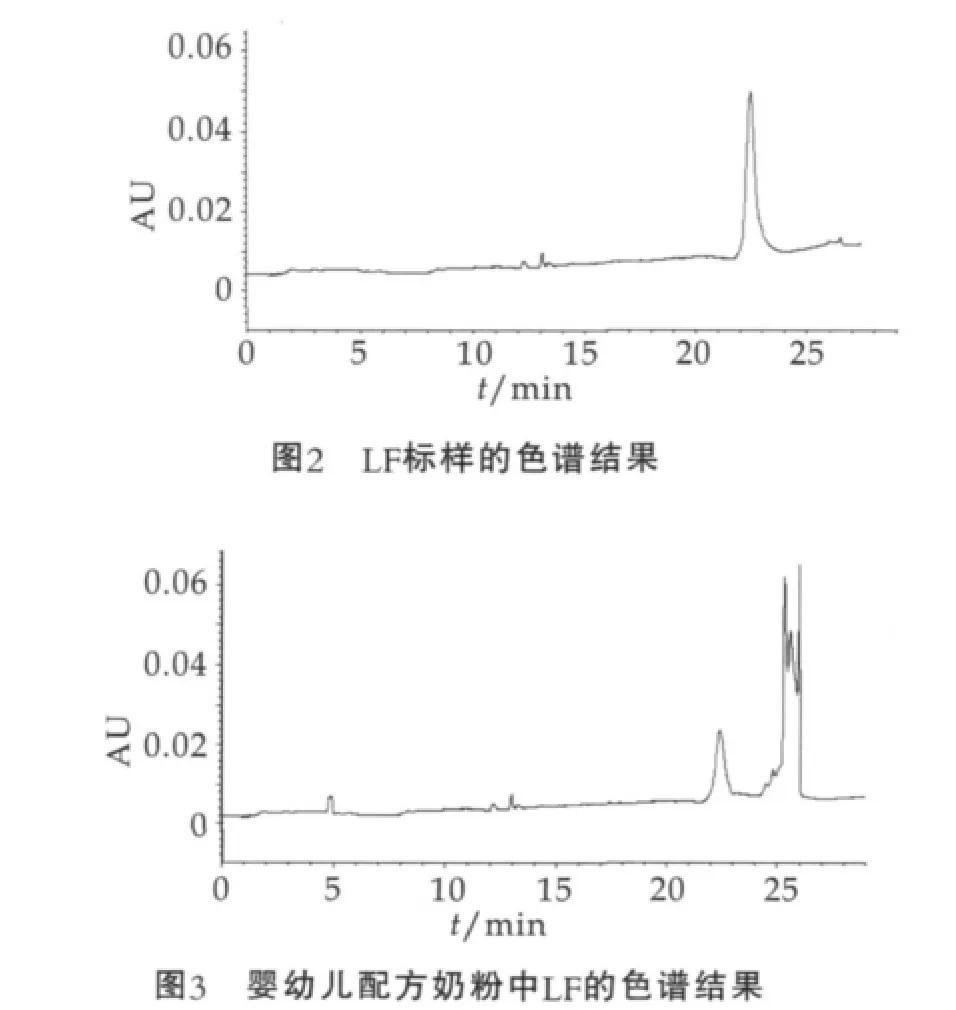
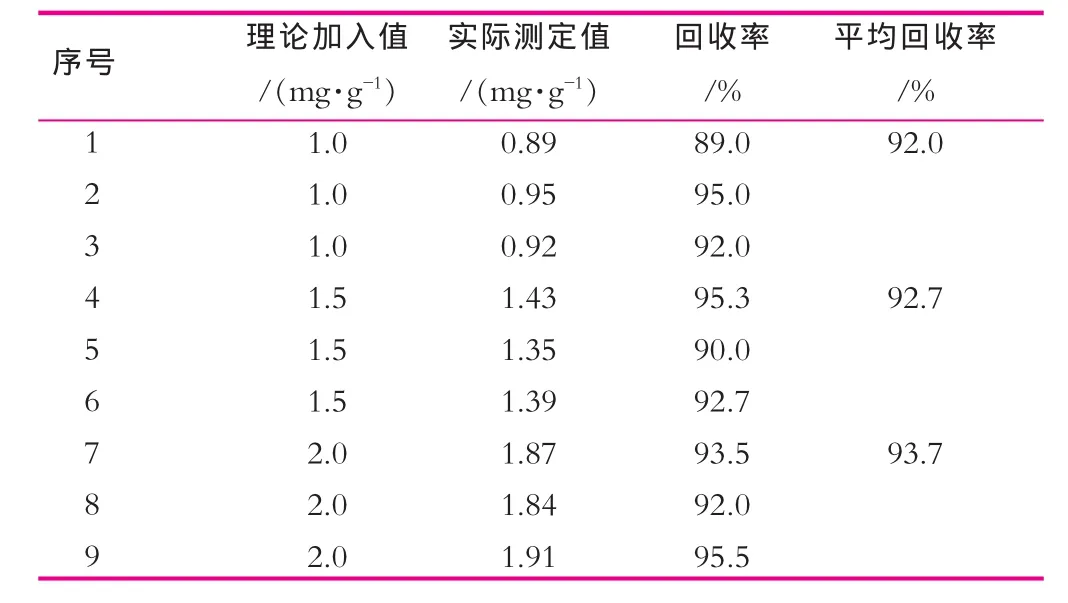
表1 回收率实验结果
对同一种添加乳铁蛋白的婴幼儿配方奶粉进行6次测定,处理方法用1.3.1,结果如表2所示。由表2经统计分析表明,测定结果的重现性较好,相对标准偏差为2.4%,测定结果稳定。由此可见,本方法用于实验室检测比较稳定。
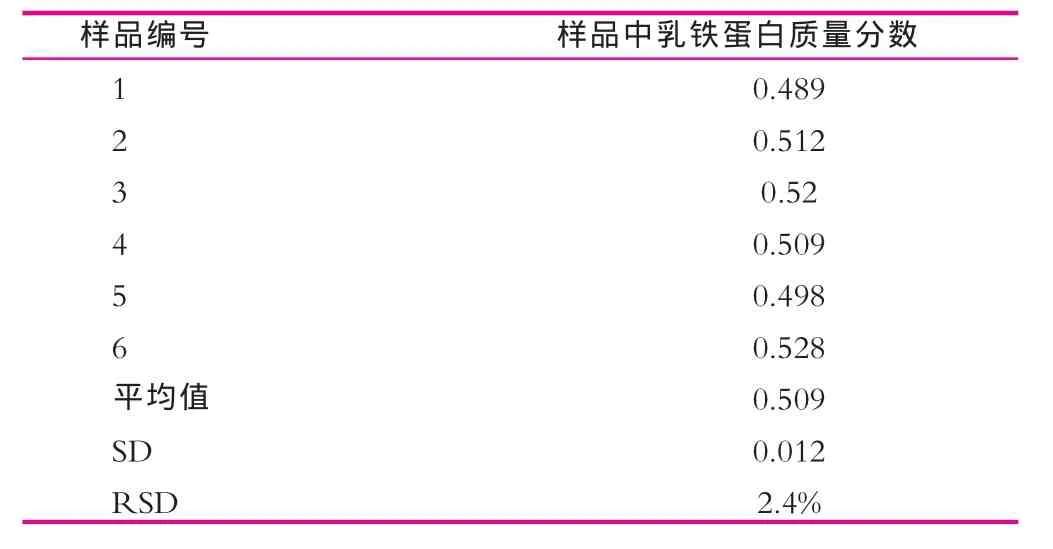
表2 精密度实验结果mg/g
3 结论
本文建立了毛细管电泳法检测婴幼儿配方奶粉中乳铁蛋白含量的方法。乳铁蛋白的提取采用脱脂、酸法去除酪蛋白和硫酸铵沉淀富集的方法,确保最大限度的去除杂质,且不会使蛋白质变性。毛细管电动色谱条件上采用了内径为50 μm,长度57 cm的毛细管柱,在适宜的检测缓冲液和检测条件下,使得乳铁蛋白和其它杂质能很好地分离开。该方法方便、准确、灵敏度高、稳定且分离度好,是快速检测婴幼儿奶粉中乳铁蛋白含量较适合的分析方法,而且解决了一直难以用常规HPLC法来分析婴幼儿配方奶粉中乳铁蛋白含量的准确定量问题,这为今后婴幼儿配方奶粉的安全检测及乳铁蛋白的进一步研究打下了基础。
[1]JOHANSSON B G.Isolation of an Iron Containing Red Protein from Human Milk[J].Acta Chem Scand,1960,14:510-512.
[2]LEVAY P F,VILJOEN M.Lactoferrin:A General Review[J].Haematologica,1995,80:252-267.
[3]冯挺财,邵谱,胡珩,等.牛乳铁蛋白直接竞争ELISA检测法的建立[J].安徽农业科学,2008,36(18):7650-7652,7761.
[4]任璐,龚广予,杭锋,等.采用HPLC测定乳铁蛋白质量浓度的方法研究[J].中国乳品工业,2009,37(2):49-52.
[5]DRACKOVA M,BORKOVCOVA I,JANSTOVA B,et al.Determination of Lactoferrin in Goat Milk by HPLC Method[J].Czech Journal of Food Sciences,2009,27:102-104.
[6]RIECHEL P,WEISS T,WEISS M,et al.Determination of the Minor Whey Protein Bovine Lactoferrin in Cheese Whey Concentrates with Capillary Electrophoresis[J].Journal of Chromatography A,1998,817: 187-193.
[7]孙国庆,康小红,刘卫星,等.利用毛细管电泳法测定乳品中乳铁蛋白含量[J].食品研究与开发,2009,30(1):115-117.
[8]杜凌,任璐,苏米亚.婴儿奶粉中乳铁蛋白的检测方法的研究[J].乳业科学与技术,2008(3):121-122.
[9]RIECHEL P,WEISS T,ULBER R,et al.Advances in Lactoferrin Research[M].Hannover,Germany:Plenum Publishing Corp,1998:33-39.
Determination of Lactoferrin in infant formula milk powder by Capillary Electrophoresis
GU Yuan1a,CHENG Li-hua1a,JIANG Jin-dou2,YANG Jin-bao2,QIAN Wen-bin1ab,WU Jing-lan1ab, YING Han-jie1ab
(1.Nanjing University of Technology a.College of Biotechnology And Pharmaceutical Engineering;b.National Biochemical Engineering Technique Research Center Nanjing 210009,China;2.National Dairy Produce Quality Inspection Center,Haerbin 150086,China)
An accurate and convenient method was developed for the determination of lactoferrin in infant formula milk powder.The pretreatment of sample was to degrease,remove caseins by adjusting pH to enrich LF with ammonium sulfate and clean up with Millipore,then using an uncoated capillary that the diameter was 50 μm and the effective length was 57 cm;buffer solution was 40 mmol/L borate/phosphate (pH=9.5),50 mmol/L SDS,20 mmol/L Brij35,4%isopropanol,30mmol/L Na2SO4;separated voltage was 18 kV;detection wavelength was 200 nm.Results showed that the relative coefficient was 0.9992,the average recovery was 92.8%;the RSD in 6 samples by testing was 2.4%.
lactoferrin;capillary electrophoresis;infant formula milk powder
TS252.7
A
1001-2230(2011)05-0054-03
2011-01-10
顾媛(1988-),女,硕士研究生,研究方向为婴幼儿奶粉中乳铁蛋白的检测。
应汉杰
