辽河口湿地异养细菌的变化规律及影响因素研究*
2011-01-08尹宁宁赵阳国田伟君
白 洁,尹宁宁,赵阳国,田伟君
(中国海洋大学1.环境科学与工程学院;2.海洋环境与生态教育部重点试验室,山东青岛266100)
辽河口湿地异养细菌的变化规律及影响因素研究*
白 洁1,2,尹宁宁1,赵阳国1,2,田伟君1,2
(中国海洋大学1.环境科学与工程学院;2.海洋环境与生态教育部重点试验室,山东青岛266100)
通过现场调查和模拟培养实验,对辽河口湿地芦苇生长期内土壤异养细菌的变化规律及其主要影响因素进行了研究。野外现场调查结果表明,异养细菌数量6月份最多,8月份最少;植被长势良好区异养细菌数量比裸滩区高1倍左右。现场培养实验结果表明,盐分、C/N、石油、植被对异养细菌数量均有影响,异养细菌数量随盐分增加而减少;C/N比值增加,异养细菌数量明显增多,碳氮比为10∶1时,异养细菌数最大,约为对照组的3倍;石油会显著抑制异养细菌生长,浓度越高,异养细菌数量越少;有植被组的异养细菌数量明显高于无植被组。
河口湿地;异养细菌;影响因素
辽河口湿地是我国面积最大的芦苇沼泽区[1],以盐生环境为主,土壤盐渍化比较严重。辽河油田历经40多年的开发活动,虽然采取大量保护措施,但依然对该区域造成比较严重的石油污染[2]。近年来在湿地中发展河蟹养殖,由于管理不科学致使湿地水质及底泥富营养化[3]。自然及人为干扰的多重因素导致了辽河口湿地生物栖息地环境发生变化,生物多样性减少[4]。
异养细菌的数量是各土壤理化因子和生物因子综合作用的结果,其多少直接或间接影响着土壤的肥力和物质转化能力,因此测定土壤中异养细菌数量对深入了解湿地土壤肥力的变化和土壤生态系统的能量流动和物质转化具重要作用[5]。然而目前对辽河口湿地异养细菌开展的研究比较少,赵先丽等[6]只对盘锦芦苇湿地土壤微生物的3大菌群分布情况做了研究。
本文通过野外调查及现场培养实验,研究了辽河口湿地土壤异养细菌的变化规律及盐分、碳氮比、石油等主要环境因素的影响,以期为河口湿地微生物生态作用及湿地生态功能研究提供基础资料。
1 材料与方法
1.1 现场调查
1.1.1 站位布设 分别选取代表芦苇长势良好区、长势一般但有人为恢复区、长势较差区和无植被生长区的4个站位,研究辽河口湿地异养细菌的时空变化。调查站位及其环境特征见表1。
1.1.2 样品采集与处理 分别于2009年的6、7、8和9月,在各调查站位无菌采集表层土样,带回实验室用于异养细菌计数和盐分、有机质、总氮和石油类含量等土壤理化因子的测定。
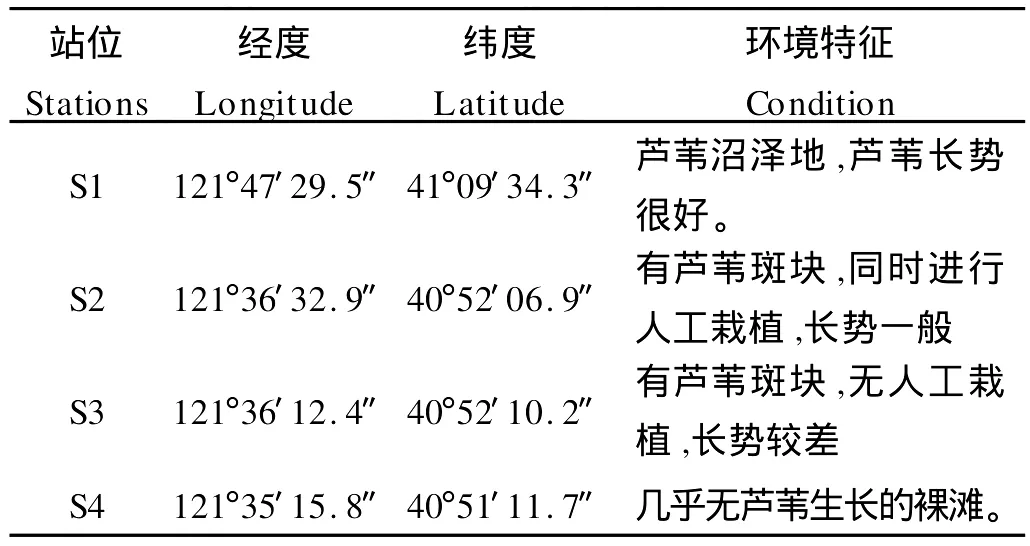
表1 辽河口湿地采样站位Table 1 Sampling stations in the Liaohe Estuary
1.2 模拟培养
1.2.1 样品来源与模拟实验 鉴于目前辽河口湿地存在植被退化明显,有些区域已退化为无任何植被生长的光滩,以及石油污染较为严重等现象,本研究选择有代表性的芦苇生长茂盛区(A区,121°47′29.5″E,41°09′34.3″N)和无植被生长的裸滩区(B区,121°35′15.8″E,40°51′11.7″N)作为研究区域,分别无扰动采集2个区域土壤进行现场模拟培养,用于研究有无植被、土壤盐分含量、C/N和石油类对河口湿地异养细菌的影响。
实验按土壤来源分为A、B 2组,A组采自有植被的A区土壤后种植取自现场的芦苇,B组取自无植被的B区土壤,不种植任何植物。2组实验分别设置盐分(S)、C/N(C)和石油类(O)3个影响因子组,A组中AS(10、15、20)、AC(5、10、15)和AO(5)分别为不同梯度的盐分(10‰、15‰、20‰)、C/N比(5∶1、10∶1、15∶1)和石油含量(5 g/kg)组。B组中BS(10、15、20)、BC(5、10、15)、BO(5、10)的因子梯度与A组相同,2组均设未做任何处理的对照组AN和BN组,具体分组见表2。每组实验均设2个平行实验组。
模拟培养于2010年5月19日~2010年10月1日进行,培养期间各实验组水量保持一致,土壤表层始终有上覆水。自6月3日开始施加影响因素,实验一次性分别向不同受试组土壤添加定量的氯化钠、葡萄糖及石油,并同时测定其含量使其达到设定浓度。

表2 采样站位及实验分组Table 2 The sampling stations and group of experiment
1.2.2 样品采集与处理 分别在施加影响因素后的第0、7、14、30、60、90及120 d无菌采集各组土壤样品,冷藏保存立即带回实验室进行异养细菌数量测定;同时采集部分土壤样品用于盐分、有机质、总氮和石油类含量等环境因子的测定。
1.3 样品测定
异养细菌数量的测定:用DAPI染色,采用荧光显微镜法[7]进行。
可溶性盐分测定:采用重量法[8]进行。
有机质含量测定:采用重铬酸钾外加热方法[8]进行。
总氮(TN)含量测定:采用剀氏定氮法[8]进行。
总石油烃含量测定:采用荧光分光光度法[5]进行。
1.4 数据统计分析
数据的统计分析采用SPSS13.0 fo r w indow s[9]软件进行。
2 结果与分析
2.1 辽河口湿地土壤异养细菌数量的时空变化
辽河口湿地不同区域异养细菌数量分布与季节变化见图1。由图中可见,各站位异养细菌数量均表现出先递减后增加的趋势,即6月份最多(平均值为17.90×109个/g干土)、8月份最少(平均值为13.02×109个/g干土)。通过相关性分析可知(见表3),异养细菌数量与盐分、有机质、总氮有相关性,但3种环境因子季节差异性不大,气温、含水率则变化显著。可知异养细菌数量变化主要与气温、含水率有关。6月份气温开始上升,细菌数量上升;7月份以后,气温也升高,但雨水增多,湿地的积水层加深,土壤通气状况不良,好养性微生物的活性受到抑制,细菌数量减少;但是随着水分的蒸发,9月份积水下降,所以适合细菌繁殖的环境条件有所改善,细菌数量又开始上升[10]。由此可见,含水率、盐分、植被是辽河口湿地异养细菌数量最重要的影响因素,其次是有机质、总氮含量和气温,石油的污染对异养细菌总数的影响相对较少。
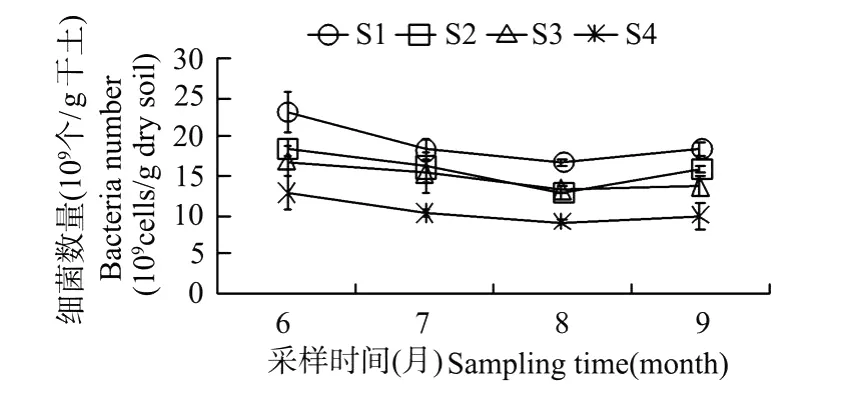
图1 辽河口湿地不同站位异养细菌数量变化Fig.1 The variation of heterotrophic bacteria number in different stations in Liaohe Estuary
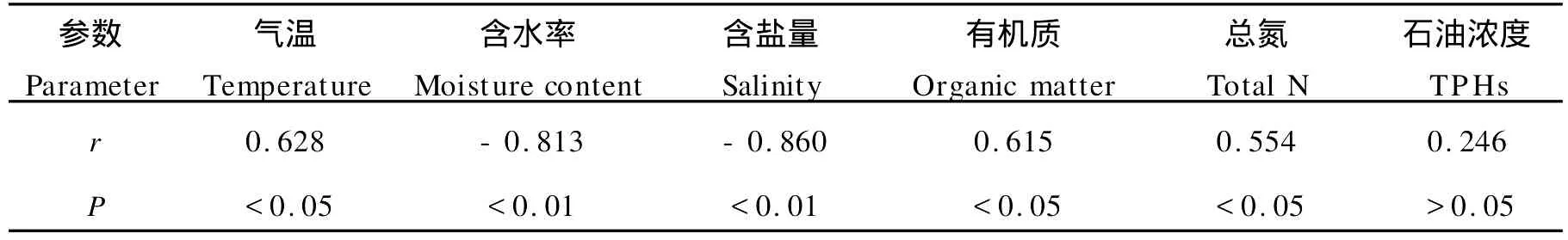
表3 异养细菌与环境因子的关系Table 3 The co rrelation coefficients of hetero trophic bacteria with the environmental facto rs
由图1还可知,不同区域异养细菌数量差别较大。芦苇长势良好区的S1站异养细菌数量最多(平均值为19.17×109个/g干土),裸滩区的S4站异养细菌数量最少(平均值为10.62×109个/g干土),长势一般的S2、S4站居中(平均值分别为为7.67、7.62×109个/g干土)。由此可以看出,植被为细菌的生长提供了良好的生存条件,植被长势越好,异养细菌数量越多,也说明植被生长良好区有利于异养细菌各种生态功能的发挥。
2.2 土壤盐分对异养细菌数量的影响
盐分对有植被组异养细菌数量的影响见图2。土壤含盐量分别为10、15、20‰时,异养细菌数量分别在(10.27~31.92、6.37~33.12、3.4~32.58)×109个/g干土之间,平均值分别为(20.74、17.08、14.88)×109个/g干土。从图2可以看出,不同土壤盐分下,异养细菌数量变化规律基本一致,表现为从6~10月逐渐递减的趋势,盐分越大,异养细菌数量越少,且在培养刚开始的前两周变化最为明显,迅速降为对照组的50%左右。其原因主要是随着土壤盐分的增加,渗透压也会变大,很多异养细菌不能够耐受高盐环境,其生命活动和活性受到抑制,而且盐分还会影响葡萄糖等营养物质的降解和硝化作用,影响了细菌对营养物质的有效吸收和利用,从而使得高盐环境下的异养细菌数量平均较低[11-12]。
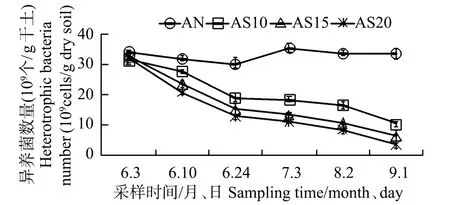
图2 不同盐分下有植被组异养细菌数量的变化Fig.2 The variation of heterotrophic bacteria number in different saline lands with reeds
盐分分别为10、15、20‰时,无植被组异养细菌数量分别在(11.88~19.78、1.18~14.63、0.44~12.43)×109/g干土之间,平均值分别为(8.15、5.73、4.43)×109个/g干土,具体变化趋势见图3。从图中可看出,无植被组异养细菌数量随盐分增加的变化规律与有植被组的基本一致,在培养期间呈逐渐下降的趋势,但各含盐量梯度组无植被组的异养细菌数量约为有植被组的50%。
通过相关性分析可知,各组异养细菌数量与盐分呈显著的负相关关系(r=-0.83,P<0.01),可见,土壤盐分是抑制异养细菌生长的重要因素之一。近年来,辽河口湿地由于连年的干旱缺水和国家用水政策的调整,导致芦苇湿地水资源日益紧张,用水短缺现象不断加剧,芦苇湿地灌溉只能用含盐量较高的混合水,土壤含盐量达8‰~30‰[13]。土壤含盐量增加,异养细菌数量的减少会显著影响湿地土壤的物质转化能力,从而影响湿地生态系统污染净化等生态功能,特别是在裸滩区,植被不再生长后盐分的增加会更显著地影响异养细菌的数量,导致其生态功能进一步下降。因此,需要加强对退化湿地的植被恢复和补充水分等排盐措施,以保证湿地正常的生态结构与功能。
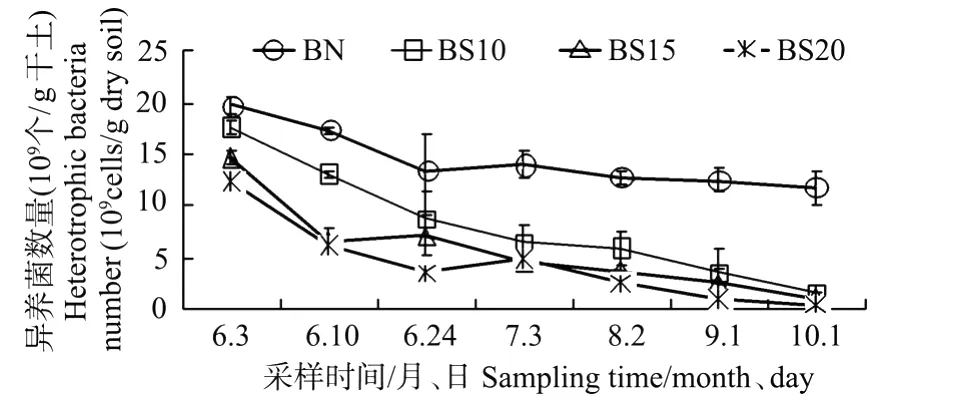
图3 不同盐分下无植被组异养细菌数量的变化Fig.3 The variation of hetero trophic bacteria number in different saline lands without reeds
2.3 C/N对异养细菌数量的影响
不同C/N对有植被组异养细菌数量变化的影响见图4。C/N比值分别为5∶1、10∶1、15∶1时,土壤异养细菌数量在(26.81~50.30、34.28~72.58、21.32~83.69)×109个/g干土之间,平均值分别为(40.06、59.5、37.49)×109个/g干土。可见,增加C/N的实验组异养细菌数量明显高于不施加任何因素的对照组,表明C/N比值的增加可促进异养细菌的生长。由图5可见,不同C/N比值组土壤异养细菌数量的变动趋势基本一致,在6月份(培养初期)最少,7月份(培养30 d)达到最大,以后逐渐降低;但C/N比值为10∶1组的土壤异养细菌数量增加量显著高于其它2组。

图4 不同C/N下有植被组异养细菌变化Fig.4 The variation of heterotrophic bacteria number in different C/N ratio soils with reeds
不同C/N比值对无植被湿地土壤异养细菌数量变化的影响见图5。C/N为5∶1、10∶1、15∶1时,土壤异养细菌数量分别在(20.14~54.69、21.48~85.29、20.19~54.53)×109个/g干土之间,平均值分别为(36.91、67.62、38.60)×109个/g干土。C/N比值增加后,土壤中异养细菌数量明显高于对照组,而且都呈现先增加后减少的趋势,也是在C/N比值为10∶1时数量最多,但除C/N比值为10∶1组外,其它C/N比值组的细菌数量明显低于有植被组。
异养细菌的生长繁殖需要一定的碳源和氮源,一般土壤中异养细菌的数量受碳源的限制,碳源的加入,增加C/N后,可以刺激异养细菌的生长,直到可利用的氮缺乏[14-16]。但是若土壤中碳氮比过高,会导致异养细菌氮素营养缺乏,从而抑制土壤异养细菌的活动,造成土壤异养细菌多样性及丰度降低[17]。本结果也表明,当C/N为10∶1时异养细菌数量明显高于其它2个比列组。可见,异养细菌的生长繁殖需要适宜的碳氮比,C/N比值为10∶1左右可能是辽河口湿地土壤异养细菌生长的最佳C/N比值。
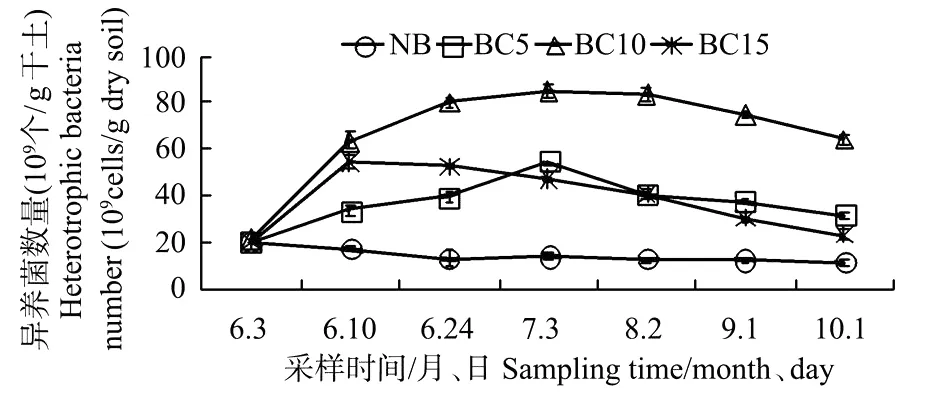
图5 不同C/N下无植被组异养细菌变化Fig.5 The variation of heterotrophic bacteria number in different C/N ratio soils without reeds
辽河口湿地自1997年以来,部分苇场就开始尝试在芦苇湿地内推出“一育三养”(即育苇、养鱼、养蟹、养禽)立体生态养殖模式的试验,使芦苇湿地真正达到了“一水多用、一地多收”的目的。但是随着养殖规模的发展,连年循环高密度养殖,有机质的累积,必然导致了养殖水体污染的逐年加剧,水质和底泥富营养化[13]。同时,来源于芦苇植被残体(地上部的枯枝落叶、地下部的死亡根系及根的分泌物)及动物残体等湿地土壤有机质在微生物分解过程中,气态碳素不断消失,但氮素仍保持在凋落物残体中,使氮的相对含量逐渐增高[18]。多种因素导致湿地氮素累积,碳/氮比值日趋减少,导致异养细菌的生长受到抑制,本研究异养细菌在7、8月份数量增加不明显也可能与湿地自身的碳氮比值有关。其结果将显著影响细菌在河口湿地物质循环中的作用,进而影响湿地的各种生态功能。因而,在湿地管理中,要科学合理发展养殖业,减少氮源污染,充分利用资源,使湿地土壤的C/N在合理的范围内,确保湿地系统的健康。
2.4 石油污染对异养细菌数量的影响
不同石油浓度对有、无植被组异养细菌数量变化的影响见图6。有植被组添加5 g/kg的石油和无植被组分别添加5、10 g/kg石油时,土壤异养细菌数量分别为(5.36~34.72、9.08~16.33、3.23~15.09)×109个/g干土之间,平均值分别为(15.40、11.72、7.49)×109个/g干土。从图中可以看出,有、无植被的5 g/kg石油浓度组和无植被的10 g/kg石油浓度组,异养细菌数量均比对照组少,石油浓度越大,异养细菌数量越少;且都在6月(前14 d)下降最为明显,以后开始缓慢下降或有所回升。原因主要是石油浓度较大,对异养细菌产生了毒害作用[19]。Franco[20]等发现原油污染造成土壤异养细菌群落适应能力降低[21],相应的数量也会随之减少。而到了后期,异养细菌的数量又有所上升,主要是石油污染基本被消除,石油对细菌的毒性作用减弱,生态系统趋于恢复正常。但在6月有植被的5 g/kg石油浓度组比无植被的同浓度组细菌数量下降更为明显,可能是石油覆盖在土壤表面,破坏了土壤-植物-水分之间的关系,对空气的排斥,引起厌氧条件的发生,使根不能正常呼吸和吸收水分[22],好氧异养细菌的生长繁殖也受到抑制;而随后异养细菌数量又比无植被组上升的快,主要是植物根系的吸收、转化及分解作用[23],加速了石油的降解,石油的毒害作用减弱。

图6 不同石油浓度下有、无植被土壤异养细菌的变化Fig.6 The variation of heterotrophic bacteria number in soils with different amounts of TPH
辽河口湿地有辽河油田,该地区高强度的石油开发引发的井喷油管破裂、原油泄漏以及输油气管线的敷设等都会对湿地表层土壤产生一定程度的破坏[24]。本研究结果表明,在自然状态下,石油对微生物产生的毒害作用使异养细菌数量明显减少,石油的降解需要较长的时间。因此,在进一步加强管理、减少石油污染物排放的同时,有必要筛选、培育适于高盐湿地土壤的高效石油降解菌,增加湿地净化能力,减少石油污染对河口湿地生态系统产生的影响。
2.5 结语
细菌多生活于中性、弱碱性土壤中,对环境因子的变化反应比较敏感。通过比较可以看出,有植被的土壤异养细菌数量与无植被的季节变化趋势基本一致,但是数量明显多于无植被组。异养细菌数量的增加有利促进土壤中有机残体的分解和潜在养分的转化,提高土壤的供肥能力;细菌代谢产生的多种有机酸还能提高土壤养分的有效性[25-27];同时,植被覆盖使得土壤湿度条件更适合于异养细菌的生长,植物根系的生长活动同样也可以改变土壤的物理环境,从而更有利于异养细菌的生长。因而,要尽快恢复辽河口区裸滩植被,充分发挥河口湿地植物与微生物的联合生态作用。
3 结论
土壤微生物的数量与土壤理化性质有着密切的关系。土壤微生物的数量越多,土壤环境容重越小,孔隙度越大,土壤的结构性越好,土壤的通气透水能力也就越强。其中土壤异养细菌数量是反应湿地土壤环境质量和生态特征的敏感指标。本文研究了异养细菌的变动规律及其主要影响因素,研究结果表明:
(1)植被生长良好的湿地土壤有利于细菌的生长,其细菌数量明显高于无植被土壤。
(2)土壤含水率、盐分、石油、有机质、总氮等是影响湿地土壤微生物数量的重要因素。土壤盐分对湿地异养细菌有明显的抑制作用;C/N增加对湿地异养细菌的生长有促进作用,且C/N比值为为10∶1左右是辽河口湿地微生物的最佳比值;
(3)石油污染对异养细菌有明显的抑制作用,且石油浓度越高,抑制作用越强。
由于异养细菌数量只能反映细菌的群体特征,并不能准确指示不同微生物类群的生态功能,因此,有必要采用分子生物学技术等现代生物学研究手段对异养细菌群落特征和生物多样性等进行深入研究,以便更好地阐明微生物在湿地生态系统中所发挥的生态功能。
[1] 肖笃宁.辽河三角洲的自然资源与区域开发[J].自然资源学报,1994,9(1):43-50.
[2] 张欣,周林林,李萌,等.辽宁盘锦双台子河口湿地生态环境需水量研究[J].水资源保护,2010,26(4):8-12.
[3] 于长斌.盘锦芦苇湿地河蟹养殖现状及发展对策[J].现代农业科技,2008(3):294-295.
[4] 王西琴,李力.辽河三角洲湿地退化及其保护对策[J].生态环境,2006,15(3):650-653.
[5] 中国标准出版社总编室.中国国家标准汇编252GB17365-17385[M].北京:中国标准出版社,1999.
[6] 赵先丽,周广胜,周莉.盘锦芦苇湿地土壤微生物特征分析[J].气象与环境学报,2006,22(14):64-67.
[7] Porter K G,Feig Y S.The use of DAPIfor identifying and counting aquatic microflora[J].Limnnolog and Oceanography,1980,25(5):943-948.
[8] 鲍士旦.土壤农化分析[M].北京:中国农业出版社,2000.
[9] 白洁,陈春涛,赵阳国,等.辽河口湿地沉积物硝化细菌及硝化作用研究[J].环境科学,2010,31(12):3011-3017.
[10] 徐惠风,刘兴土,白军红.长白山沟谷湿地乌拉苔草沼泽湿地土壤微生物动态及环境效应研究[J].水土保持学报,2004,18(3):115-117,122.
[11] Hunter P R,Gaston M A.Numerical index of the discriminatory ability of typing systems:an application of Simpson’s index of diversity[J].Journal of Clinical Microbiaology,1988,26(11):2465-2466.
[12] Rietz D N,Haynes R J.Effects of irrigationinduced salinity and sodicity on soilmicrobial activity[J].Soil Biology and Biochemistry,2003,35(6):845-854.
[13] 于长斌.盘锦芦苇湿地河蟹养殖现状及发展对策[J].现代农业科技,2008(3):294-295.
[14] Garten Jr C T,Cooper L W,Post IIIW M,et al.Climate controls on forest soil C isotope ratios in the southern Appalachian Mountains[J].Ecology,2000(81):1108-1119.
[15] Garten Jr C T,Wullschleger SD.Soil carbon dynamics beneath switchgrass as indicated by stable isotope analysis[J].Environ Quality,2000(29):645-653.
[16] Martin C,Johnson W.Variation in radiocarbon ages of soil organic matter fractions from late quaternary buried soils[J].Quaternary Res,1995(43):232-237.
[17] 王其兵,贺金生.长江三峡地区退化生态系统土壤异养细菌的初步研究[J].生物多样性,1997,5(4):241-245.
[18] 刘树,梁漱玉.芦苇湿地土壤有机质含量对芦苇产能的影响研究[J].现代农业科技,2008(7):232-234.
[19] 任磊,黄廷林.土壤的石油污染[J].农业环境保护,2000,19(6):360-363.
[20] Franco I,Contin M,Bragato G,et al.Microbiological resilience of soils contaminated with crudeoil[J].Geoderma,2004,121(1/2):17-30.
[21] 张晶,张惠文,张勤,等.长期石油污水灌溉对东北旱田土壤异养细菌生物量及土壤酶活性的影响[J].中国生态农业学报,2008,16(1):67-70.
[22] 韩言柱,王立成,许学工,等.河三角洲土壤(潮土)石油类含量对小麦的影响研究[J].环境科学与技术,2000,27(4):1-4.
[23] 李云辉,文荣联,莫测辉.土壤有机污染的植物修复研究进展[J].广东农业科学,2007(12):96-98.
[24] 周广胜,周莉,关恩凯,等.辽河三角洲湿地与全球变化[J].气象与环境学报,2006,22(4):7-12.
[25] 孙淑荣,吴海燕,刘春光,等.玉米连作对中部农区主要土壤微生物区系组成特征影响的研究[J].玉米科学,2004,12(4):67-69.
[26] 邓欣,谭济才,尹丽蓉,等.不同茶园土壤微生物数量状况调查初报[J].茶叶通讯,2005,32(2):7-9.
[27] 范君华,刘明.塔里木海岛棉生育全程土壤微生物与酶活性的动态变化[J].中国农学通报,2005,21(4):202-205.
Research on the Variation of Heterotrophic Bacteria and Its Main Effecting Facto rs in Liaohe Estuary Wetland
BA IJie1,2,YIN Ning-Ning1,ZHAO Yang-Guo1,2,TIAN Wei-Jun1,2
(1.College of Environmental Science and Engineering;2.The Key Lab of M arine Environmental Science and Ecology,Ministry of Education,Ocean University of China,Qingdao 266100,China)
The seasonal variation of heterotrophic bacteria(HB)and its main influencing factors were analyzed by field survey and field culture experiments in Liaohe estuary wetland.The results of the field survey show ed that the number of HB increased to the largest in June,and reduced to them inimum in October.The number was larger in the areas where reeds grew well than there no reeds grew.The field culture experiments showed that the number of the HB was affected by salinity,C/N ratio,petroleum oil and vegetation.The heterotrophic bacteria were inhibited by salinity and their numbers reduced rapidly.The increase of C/N ratio significantly stimulated the grow th of the heterotrophic bacteria,and the number of HB in the group of C/N ratio was 10∶1 increased by 2 times compared with the control group.Petroleum oil pollution significantly inhibited the grow th of HB.The number of HB reduced with increasing of petroleum oil pollutants.The number of HB in the reeds group was larger than the number in the without reed group.
estuary wetland;heterotrophic bacteria;effecting factors
X53
A
1672-5174(2011)7/8-113-06
国家水体污染控制与治理科技重大专项(2008ZX07208-009)资助
2011-03-04;
2011-04-23
白 洁(1962-),女,教授,博士,主要从事海洋微生物生态及在物质循环中的作用研究。E-mail:baijie@ouc.edu.cn
责任编辑 庞 旻
