北太平洋柔鱼生殖群体结构特征及繁殖生物学*
2011-01-08唐峰华伍玉梅
唐峰华,伍玉梅,樊 伟
(中国水产科学研究院东海水产研究所,农业部海洋与河口渔业资源及生态重点开放实验室,上海200090)
北太平洋柔鱼生殖群体结构特征及繁殖生物学*
唐峰华,伍玉梅,樊 伟**
(中国水产科学研究院东海水产研究所,农业部海洋与河口渔业资源及生态重点开放实验室,上海200090)
根据2010年6~9月北太平洋柔鱼(Ommastrephe bartramii)渔业的现场调查资料,分析了北太平洋柔鱼胴长和体质量组成结构、性比、初次性成熟胴长、群体成熟度指数等等基础性的渔业生物学参数,阐述了该海域柔鱼的种群结构动态及繁殖生物学的特征。结果表明:各月北太平洋柔鱼生殖群体中雌性个体数量大于雄性,且雌性个体的平均胴长及体质量均显著大于雄性;生殖群体中雌、雄个体胴长与体质量关系的差异极为显著;相同胴长组下雄性个体的性成熟率要高于雌性;北太平洋柔鱼初次性成熟胴长M L50%♀为261.83 mm;ML50%♂为255.60 mm,雄性初次性成熟胴长显著小于雌性;东部海区(170°W~178°W)生殖群体比例及个体大小明显高于西部海区传统作业渔场(150°E~160°E)。判断东西部海区柔鱼是否是同一群体,还需要连续性的调查,进一步分析其成熟度随时间的变化及利用耳石信息分析技术来确定,还可以用微卫星技术测定分析以及标志放流法来判定,结论更为准确。
柔鱼;北太平洋;种群结构;生殖群体;初次性成熟胴长
巴特柔鱼(Ommastrephe bartramii)又名柔鱼或枪柔鱼,作为大洋性种类,广泛分布于北太平洋整个海域,资源丰富[1]。日本于20世纪70年代初开始开发和利用这一资源。我国于1993年起开发北太平洋海域该资源,1994年始在北太平洋进行了大规模的商业性开发和利用,作业渔场不断地向东拓展,至2010年作业渔场已到达165°W,生产规模逐年扩大,鱿钓产量稳步上升。至今,各国学者对柔鱼种群分布、生长、繁殖、产卵等进行了较为广泛的研究[2-5]。国内学者对北太平洋柔鱼生殖群体和繁殖生物学方面的研究较多[6-8],但是随着时间的推移,该海域柔鱼资源的生物学特征可能有所变动。笔者根据2010年6~9月我国鱿钓船在北太平洋的现场调查,对鱿钓作业期间所采集的样本,及其胴长组成与性成熟度的关系进行初步研究,为了解和掌握北太柔鱼资源的现状及其分布规律,更好地掌握不同时期柔鱼的作业渔场,为鱿钓渔业产业和进一步深入研究柔鱼资源提供参考。
1 材料与方法
1.1 材料来源
柔鱼样本为北太平洋公海海域中国水产公司舟山海洋渔业公司生产船“1301”号进行的鱿钓渔获所得,时间为2010年的6~9月。其中6月鱿钓生产集中在东部海区170°W~178°W之间;7、8、9月集中在西部海区传统渔场150°E~157°E,每月随机选择8~12个站位,各站位的随机取样为10~20ind,符合统计学意义,具体站位如图1所示。样品全部进行现场生物学测定,对渔获的柔鱼生物量换算为每小时的尾数(单位:ind/h)。

图1 北太平洋柔鱼渔场调查站位Fig.1 Sampling stations of the fishing grounds of neon flying squid in the North Pacific Ocean
1.2 生物学测定
海上现场调查以及生物学测定依据《海洋调查规范》[9]进行。生物学测定包括腹胴长(M L)、体质量(BW)、性别、性腺成熟度等。胴长测定精确至1 mm,体质量精确至0.1 g。参考Earhardt[10]将性腺成熟度划分为I、Ⅱ、Ⅲ、Ⅳ、V五期,将性腺成熟度达到I、Ⅱ期的定为性未成熟群体,Ⅲ、Ⅳ期达到性成熟的定为生殖群体,V期的定为繁殖后群体。
整个调查期间共对438 ind柔鱼样本进行了性别及性成熟度的划分。
1.3 处理方法
1.3.1 性别比例 为检验生殖群体的雌、雄比例(♂/♀)是否符合1∶1的关系,对各月份柔鱼生殖群体的雌、雄比例进行χ2检验,并将各站点性别比例数据进行Logistic转化,随后进行单因素方差分析(onefacto r ANOVA),以检验不同月份不同海域柔鱼生殖群体的雌、雄比例是否存在显著性差异。
1.3.2 群体成熟度指数 利用群体成熟度指数(population maturity index,PM I)描述各站位及各月份太平洋柔鱼生殖群体的相对资源密度。依据Collins等[11]的方法,PM I表达式如下:
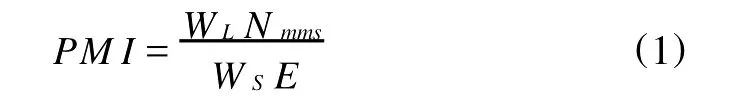
式中,WL为渔获质量;Nmms为样本中成熟的雌、雄个体数;WS为样本质量;E为以小时为单位的捕捞努力量。1.3.3初次性成熟胴长
(1)胴长组成采用频率分布法,组距为10 mm;(2)对不同胴长组内性成熟个体的比例和胴长组数据采用线性回归,拟合Logistic曲线,推算不同性别柔鱼的初次性成熟胴长[12]:

式中,Pi为成熟个体占组内样本的百分比;li为各胴长组(mm);a和b为参数;
初次性成熟胴长(M L50%)=-a/b。数据统计分析采用SPSS 16.0软件,显著性水平为0.05。
2 结果与分析
2.1 样本概况及性别比例
整个调查期间,共测定北太平洋柔鱼438ind,其中雌性263ind,雄性175ind。雌、雄个体的平均胴长分别为255和254 mm;平均体质量分别为587和582 g。各月北太平洋柔鱼雌性个体的比例均大于雄性,性别比例为0.52~0.72波动。卡方检验结果显示:6、9月性比关系不明显,雌雄比例接近符合1∶1的关系;7、8月性比关系显著,雌、雄比例悬殊。总性比为0.67,雌性个体数量显著多于雄性(χ2=17.28,P<0.001)(见表1)。

表1 各月份北太平洋柔鱼的样本概况及性比组成Table 1 Summary of examined samples and sex ratio of Ommastrephe bartramii in each month
2.2 生殖群体的组成
从调查渔获物北太平洋柔鱼样本的生物学测定的结果看,6、7、8、9月份均存在一定数量的生殖群体,尤其是6月东部海区(170°W~178°W)深水鱿钓的80%渔获都为成熟群体,4个月份生殖群体的出现率分别是85.09%、8.82%、12.26%、37.93%,群体成熟度指数顺序依次为7月<8月<9月<6月,东部海区柔鱼成熟率明显高于西部海区传统渔场(见表2)。

表2 各月份北太平洋柔鱼群体成熟度指数的变化特征Table 2 The variations of the PM I of Ommastrephe bartram i in each month
2.3 各月的性成熟度分布
将各月的性成熟度分为2大部分分析,性未成熟群体(Ⅰ+Ⅱ)和性成熟群体(Ⅲ+Ⅳ+Ⅴ)。如图2所示,6月东部海区以性成熟群体为主,比例高达85.09%;西部海区7、8、9月以性未成熟群体为主,其中7月高达91.18%,8月为87.74%,9月性成熟强度逐渐升高,未成熟群体下降至62.07%。

图2 各月的性成熟度比例Fig.2 Percentage of maturity stage in each month
2.4 胴长与体重的关系
不同性成熟度下,雌、雄柔鱼平均胴长见图3,及胴长与体质量的拟合关系见图4。雌性柔鱼各阶段性成熟度下的平均胴长依次显著升高:Ⅰ期为212 mm;Ⅱ期为242 mm;Ⅲ期为270 mm(270.16);Ⅳ期为315 mm;Ⅴ期为377 mm。雄性柔鱼各阶段性成熟度下的平均胴长依次同样显著升高:Ⅰ期为211 mm;Ⅱ期为241 mm;Ⅲ期为270 mm(269.59);Ⅳ期为301 mm;Ⅴ期为361 mm。可见相同性成熟度条件下,雄性个体的平均胴长小于雌性。
不同性成熟度下,雌、雄柔鱼胴长与体质量的关系分Ⅰ期、Ⅱ期、Ⅲ+Ⅳ期3项拟合。显而易见,成熟群体(Ⅲ+Ⅳ)的体质量显然高于同一胴长组下未成熟群体(Ⅰ期、Ⅱ期)的体质量;而且柔鱼在Ⅲ和Ⅳ期时,其胴长与体质量的生长拟合关系更显著。

图3 不同性成熟度下雌、雄柔鱼的平均胴长Fig.3 Average mantle length for females and males of Ommastrephe bartrami at different maturity stages

图4 不同性成熟度下胴长与体质量的拟合关系Fig.4 Relationship between mantle length and body weight of Ommastrephe bartrami at different maturity stages
为比较不同性成熟度下胴长与体质量关系的差异,对不同性腺成熟度的雌、雄个体进行方差分析,其中Log BW为因变量,性别为固定因素,Log M L为协变量。统计分析结果表明,雌、雄北太平洋柔鱼在不同性成熟度下胴长与体质量关系的差异均达到极显著水平(ANOVA,P<0.01),详见表3。

表3 性成熟度对胴长与体质量关系影响的协方差分析Table 3 Result of the ANCONA to test the effect of maturity stageson the relationship between mantle length and body weight
2.5 各胴长组的性成熟率
表4为各胴长组下北太平洋柔鱼雌、雄个体的性成熟率。传统作业渔场调查中,7、8、9月雌、雄个体性成熟比例随胴长组增大而升高的趋势。相比于雌性,雄性个体较早进入性成熟,同一胴长组下雄性个体的成熟比率相对要高于雌性。6月由于是在东部海区渔场的样品,小于220 mm胴长组的柔鱼未采到;在西部传统渔场,7月未采到大于280 mm的柔鱼,8月未采到大于310 mm的柔鱼,9月未采到大于320 mm的柔鱼。分析下表,初步可得280 mm是北太平洋柔鱼进入成熟群体的绝对胴长组。

表4 各胴长组柔鱼雌、雄性成熟率Table 4 Percentage of maturemales and females of Ommastrephe bartrami by mantle length classification/%
2.6 初次性成熟胴长
雌、雄北太平洋柔鱼性成熟度胴长的Logistic曲线见图5,拟合方程分别为:
雌性:Pi=1/(1+e-(-61.6894+0.2356l)i) R2=0.997 7,P<0.05
雄性:Pi=1/(1+e-(-50.3102-0.1968l)i) R2=0.998 6,P<0.05
雌性北太平洋柔鱼初次性成熟胴长(M L50%♀)为261.83 mm;雄性(M L50%♂)为255.60 mm。可见雄性初次性成熟胴长显著小于雌性。

图5 雌、雄北太平洋柔鱼的初次性成熟胴长Fig.5 Size at firstmaturity(ML50%)fo r females and malesof Omm astrephe bartram i
3 讨论
3.1 渔获群体结构
研究结果表明,在北太平洋海域6、7、8、9月均存在一定数量的北太平洋柔鱼生殖群体,在本次调查的东、西部海区也同样存在着生殖群体,且东部海区(170°W~178°W)生殖群体比例明显高于西部海区传统作业渔场(150°E~157°E)。各月份北太平洋柔鱼生殖群体中雌性个体数量始终大于雄性,且雌性个体的平均胴长及体质量均显著大于雄性;生殖群体中雌、雄个体胴长与体质量关系的差异极为显著;相同胴长组下雄性个体的性成熟率要高于雌性;北太平洋柔鱼初次性成熟胴长M L50%♀为261.83 mm;M L50%♂为255.60 mm,雄性初次性成熟胴长显著小于雌性。由于北太平洋柔鱼在1 a内即达到性成熟,雌、雄生活周期相同[13-15],通过以上可以判断,柔鱼雌、雄个体的性腺发育并不完全同步,雄性个体的性腺发育较快,较早进入性成熟阶段。出现这些雌、雄差异的原因,一方面可能是雄性繁殖期持续的时间较长,较早进入性成熟阶段;另一方面可能是雌、雄个体在生长速率上存在差异性,雄性的总体生长速度小于雌性。北太平洋柔鱼这种雌、雄差异性的繁殖机制,在该种头足类和其他种的研究中都有类似报道[16-18],这可能是短生活史周期的头足类为提高种群再生产能力所表现出来的1种生存和繁衍策略[19]。
雌、雄北太平洋柔鱼胴长与体质量均存在明显的幂函数的关系。但性腺发育对雌、雄个体胴长与体质量关系的影响较为显著,不同性腺成熟度间的差异达到了显著水平。由不同性腺成熟度下胴长与体质量的关系可知(见图4),在性腺发育初期,雌、雄个体体质量的增加主要来源于胴长的生长;待到性成熟阶段,性腺发育程度较高,迫于生长发育需求,摄食强度加大,性腺发育对个体体质量的贡献率较大,增长较为迅速。这与国外Perez[20]及国内杨林林等[21]相关的研究结果相类似。东部海区柔鱼生长个体较大,胴长与体质量的关系较稳定;西部海区柔鱼胴长与体质量关系逐月在变化,体质量随着胴长增大而升高。说明秋季(7、8、9月)和对应的西部海区150°E~157°E为北太平洋柔鱼摄食的高峰期(生长发育期)和重要的索饵场。本次调查研究因时间所限,未对渔汛后期10、11月北太平洋柔鱼的生殖群体进行研究,单就从7、8、9 3个月的调查结果来看,东部海区柔鱼群体的资源量逐月升高。这表明,秋季是该海区北太平洋柔鱼的1个主要生长季节,这与有关调查报道相吻合[22]。但是考虑到北太平洋渔场作业的外部环境因子,即各群系的资源状况受环境因素及捕捞作业强度的影响较大。整个北太平洋柔鱼的群系组成及发生量是不是有所变化,上升还是降低,还有待于结合渔汛后期柔鱼生殖群体以及总的资源状况进行全面的对比分析。
3.2 繁殖群体的分析
已有的研究表明,北太平洋柔鱼群系组成较为复杂,分为中部秋生群、东部秋生群、西部冬春生群和中东部冬春生群等4个群体[23-25],其中西部冬春生群为中国大陆鱿钓船的传统捕捞对象,主要捕捞区域为38°N~46°N、165°E以西海域,即本文7、8、9月调查的传统渔场海域;170°E以东为东部海区,该海域的柔鱼为东部秋生群。而笔者并不这样认为,根据各月份柔鱼群体成熟度指数的变化特征(见表2)可知,7、8、9月西部海区柔鱼处于生长发育期,而6月东部海区群体为性腺成熟度以后3期(Ⅲ、Ⅳ、V期)为主,成熟度处于稳定状态;同时连接西部和东部海区没有明显的分界线,也无实物障碍,是畅通无阻的,有可能这本是同一群体,即西部海域的下半年(7~12月)群体经过高度洄游到东部海域,随着时间的推移及柔鱼的生长,演变成东部海区的群体(本文调查中的6月柔鱼群体),理论上不排除这种可能性。到底是不是同一群体,还需要连续性的调查,进一步分析其成熟度随时间的变化及利用耳石信息分析技术[26-27]来确定,以及用微卫星技术测定分析[28]以及标志放流法来判定,结论更为准确。
根据对7月西部海区柔鱼群体的性成熟度组成的分析(见图2),性未成熟群体(Ⅰ、Ⅱ期)的幼体比例相当高,高达90%以上;其对应的胴长组和体质量组都是最低的(见表1和图3),胴长组小于250 mm,体质量组小于500 g。初步推断7月之前的时期为该北太平洋柔鱼群体的产卵繁殖期,以及150°E~157°E海域附近可能存在着产卵场,至于具体什么位置,还需要后续大量的调查数据,以及结合海表温、叶绿素a、浮游生物、饵料等环境因子来加以追踪分析和验证。
本研究对各月份北太平洋柔鱼性比、胴长结构、性腺成熟度、初次性成熟胴长和群体成熟度指数等进行了探讨。调查采集的各月样本量总体偏小,可能会对结果产生一定程度的影响。调查周期偏短,需要进行长时间的大范围连续取样加以补充分析。因此,北太平洋柔鱼的种群结构及繁殖生物学特征还需进行更为深入的研究。
致谢:本研究得到中国水产舟山海洋渔业公司之远海渔业部门陆良峰经理和朱金鑫科员的热情帮助,以及“1301”号船长和全体船员的大力支持,谨致谢忱!
[1] 王尧耕,陈新军.世界大洋性经济柔鱼类资源及其渔业[M].北京:海洋出版社,2005.
[2] Saito K.Distribution of palalarvae of Ommastrephes bartrami and Eucleoteuthis luminosa in the eastern waters off Ogasawara islands[J].Bulletin of the Hokkaido National Fisheries Research Institute,1994,58:15-23.
[3] Yatsu A,Watanabe T,Mo ri J,et al.Interannual variability in stock abundance of the neon flying squid,Ommastrephes bartram ii,in the No rth Pacific Ocean during 1979-1998:Impact of driftnet fishing and Oceanographic conditions[J].Fisheries Oceanography,2000,9(2):163-170.
[4] Hayase S.Distribution of spawning grounds of flying squid,Ommastrephes bartram ii,in the North Pacific Ocean[J].Japan Agricultural Research Quarterly,1995,29:65-72.
[5] Bower J.Estimated paralarval drift and inferred hatching sites for Ommastrephes bartramii(Cephalopoda:Ommastrephidae)near the Haw aiian Archipelago[J].Fishery Bulletin,1996,94(3):398-411.
[6] 郑元甲,严利平.1999年北太平洋海区柔鱼群体组成特征[J].远洋渔业,2000,3:7-14.
[7] 黄洪亮,郑元甲,程家骅.北太平洋海区柔鱼生物学特征研究[J].海洋渔业,2003,25(3):126-129.
[8] 孙满昌,张圣海,钱卫国.北太平洋中东部海域的柔鱼生物学特征研究[J].海洋渔业,2001,23(1):21-24.
[9] 国家质量监督检疫总局.海洋调查规范[M].北京:中国标准出版社,2008.
[10] Ehrhardt N M,Jacquenmin P,Garcia F,et al.On the fishery and biology of the giant squid Dosidicus gigas in the Gulf of California,Mexico[R].FAO.Advances in assessment of world cephalopod resources.Rome:FAO Fisheries Technical Paper NO.231.1983:306-320.
[11] Collins M A,Pierce GJ,Boyle PR.Population indicesof reproduction and recruitment in Loligo forbesi(Cephalopoda:Loliginidae)in Scottish and Irish waters[J].Jour App1 Ecol,1997,34(3):778-786.
[12] Tafur R,Villegas P,Rabi M,et al.Dynamics of maturation,seasonality of reproduction and spaw ning grounds of the jumbo squid Dosidicus gigus(Cephalopoda:Ommastrephidae)in Peruvian waters[J].Fish Res,2001,54(1):33-50.
[13] O’dor R K,Webber D M.The constraints on cephalopods:w hy squid aren’t fish[J].Can J Zool,1986,64(8):1591-1605.
[14] Okutani T.Todarodespacificus[M].∥Boyle P R.Cephalopod Life Cycles.London:Academic Press.1983:201-214.
[15] Nakamura Y,Sakurai Y.Validation of daily grow th increments in statoliths of Japanese common squid Todarodes pacificus[J].Nip Suis Gakk,1991,57(11):2007-2011.
[16] Gonzalez A F,Trathan P N,Rodhouse P G.Interactions between oceanography,ecology an d fishery biology of the ommastrephid squid Martialia hyades in the South Atlantic[J].Mar Eco1 Prog Ser,1997,152(1-3):205-215.
[17] Nigmatullin C M,Nesis K N,A rkhipkin A I.A review of the biology of the jumbo squid Dosidicus gigus(Cephalopoda:Ommastrephidae)[J].Fish Res,2001,54(1):9-19.
[18] Piatkow ski U,Hernandez-Garda V,Clarke M R.On the biology of the European flying squid Todarodes sagittatus(Lamarek,1798)(Cephalopoda,Ommastrephidae)in the Central Eastern Atlantic[J].SMr J Mar Sei,1998,20(1):375-383.
[19] 杨林林,姜亚洲,严利平,等.东海区太平洋褶柔鱼生殖群体结构特征的季节差异[J].海洋渔业,2009,31(4):376-383.
[20] Perez J A,Aguiar D C,Oliveira U C.Biology and population dynamics of the long finned squid Loligo p lei(Cephalopoda:Loliginidae)in southern Brazilian waters[J].Fisheries Research,2002,58:267-279.
[21] 杨林林,姜亚洲,程家骅.黄海南部太平洋褶柔鱼种群结构与繁殖生物学[J].生态学杂志,2010,29(6):1167-1174.
[22] 董正之.世界大洋经济头足类生物学[M].济南:山东科学技术出版社,1991.
[23] Yatsu A,M idorikaw a S,Shimada T,et al.Age and grow th of the neon flying squid,Ommastrephesbartramii,in the North Pacific Ocean[J].Fish Res,1997,29:257-270.
[24] Yatsu A,Tanaka H,Mori J.Population structure of the neon flying squid,Ommastrephes bartram ii,in the North Pacific[C].∥Okutani T.Contributed papers to International Symposium on Large Pelagic Squids.Tokyo:Japan Marine Fishery Resources Research Center,1998:31-48.
[25] Nagasawa K,Mori J,Okamura H.Parasites as biological tagsof stocks of neon flying squid(Ommastrephes bartram ii)in the North Pacific Ocean[C].∥Okutani T.Contributed Papers to International Symposium on Large Pelagic Squids.Tokyo:Japan Marine Fishery Resources Research Center,1998:49-64.
[26] 陈新军,马金,刘必林,等.性成熟和个体大小对西北太平洋柔鱼耳石形态的影响[J].水产学报,2010,34(6):928-934.
[27] 马金,刘必林,陈新军,等.利用耳石鉴定头足类年龄与生长研究进展[J].海洋渔业,2009,31(3):316-324.
[28] 冯建彬,吴春林,丁怀宇,等.洪泽湖日本沼虾9个野生群体遗传多样性微卫星分析[J].中国水产科学,2010,17(2):218-227.
Population Structure and Reproductive Biology of Mature Neon Flying Squid in the North Pacific Ocean
TANG Feng-Hua,WU Yu-Mei,FAN Wei
(The Key Laboratory of Marine and Estuarine Fisheries Resources and Ecology,Ministry of Agriculture,East China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Shanghai 200090,China)
Based on the data of field investigation on neon flying Squid(Ommastrephe bartramii)fishery in North Pacific Ocean from May to September 2010,this paper studied the population structure and reproductive biology of neon flying squid in this area,with the evaluation of the monthly patterns in size and weight structure,sex ratio,mantle length at first maturity,and population maturity index.The results showed sa following:the reproductive populations in females always were larger than that of males of neon flying squid,the average mantle length and weight in females were significantly greater than those of males.Individual differences of relationship of malesπand femalesπlength and weight were extremely significant.The sexual rate of males was higher than that of females under the same mantle length group.261.83 mm was the mantle length at first maturity of females,and 255.60 mm was mantle length at first maturity of males,mantle length at first maturity of males was significantly less than that of females.Proportion of mature group and body size in the eastern area(170°W~178°W)were obviously higher than that in the western area(150°E~160°E).To judge whether neon flying squids of the eastern and western areas were the same group or not,continuing investigation and further analysis on its maturity changing are still needed.Besides,statolith shapes information analysis technique,microsatellite technological,measurement analysis or logo discharge method can also be used to make an more accurate conclusion.
neon flying squid(Ommastrephe bartram ii);North Pacific Ocean;population structure;breeding population;mantle length at firstmaturity
S931.5
A
1672-5174(2011)7/8-072-07
国家高技术研究发展计划项目(2007AA 092202);国家科技支撑计划项目(2006BAD09A 05)资助
2010-11-10;
2011-02-28
唐峰华(1982-),男,实习研究员,主要研究方向为海洋生态学和渔业遥感研究。E-mail:f-h-tang@163.com
**通讯作者:Tel:021-65680117;E-mail:Fanwee@126.com
责任编辑 王 莉
