刺参雌核发育二倍体的诱导及其早期生长发育*
2011-01-08聂鸿涛于瑞海
聂鸿涛,李 琪,于瑞海
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
刺参雌核发育二倍体的诱导及其早期生长发育*
聂鸿涛,李 琪**,于瑞海
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
紫外线照射使精子遗传物质失活,用细胞松弛素B(CB)处理受精卵抑制第二极体释放,诱导刺参(Apostichopus japonicus)雌核发育二倍体。用强度为2561μW/(cm2·s)的紫外线(254 nm)照射不同时间的精子与正常卵子受精。结果发现随照射时间的增加,卵裂率、早期胚胎存活率和小耳幼虫发生率逐渐降低,照射30 s时小耳幼虫发生率降为0。受精后35 min,显微镜下观察到有20%~30%受精卵排出第1极体时,用浓度0.5μg/mL的CB持续处理受精卵20 min,诱导出刺参第二极体抑制型雌核发育二倍体,雌核发育二倍体发育速度低于正常二倍体。微卫星分析表明,雌核发育二倍体诱导成功率为93.3%。
刺参;紫外线照射;雌核发育;微卫星
人工雌核发育是快速建立纯合系、培育新品种、克隆及进行基因定位的有效手段。水产动物的人工雌核发育技术在鱼类中研究的较多[1-4],通过人工雌核发育技术培育出了多种经济鱼类的克隆品系,如草鱼、罗非鱼、香鱼、鲶鱼、真鲷和牙鲆等。在海洋贝类中,贻贝(Mytilus edulis)[5]、太平洋牡蛎(Crassostrea gigas)[6]、皱纹盘鲍(Haliotis discus hannai)[7]、地中海贻贝(M.galloprovincialis)[8]、华贵栉孔扇贝(ChlaMys nobilis)[9]、虾夷扇贝(Patinopecten yessoensis)[10]、栉孔扇贝(C.farreri)[11]和马氏珠母贝(Pinctadam artensii)[12]等种类也有研究报道,为基因着丝点作图、快速建立纯系、性别决定机制以及养殖新品种的开发等遗传学和育种学研究提供了非常宝贵的实验材料。迄今为止,棘皮动物的雌核发育研究仅在中间球海胆(Strongy locentrotus intermedius)[13]和马粪海胆(Hem icentrotus pulcherrim us)[14]有报道。
刺参(Apostichopus japonicus),俗称海参,属棘皮动物门(Echinodermata),海参纲(Holothuroidea),楯手目(Aspidochirotida),刺参科(Stichopodidae),主要分布在俄罗斯、日本和朝鲜半岛的北太平洋沿岸,在我国只分布于江苏连云港以北海域。自1990年代以来,刺参已成为中国海水养殖业中最受青睐的养殖对象。开展刺参雌核发育二倍体人工诱导研究对于开展基因-着丝点图谱构建、快速建立纯系具有重要意义。本实验以刺参为材料,研究了刺参雌核发育二倍体的人工诱导及早期生长特性,以期为海参的遗传育种研究提供素材。
1 材料与方法
1.1 材料
实验于2010年5~6月在山东海阳市海泰育苗场进行。亲参采自海阳沿海,挑选个体大,健壮的海参做为亲参。亲参入池后在水温18~20℃海水中暂养。采用阴干流水升温法诱导亲参产卵,阴干1 h,流水刺激30 min,放入升温海水(3~5℃)中,待其排精、产卵。亲参排放后分别将精卵浓度调整为5.0×106/m L和2.0×103/m L。水温维持在20~22℃,海水盐度30~32。
1.2 雌核发育二倍体的诱导
1.2.1 紫外线处理精子 将2.0 m L精悬液均匀分散于直径9.0 cm的塑料培养皿中,置于日本东芝公司生产的紫外灯(15 W)下15 cm处照射处理。用紫外线强度仪(美国Cole-Parmer公司)测得此条件下紫外线强度为2561μW/(cm2·s)。精子在紫外线下分别处理0、5、10、15、20、25、30、35、40、45、50、55和60 s[19]。照射结束后分别与10 mL卵液混合受精,在500 m L烧杯中孵化培养,温度保持20~22℃。实验重复3次。
1.2.2 卵子染色体的二倍化 根据精子紫外线照射条件的筛选,确定刺参精子遗传失活的最佳紫外线照射时间。将最佳紫外线照射时间处理后的精液加入100 mL卵液中。受精35 min后,显微镜下观察到有20%~30%受精卵排出第1极体时,用浓度0.5μg/mL的细胞松弛素B(CB)持续处理受精卵20 min。处理结束后用300目筛绢过滤洗卵,再放入0.1%的DM SO中浸泡30 min以去除残留的CB,然后移入砂滤海水中孵化培养。
授精后5 h统计分裂卵数占总处理卵数的百分比得到卵裂率,授精后20 h统计囊胚和原肠期胚胎数占总受精卵数的百分比得到早期胚胎存活率,授精后40 h统计小耳幼虫数占总幼虫数的百分比得到小耳幼虫发生率。每天随机测量雌核发育二倍体组和对照组幼虫的体长和体宽。采用不同的亲参,重复实验3次。
卵裂率(%)=卵裂细胞数/总观察卵数×100,
早期胚胎存活率(%)=上浮囊胚和原肠期胚胎数/受精卵数×100,
小耳幼虫发生率(%)=小耳幼虫数/总幼虫数×100。
1.3 DNA提取及微卫星分析
利用微卫星分析进行雌核发育二倍体的鉴定,以雄性亲本特异等位基因的有无作为判断是否为雌核发育后代。亲本基因组DNA参照Li等[15]用CTAB法提取,雌核发育二倍体子代采用48 h小耳幼虫,参照Li等[16]用Chelex树脂提取。微卫星引物的PCR反应体系、反应参数参照Li等[17]的方法。微卫星引物序列、GenBank注册号、重复序列及退火温度见表1。反应程序于GeneAmp 9700型PCR仪(App lied Biosystem s公司)上进行,扩增产物于6%变性聚丙烯酰胺凝胶电泳分离,银染显色。

表1 刺参微卫星引物序列和退火温度Table 1 Sequences and annealing temperature of microsatellite p rimers in A postichopus japonicus
2 结果
2.1 精子遗传失活
紫外线照射时间对刺参卵裂率、早期胚胎存活率、小耳幼虫发生率产生了较大影响。由表2可见,在各照射组中,刺参卵裂率、早期胚胎存活率、小耳幼虫发生率均随着紫外线照射时间的延长而逐渐降低,其中当照射时间达到30 s时,卵裂率为74.3%(对照组为98.0%),早期胚胎存活率为50.0%(对照组为92.2%),小耳幼虫发生率降低为0(对照组为88.8%)。
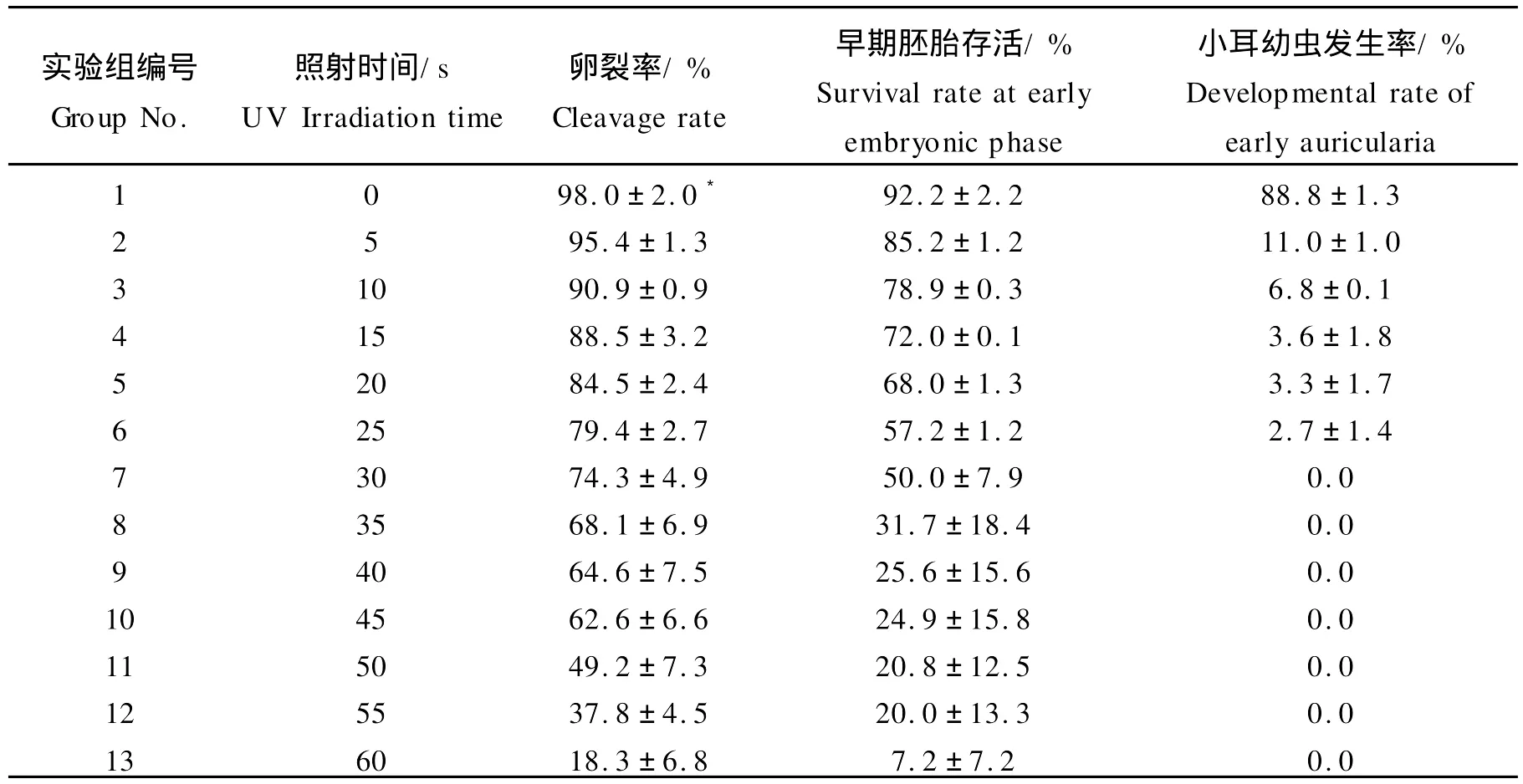
表2 紫外线照射时间与卵裂率、早期胚胎存活率和小耳幼虫发生率的关系Table 2 Different impact of UV irradiation time on cleavage rate,survival rate at early embryonic phase and developmental rate of early auricularia
本实验从遗传失活照射梯度的结果可以看出,紫外线照射5~25 s,均有正常的二倍体小耳幼虫出现,表明5~25 s的照射强度不足以使刺参精子染色体完全遗传失活。照射精子的时间达到30 s时,正常形态的二倍体小耳幼虫完全消失,全部为畸形的雌核发育单倍体,因此用强度为2561μW/(cm2·s)的紫外线照射30 s是获得刺参雌核发育单倍体的适宜剂量。
2.2 雌核发育二倍体人工诱导
表3显示了刺参对照组和雌核发育二倍体组(G2N)幼虫的发育速度。从表3可见,G2N组幼虫个体发育速度慢于对照组幼虫,第1天对照组有3.3%的小耳幼体,G2N组全为原肠期,第2天对照组有6.7%的中耳幼体,G2N组全为小耳幼体,第7天对照组有16.7%的大耳幼体,而G2N组没有发现大耳幼体。发育至第9天,对照组发现3.3%的樽形幼体,而G2N组没有发现樽形幼体。直至第11天,G2N组才出现樽形幼体,比例为5.9%,而此时对照组已投放附着基2 d,樽形幼体比例高达25%。
在生长方面,刺参对照组幼虫的体长和体宽都大于G2N组幼虫。图1显示了选育后1~9 d(G2N组和对照组均处于浮游幼虫阶段),对照组幼虫的体长和体宽均大于G2N组幼虫(见图1),说明附着变态前刺参雌核发育二倍体的生长速度滞后于正常二倍体。

图1 对照组和雌核发育二倍体组附着变态前的生长速度比较Fig.1 Grow th speed of larvae in control and gynogenesis groups before metamorphosis(?X±SD,n=3)

表3 对照组和雌核发育二倍体组附着变态前的发育速度Table 3 Development speed of larvae in control and gynogenetic dip loid groups beforemetamorphosis
从5对微卫星引物中筛选得到2对父本具有特异等位基因的位点,PCR扩增结果显示SJ33引物可扩增出清晰的亲本差异条带,父本存在特有等位基因(见图2)。比较亲本和子代的基因型,30个子代中有28个个体未出现父本的等位基因,表明是真正的雌核发育个体。此外,还有1个是正常二倍体(19),1个是污染个体(21)。本实验雌核发育二倍体诱导成功率为93.3%。
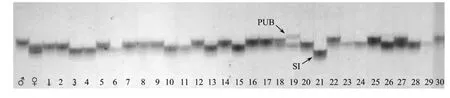
图2 引物SJ33在刺参亲本及雌核发育子代中扩增的微卫星图谱Fig.2 Microsatellite locus amplified by SJ33 primer pairs in A.japonicus gynogenetic family
3 讨论
人工诱导雌核发育需要精子的遗传失活和较高的卵裂率,紫外线照射剂量过大,则导致精子失去受精能力,剂量不足,则不能灭活精子遗传物质,得不到雌核发育个体。因此,要想获得雌核发育单倍体关键是筛选适宜的紫外线照射剂量,即能使精子染色体完全失活而又不影响其受精能力。据报道,太平洋牡蛎雌核发育中精子失活的最佳诱导剂量是紫外线照射强度1080μW/(cm2·s),照射时间5~6 min[6];皱纹盘鲍为720μW/(cm2·s),20 s[7];地中海贻贝为620μW/(cm2·s),2 min[8];栉孔扇贝为2561μW/(cm2·s),30 s[11]。因此,诱导精子遗传失活的紫外线照射剂量因种类不同而有所差异,同时与精液的密度和厚度有关。
研究表明,精子染色体遗传失活的原理是紫外线照射导致DNA氢键断裂,使胸腺嘧啶之间形成胸腺嘧啶二聚体(thyminedimers),造成双螺旋两链间的氢键减弱,DNA结构局部变形,进而使DNA的正常复制与转录受到严重影响[18]。本实验中卵裂率、早期胚胎存活率和小耳幼虫发生率均随着紫外线照射时间的延长而逐渐降低,其中照射30 s后小耳幼虫发生率降为0。随紫外线照射剂量的增加精子激活卵子的能力逐渐降低导致卵裂率逐渐下降,原因可能是精子的形态、结构和受精力受到破坏的程度增大,导致了精子受精能力的减弱,造成受精率的大幅下降[19]。Pan等[11]在栉孔扇贝雌核发育诱导和细胞学观察的研究中发现,紫外线照射引起的损伤不仅包括精子的顶体和鞭毛受到破坏,其内部构造如核膜、细胞膜、线粒体嵴等也同样受到伤害。
雌核发育个体的生长速度与正常个体有所不同,Scarpa等[8]报道地中海贻贝对照组幼虫的个体大小总是大于雌核发育个体,且其附着变态的时间也比雌核发育幼虫大约提前3周。Guo等[20]报道太平洋牡蛎雌核发育二倍体生长到8月龄时,与对照组个体大小差别很小。而侏儒蛤雌核发育个体发育到3月龄时,在大小和重量上与正常雌性个体没有显著差异Guo等[21]。Fujino等[22]则报道皱纹盘鲍雌核发育二倍体的个体大小与正常二倍体相比差异较大。据李琪等[23]的报道,栉孔扇贝雌核发育二倍体的个体大小在孵化后前3 d小于对照组,以后大于对照组。本研究发现人工诱导产生的刺参雌核发育二倍体幼体发育速度慢于正常二倍体。由于是相同亲本的精卵在同一环境中得到的实验结果,排除了亲本差异、卵质差异及孵化条件不同等因素的影响,推测可能是诱导过程中理化因素的改变造成发育速度滞缓。以前的研究表明,紫外线照射不仅造成精子遗传物质受到破坏,同时还引起了精子入卵后的行为变化[24]。卵子的成熟分裂以及雌雄性原核的形成虽不受紫外线照射影响,但经紫外线照射的精子会使卵的发生速度出现滞缓,此现象在栉孔扇贝[24]、太平洋牡蛎[25]和皱纹盘鲍[26]中也有相似的报道。
研究发现雌核发育的人工诱导过程中,紫外线照射剂量不足、照射不均一等因素都会导致精子遗传物质失活不彻底,致使父本部分基因参与遗传[19]。同时,Watson等[27]提出由紫外线引起的DNA损伤在特定的酶作用下可以被光修复,这同样可以导致父本染色体的部分基因参与遗传,因此有必要对雌核发育的真实性进一步确认。Li等[28]应用5对微卫星引物证实了太平洋牡蛎人工雌核发育诱导成功率为100%,即没有任何雄性基因参与遗传;杨凤影等[29]用5对微卫星引物对栉孔扇贝的雌核发育后代进行分析,雌核发育诱导成功率为70.2%。本研究用筛选出的2对微卫星引物对刺参雌核发育二倍体家系进行鉴定,雌核发育诱导成功率为93.3%。本研究结果进一步证明了微卫星标记鉴定方法是雌核发育鉴定分析的有效手段。
[1] Purdom C E,Thompson D,Lou YD.Genetic engineering in rainbow trout Salmo gairdnerii Richardson,by suppression of meiotic and mitotic metaphase[J].J Fish Biol,1985,27:73-79.
[2] Yamamoto E.Studies on sex-manipulation and production of cloned populations in hirame,(Temminck Schlegel)[J].Aquaculture,1999,173:235-246.
[3] Harald B T,Tillmann J B,Debo rah J M R,et al.Gynogenesis and sex determination in Atlantic Halibut(Hippoglossus hippog lossus)[J].Aquaculture,2006,252:573-583.
[4] Francesc P,Rosa M C,Castora G,et al.Induction of gynogenesis in the turbot(Scophthalmusmaximus):Effects of UV irradiation on sperm motility,the Hertwig effect and viability during the flint 6 months of age[J].Aquaculture,2004,238:403-419.
[5] Fairbrother J E.Viable gynogenetic diploid Mytilus edulis(L.)larvae produced by ultraviolet light irradiation and cytochalasin Bshock[J].Aquaculture,1994,126:25-34.
[6] Li Q,Osada M,Kashihara M,et al.Induction of gynogenetic diploids and cytological studies in the Pacific oyster,Crassostrea gigas[J].Suisanzoshoku,2000,48(2):185-191.
[7] Li Q,Osada M,Kashihara M,et al.Artificially induced gynogenetic diploid in the Pacific abalone,Haliotis discus hannai[J].Fish Genet Breed Sci,1999,28:85-94.
[8] Scarpa J,Komaru A,Wada K T.Gynogenetic induction in the mussel,Mytilus galloprovincialis[J].Bull Natl Res Inst Aquac,1994,23:33-41.
[9] Goswami U.Sperm density required for inducing gynogenetic haploidy in scallop Chla Mys nobilis[J].Indian J Mar Sci,1991,20:255-258.
[10] Li Q,Osada M,Kashihara M,et al.Effects of ultraviolet irradi-ation on genetical inactivation and morphological structure of sperm of the Japanese scallop,Patinopecten yessoensis[J].Aquaculture,2000,186:233-242.
[11] Pan Y,Li Q,Yu R,et al.Induction of gynogenetic diploids and cytological studies in the zhikong scallop,Chla Mys farreri[J].Aquat Living Resour,2004,17:201-206.
[12] 许国强,林岳光,李刚,等.人工诱导合浦珠母贝雌核二倍体发生及“Hertwig”效应的初步研究[J].热带海洋,1990,9:1-7.
[13] 丁君,常亚青,曹学彬,等.中间球海胆雌核发育单倍体胚胎的初步研究[J].大连水产学院学报,2004,19(1):10-15.
[14] 曹学彬,丁君,常亚青,等.人工诱导马粪海胆雌核发育的早期胚胎发育及细胞学观察[J].大连水产学院学报,2008,23(1):1-7.
[15] Li Q,Chen L M,Kong L F.A genetic linkagemap of the sea cucumber,Apostichopus japonicus(Selenka),based on AFLP and microsatellite markers[J].Animal Genetics,2009,40:678-685.
[16] Li Q,Park C,Kijima A.Allelic transmission of microsatellites and application to kinship analysis in new ly hatched Pacific abalone larvae[J].Fisheries Sci,2003,69:883-889.
[17] Li Q,Nie H T,Kong L F.Microsatellite-centromeremapping in zhikong scallop(Chla Mys farreri)through half-tetrad analysis in D-shaped larvae of gynogenetic diploid families[J].Aquaculture,2009,293:29-34.
[18] 楼允东.人工雌核发育及其在遗传学和水产养殖上的应用[J].水产学报,1986,10(1):111-123.
[19] 杨青,李琪,于瑞海,等.人工诱导栉江珧雌核发育的初步研究[J].中国水产科学,2006,13(2):310-315.
[20] Guo X M,Gaffney PM.Artificial gynogenesis in the Pacific oyster,Crassostrea gigas:II.allozyme inheritance and early grow th[J].J Hered,1993,84:311-315.
[21] Guo X M,Allen S K Jr.Sex determination and polyp loidy gigantism in the dwarf surf clam(M ulinia lateralis Say)[J].Genetics,1994,138:1199-1206.
[22] Fujino K,A rai K,Iwadare K,et al.Induction of gynogenetic diploid by inhibiting 2nd meiosis in the Pacific abalone[J].Nippon Suisan Gakkaishi,1990,56:1755-1763.
[23] 李琪,杨青,于瑞海.栉孔扇贝雌核发育二倍体早期成活与生长发育的研究[J].中国海洋大学学报:自然科学版,2007,37(3):399-404.
[24] 潘英,李琪,于瑞海,等.栉孔扇贝人工雌核发育的细胞学观察[J].水产学报,2004,28(6):616-622.
[25] Li Q,Osada M,Kashihara M,et al.Cytological observationson nuclear behavior in normal and gynogenetic eggs of the Pacific oyster Crassostrea gigas[J].Suisanzoshoku,2000,48:193-198.
[26] Li Q,Osada M,Kashihara M,et al.Cytological studies on artificially induced gynogenesis in the Pacific abalone[J].Fisheries Sci,2000,66:701-707.
[27] Watson JD.Molecular Biology of the Gene[M].London:W A Benjamin lnc,1975.
[28] Li Q,Kijima A.Microsatellite analysis of gynogenetic families in the Pacific oyster,Crassostrea gigas[J].J Exp Mar Biol Ecol,2006,331:1-8.
[29] 杨凤影,杨爱国,刘志鸿,等.人工诱导栉孔扇贝雌核发育后代的微卫星标记分析[J].水生生物学报,2008,32(5):680-686.
Artificial Induction of Gynogenetic Diploids and Early Grow th in the Sea Cucumber Apostichopus japonicus
N IE Hong-Tao,LIQi,YU Rui-Hai
(The Key Laboratory of Mariculture,Ministry of Education,Ocean University of China,Qingdao 266003,China)
Gynogenetic diploids in sea cucumber(A postichopus japonicus)were induced by means of ultraviolet(UV)radiation and cytochalasin B(CB)treatment for the inhibition of the second polar body release.The sperms irradiated by UV at an intensity of 2561μW/(cm2·s)for various durations were fertilized with the normal eggs.With increasing irradiation time,cleavage rate,survival rate at early embryonic phase and developmental rate of early auricularia decreased,and none of early auricularia occurred at 30 s.Thirty-fiveminutes later after fertilization,it could be observed under the op tical microscope that 20%~30%of eggs released the first polar body.Then the fertilized eggs were exposed to 0.5μg/m L CB for 20 min.Compared with those in the control group,the developmental speed in the gynogenetic diploid group was slower.Microsatellite analysis demonstrated that 93.3%of gynogenetic diploids were successfully induced.
Apostichopus japonicus;UV radiation;gynogenesis;microsatellite
S917
A
1672-5174(2011)09-031-05
山东省科技发展计划项目(2009GG10005013);高等学校博士学科点基金项目(20090132110018)资助
2010-11-25;
2011-03-20
聂鸿涛(1984-),男,博士生,从事水产动物遗传育种学研究。E-mail:nhtarnold361@yahoo.com
**通讯作者:Tel:0532-82031622;E-mail:qili66@ouc.edu.cn
责任编辑 王 莉
