羧甲基壳聚糖对肿瘤生长的影响研究*
2011-01-08刘万顺郑美玲韩宝芹亢寿海
刘万顺,郑美玲,韩宝芹,亢寿海,李 南
(1.中国海洋大学海洋生命学院,山东青岛266003;2.江苏省肿瘤研究所,江苏南京210008)
羧甲基壳聚糖对肿瘤生长的影响研究*
刘万顺1,郑美玲1,韩宝芹1,亢寿海2,李 南1
(1.中国海洋大学海洋生命学院,山东青岛266003;2.江苏省肿瘤研究所,江苏南京210008)
研究评价了不同分子量及不同取代度的3种羧甲基壳聚糖(CM-CTS)对肿瘤生长的影响。用MTT比色法测定3种CM-CTS对人正常肝细胞L02及3株肿瘤细胞:Bel-7402、SGC-7901及Hela生长的影响;EL ISA方法检测3种CMCTS对2种肝细胞L02及Bel-7402分泌TGF-α及VEGF水平的影响;建立小鼠移植性肿瘤Heps模型,腹腔注射分子量最大的CM-Ⅰ,研究CM-CTS的抑瘤作用。研究结果表明,分子量及取代度不同的3种CM-CTS在0.05~0.8 mg/mL浓度范围内,对L02细胞增殖具有显著促进作用,对Bel-7402、SGC-7901及Hela细胞的增殖则具有一定的抑制作用;3种CM-CTS能提高L02细胞TGF-α分泌水平,抑制Bel-7402细胞分泌TGF-α及VEGF水平;在动物水平上,CM-CTS能抑制小鼠Heps肿瘤生长,且量效关系显著。说明不同分子量及取代度的3种羧甲基壳聚糖对肿瘤生长具一定的抑制作用。
羧甲基壳聚糖;肿瘤;细胞因子
羧甲基壳聚糖(Carboxymethyl chitosan,CMCTS)是壳聚糖改性研究和应用研究最多的1种壳聚糖衍生物,具有良好的水溶性、优良的成膜性和保湿性等,在日化、食品、医药及医用生物材料等领域中具有广泛的应用前景[1]。CM-CTS作为生物医用材料在烧伤敷料、防术后黏连材料、药物载体及酶抑制剂等领域中研究较多[2]。CM-CTS含有-NH2和-COOH,其分子量和羧基取代度不同,使生物学活性存在较大差异。细胞水平的研究证明,CM-CTS具有促进正常细胞生长的作用[3],而其对肿瘤细胞生长的影响则报道较少,故开展CM-CTS对肿瘤生长的影响具有重要的理论意义和实际意义。本实验旨在研究不同分子量及不同羧化度的CM-CTS对人正常肝细胞L 02及3株肿瘤细胞:Bel-7402、SGC-7901及Hela体外增殖及相关细胞生长因子分泌水平的影响,以及对Heps小鼠肿瘤生长的影响,为CM-CTS在生物医用材料领域的应用提供实验数据。
1 材料与方法
1.1 材料
3种CM-CTS样品均由本实验室制备,分别标记为CM-Ⅰ、CM-Ⅱ及CM-Ⅲ。人正常肝细胞L 02及人肝癌细胞Bel-7402购自中国海洋大学药物研究所;人胃癌细胞SGC-7901及人宫颈癌细胞Hela由中国科学院上海生命科学研究院生物化学与细胞生物学研究所提供。4种细胞均于含10%新生牛血清的RPM I1640培养基中常规培养,0.25%胰酶消化传代;昆明种小鼠,雌雄各半,体质量(20±1)g,由南京安立默实验动物繁殖中心提供。Heps荷瘤小鼠购自北京鼎国生物科技有限公司。
1.2 试剂与仪器
RPM I1640培养基(Gibco),新生牛血清(Hyclone),胰蛋白酶和M TT(Sigma),人TGF-α和VEGF EL ISA试剂盒(上海劲马实验设备有限公司),其它试剂均为国产分析纯。
真空冷冻干燥机(Labconco),高效液相色谱仪(美国Waters),倒置显微镜(日本Olympus),超净工作台、BB16FCO2培养箱(上海力申科学仪器有限公司),Rayto2100C酶标仪(深圳雷杜生命科学有限公司)。
1.3 实验方法
1.3.1 材料纯化及性质研究 CM-Ⅰ、CM-Ⅱ及CM-Ⅲ样品于三蒸水中溶解透析,经0.22μm滤膜过滤,真空冷冻干燥。GPC-HPLC测定样品分子量,流动相:0.02M PBS溶液;流速:0.8 mL/min;柱温:35℃;示差检测器;右旋糖苷标样。采用电位滴定法测定羧基取代度[4]。
1.3.2 体外细胞增殖实验 取对数生长期L02、Bel-7402、SGC-7901及Hela细胞,胰酶消化后,调整细胞浓度为3×104/mL,接种于96孔板,每孔200μL。实验设不同浓度CM-CTS实验组,细胞对照组及空白对照组。常规培养24 h待细胞贴壁生长良好时,吸去原培养基,实验组分别加入含不同浓度CM-Ⅰ、CM-Ⅱ及CM-Ⅲ的RPM I1640培养基,每个浓度设5个重复孔,细胞对照组加入等量RPM I1640培养基。各组细胞分别培养2 d及4 d,M TT法测定其在492 nm处测吸光值,计算细胞相对增殖率(RGR):

上式中,D0,D1及D2分别为空白组,实验组及对照组的吸光值。
1.3.3 3种CM-CTS对L 02及Bel-7402细胞分泌生长因子水平的影响 细胞培养方法同1.3.2,实验设不同浓度CM-Ⅰ、CM-Ⅱ及CM-Ⅲ实验组、细胞对照组及空白对照组。不同组别的细胞采用无血清培养基。24 h后收集培养液,离心、收集上清液,按照EL ISA试剂盒说明书步骤进行操作,分别测量L02及Bel-7402细胞分泌TGF-α水平及Bel-7402细胞分泌VEGF水平。
1.3.4 体内抑瘤实验 取肿瘤生长旺盛的荷瘤小鼠,颈椎脱臼处死,无菌条件下取出瘤块,制备成单细胞悬液,调节细胞浓度为1×108/m L,接种于健康小鼠右前肢腋窝皮下,每只0.2 m L[5]。接种24 h后随机分为低、中、高剂量实验组和对照组,每组10只。由于实验经费和实验时间的限制,作者选择分子量最大的CM-Ⅰ作为受试物。实验组动物分别以75、150和300 mg·kg-1剂量腹腔注射CM-Ⅰ给药,隔日1次,连续2周。停药24 h后颈椎脱臼处死小鼠,称体质量,解剖剥离瘤块,称瘤质量。对照组平均瘤质量1 g以上可进行结果分析,计算抑瘤率:抑瘤率=(1-实验组平均瘤质量/对照组平均瘤质量)×100%。
1.4 数据的统计分析
实验数据以应用SPSS13.0软件进行统计学分析,组间比较采用方差分析(one way ANOVA),P<0.05有显著性差异。
2 结果
2.1 3种CM-CTS理化性质
3种CM-CTS样品均有良好的水溶性,分子量及羧化度测定结果如表1所示,其中CM-Ⅰ、CM-Ⅱ及CM-Ⅲ的分子量依次减小;CM-Ⅰ及CM-Ⅲ的羧基取代度相近,CM-Ⅱ羧基取代度较低。

表1 3种CM-CTS的主要物理性质Table 1 The Physical p roperties of three CM-CTS samp les
2.2 CM-Ⅰ、CM-Ⅱ及CM-Ⅲ对4种细胞增殖的影响
由表2可知,在0.05~0.8 mg/mL浓度范围内作用2 d时,CM-Ⅰ、CM-Ⅱ及CM-Ⅲ对人正常肝细胞L02的增殖均有显著的促进作用,RGR平均值基本一致,分别为110.8%、114.4%和113.4%。但3种受试物促生长作用的最优浓度不同,分别为0.3、0.8和0.1 mg/mL。在实验浓度范围内,CM-Ⅰ、CM-Ⅱ及CM-Ⅲ对人肝癌细胞Bel-7402的生长表现出一定程度的抑制作用(P<0.05),三者的抑制作用浓度范围分别为0.1~0.8 mg/mL(2 d)、0.05~0.8 mg/mL(2 d)及0.1~5.0 mg/mL(2 d),作用4 d时,生长抑制作用减弱;CM-Ⅰ、CM-Ⅱ及CM-Ⅲ对人胃癌细胞SGC-7901的生长表现出一定程度的抑制作用(P<0.05),在5.0 mg/mL时抑制效果最为明显,RGR可分别达55.6%(2 d)、79.1%(2d)及72.4%(2 d);对于Hela细胞,CM-Ⅰ、CM-Ⅱ及CM-Ⅲ在低浓度范围内对其生长作用不明显,在5.0 m g/m L时有一定程度的抑制作用,RGR分别为67.9%(2 d)、83.2%(2 d)及82.2%(2 d)。
2.3 CM-Ⅰ、CM-Ⅱ及CM-Ⅲ对细胞因子TGF-α及VEGF分泌的影响
TGF-α是1种参与调节正常细胞和肿瘤细胞增殖、分化的细胞因子,是正常肝细胞、肝癌细胞增殖分化过程中必不可少的有丝分裂原。由图1所示,CM-Ⅰ、CM-Ⅱ及CM-Ⅲ均显著促进人正常肝细胞L 02分泌TGF-α水平,其作用的浓度范围分别为0.1~5.0、0.1~0.8和0.1~5.0 mg/m L;同时,CM-Ⅰ、CM-Ⅱ及CM-Ⅲ均显著抑制人肝癌细胞Bel-7402分泌TGF-α水平,抑制作用的浓度范围分别为0.1~5.0、0.1~0.3及0.1~5.0 mg/mL。
VEGF是肿瘤诱导产生新生血管的最主要的细胞因子。由由图1可见,CM-Ⅰ、CM-Ⅱ及CM-Ⅲ能显著抑制人肝癌细胞Bel-7402分泌VEGF水平,三者抑制作用的浓度范围分别为0.1、0.1~5.0和0.1~5.0 mg/mL。
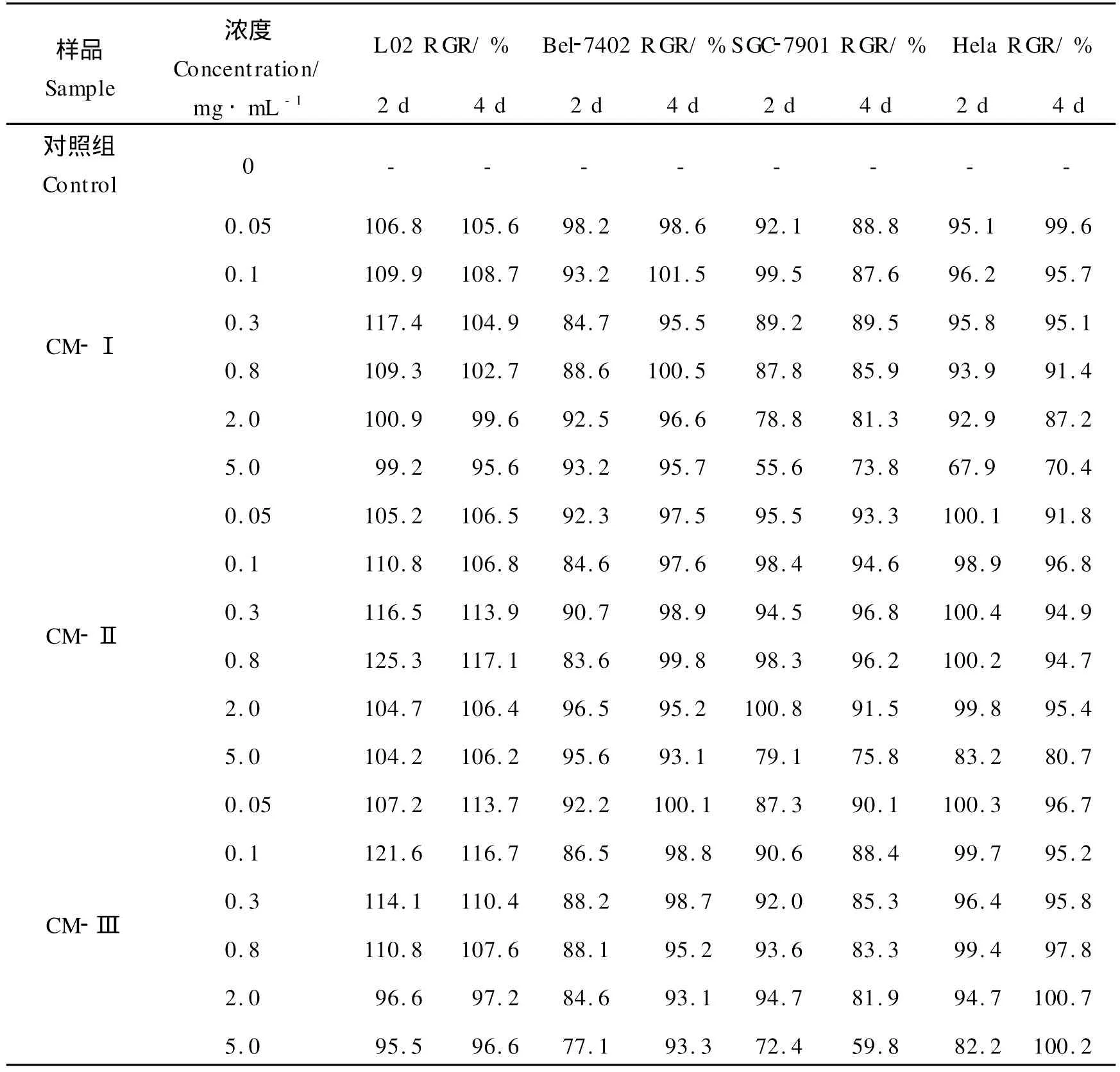
表2 3种CM-CTS对4种细胞增殖的影响Table 2 Effects of three CM-CTSon the proliferation of four cells(n=5,?x)

图1 3种CM-CTS对TGF-α及VEGF分泌的影响Fig.1 Effect of three CM-CTSon the secretion of TGF-αand VEGF(n=3,x?±SD,*P<0.05 vs control)
2.4 CM-Ⅰ对荷瘤小鼠肿瘤生长的影响
由表3和图2可见,不同剂量的CM-Ⅰ均能抑制小鼠实体瘤的生长。CM-Ⅰ在75,150及300 mg·kg-1时抑瘤率分别为12.9%,18.2%及22.1%(见表3)。与对照组相比,CM-Ⅰ对小鼠体重无显著性影响。在实验过程中,实验组小鼠生长状态较好,主要表现为活动、饮食量增加,皮毛光亮,表明CM-CTS对实验动物机体毒性较小。
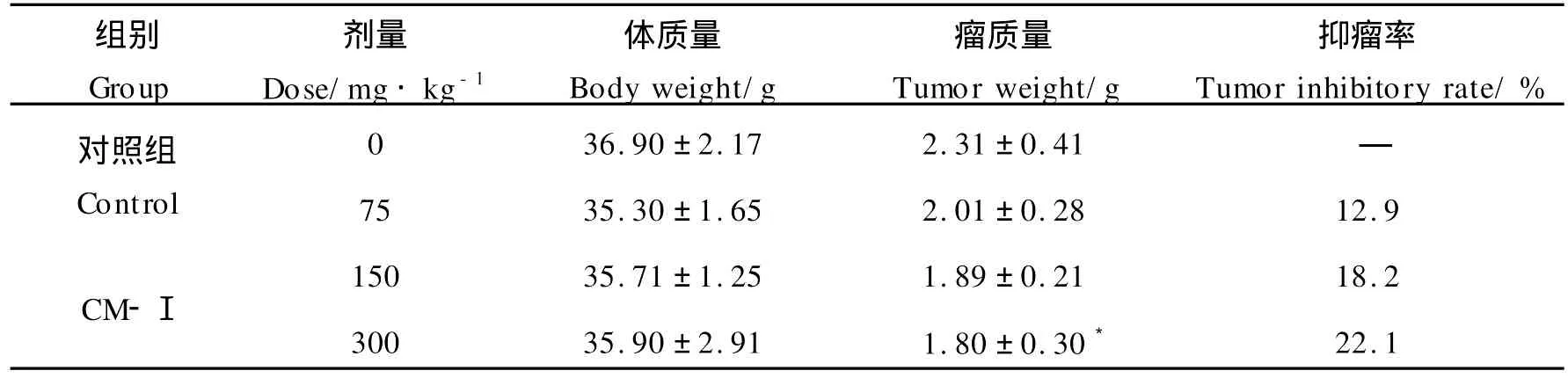
表3 CM-Ⅰ对Heps实体瘤模型小鼠肿瘤生长的影响Table 3 Effect of CM-Ⅰon the grow th of Heps tumo r in mice(n=10,?x±SD)
图2 CM-Ⅰ对小鼠Heps肿瘤形态的影响Fig.2 Effect of CM-Ⅰon the morphology of Heps tumo r
3 讨论
本文主要研究CM-CTS对肿瘤生长的影响。体外实验表明,CM-CTS对正常细胞和肿瘤细胞生长的影响表现出了相反的影响结果,3种不同分子量不同羧化度的CM-CTS在一定浓度范围内,对人正常肝细胞L 02的增殖均具有显著的促进作用,但对3株肿瘤细胞:Bel-7402、SGC-7901及Hela的增殖则表现出轻微抑制作用。在本文的研究中,CM-CTS的分子量和羧化度在对正常细胞和肿瘤细胞生长的影响中,没有较大的不同。体内实验显示,腹腔注射CM-Ⅰ机体毒性较小并对小鼠Heps实体瘤生长具剂量相关抑制作用,实验结果进一步验证了CM-CTS的抗肿瘤生长作用。
CM-CTS对正常细胞生长的促进作用已经在正常皮肤成纤维细胞[6]及角质形成细胞[3]的生长中得到验证;壳聚糖对肿瘤细胞生长的抑制作用分别在宫颈癌Hela细胞[7]及艾氏腹水瘤(EA T)细胞[8]生长研究中得到验;CM-CTS对人高转移肺癌细胞95-D的生长具抑制作用[9]。CM-CTS对正常细胞和肿瘤细胞生长的不同方向的调节作用,可能与正常细胞和肿瘤细胞结构不同有关,其作用机制有待进一步研究。
目前,CM-CTS体内抑制实体瘤生长的作用机制尚未清楚。杨靖亚等[10]发现灌胃给药CM-CTS能促进机体分泌IFN-γ、IL-2,增强N K细胞活性等增强机体免疫力,从而对S180实体瘤生长具抑制作用。刘艳如等[11]研究发现CM-CTS能提高小鼠巨噬细胞的吞噬百分率和吞噬指数,对小鼠外周血清溶血素抗体的生成和血凝素抗体积数生成有显著影响。因此,腹腔注射CM-CTS对Heps实体瘤生长的抑制作用的机制可能与其对机体免疫调节有关。
[1] Sun Liping,Du Yumin,Shi Xiaowen.A new app roach to chemically modified carboxymethyl chitosan and study of its moistureabsorp tion and moisture-retention abilities[J].Journal of Applied Polymer Science,2006,102(2):1303-1309.
[2] 赵丽瑞,孙多先,刘满英.羧甲基壳聚糖的性能及其在生物医学领域的应用[J].高分子通报,2007,8:43-47.
[3] 王征,刘万顺,韩宝芹,等.不同分子量羧甲基壳聚糖的制备及其对皮肤成纤维细胞和角质形成细胞生长的影响[J].生物医学工程学杂志,2007,24(2):340-344.
[4] 刘长霞,陈国华,孙明昆,等.N,O-羧甲基壳聚糖羧化度计算式的修正[J].北京化工大学学报,2003,31(2):14.
[5] 徐叔云,卞如濂,陈修.药理实验方法学[M].2版,北京:人民卫生出版社,1994:1423.
[6] Chen Xiguang,Wang Zhen,Liu Wanshun.The effect of carboxymethyl-chitosan on proliferation and collagen secretion of normal and keloid skin fibroblasts[J].Biomaterials,2002,23:4609-4614.
[7] 沈江波,林建立,张世馥.壳聚糖对人子宫颈癌HeLa细胞生长作用的研究[J].解剖学报,1997,28(4):421-423.
[8] Guminska M,Ignacak J,Wojcik E.In vitro inhibitory effect of chitosan and its degradation productson energymetabolism in Ehrlich ascites tumour cells[J].Pol J Pharmacol,1996,48(5):495.
[9] 杨靖亚,刘建文,刘承初,等.羧甲基壳聚糖对人高转移肺癌细胞—95-D增殖能力和体外转移能力的抑制作用[J].中国临床药理学与治疗学,2006,6:640-643.
[10] 杨靖亚,吴宏中,于有军,等.羧甲基壳聚糖抗肿瘤及免疫增强活性研究[J].中国临床药理学与治疗学,2007,12(12):1390-1394.
[11] 刘艳如,余萍.水溶性壳聚糖对小鼠免疫功能与移植性肿瘤的影响[J].福建师范大学学报:自然科学版,1999,15(4):66-70.
Study on the Antitumo r Effect of Carboxymethyl Chitosan
L IU Wan-Shun1,ZHENG M ei-Ling1,HAN Bao-Qin1,KANG Shou-Hai2,L INan1
(1.College of Marine Life Science,Ocean University of China,Qingdao 266003,China;2.Institute of Oncology of Jiangsu,Nanjing 210008,China)
The effects of three carboxymethyl chitosan(CM-CTS)with different molecular weights(MW)and different substituted degrees(DS)on the grow th of tumo r w ere studied.Effects of CM-CTS on the grow th of human no rmal liver cell L 02 and three tumo r cell lines:Bel-7402,SGC-7901 and Hela were measured by M TT assay,w hile levels of transforming grow th factor-α(TGF-α)and vascular endothelial grow th factor(VEGF)secreted by L 02 and Bel-7402 cells were measured by EL ISA.In vivo,tumo r modelsof Hep smice w ere established and CM-CTSwith the highestmolecular weight w as administered through intraperitoneal injection to investigate tumor inhibitory effect.CM-CTSwith different MW and different DS all p romoted the proliferation of L02 cells but slightly inhibited that of Bel-7402,SGC-7901 and Hela cellswithin the concentration of 0.05—0.8 mg/mL.They also could imp rove the TGF-α secretion of L02 cells,w hereas decreased TGF-αand VEGF secretion of Bel-7402 cells.CM-CTSalso inhibited the grow th of Heps tumor in a dose-dependentmanner.CM-CTSexhibited inhibitory effect on the grow th of tumo r bo th at cellular level and tissular level.
carboxymethyl chitosan;cancer;cytokine
[Q539+.7];R735.7
A
1672-5174(2011)09-036-05
国家高技术研究发展计划重点项目(2007AA091603)资助
2011-01-17;
2011-04-18
刘万顺(1950-),男,博导,从事生物化学与海洋生物材料研究。E-mail:WanshunLiu@hotmail.com
责任编辑 朱宝象
